Вакцинация против папилломавирусной инфекции в профилактике онкологических заболеваний
- Аннотация
- Статья
- Ссылки



В настоящее время определение природы онкологических заболеваний позволило создать две профилактические вакцины, способные предотвратить раковые заболевания – это вакцины, направленные против гепатита В и папилломавирусной инфекции.
Возбудителем ВПЧ-инфекции является безоболочечный ДНК-содержащий вирус, относящийся к роду А семейства паповирусов. Как было установлено, ВПЧ поражает базальные клетки эпидермиса и клетки базальной мембраны слизистых оболочек.
В мировом масштабе около 630 млн человек инфицировано ВПЧ (4). Исследования показали, что большинство женщин на протяжении жизни инфицируется данным вирусом. Так, например, до 82% женщин считаются инфицированными уже через 2 года после сексуального дебюта (D.R. Brown et al., 2005), при этом даже при одном партнере 20% женщин заражены (S. Ley et al., 1991). С течением времени вирус преимущественно элиминируется из организма самостоятельно, но у части женщин отмечается его персистирующее носительство. ВПЧ-инфекция, вызванная типами ВПЧ высокого риска, оставаясь невыявленной и нелеченной, может привести к развитию рака шейки матки (РШМ).
Известно, что РШМ возникает, если в тканях отмечаются персистенции высокоонкогенных типов ВПЧ (в Европе и РФ наиболее часто встречаются типы 16, 18, 31, 45).
Особенностью инфекции считают тот факт, что в силу эпителиофильности вируса в крови он не обнаруживается, а выработка антител иммунной системой отмечается далеко не во всех ситуациях инфицирования, по оценке экспертов – приблизительно в половине случаев. При этом уровень антител очень низок и не способен обеспечить длительную надежную защиту от развития заболевания, ДНК ВПЧ сохраняется в эпителии долгое время и при воздействии факторов риска может привести к развитию предрака и рака шейки матки, а также вульвы и влагалища. Поэтому Международная организация по исследованиям в области рака (IARC) заявляет, что предотвращение заражения и персистенции ВПЧ однозначно можно считать профилактикой РШМ. Другими словами, вакцина против ВПЧ является вакциной против РШМ.
Более того, учитывая тот факт, что онкогенные типы ВПЧ считаются в половине случаев причиной рака влагалища и вульвы, а также пениса у мужчин, вакцина может обеспечить их реальную профилактику (J.M. Walboomers et al., 1999; American Cancer Society. Available at: http://www.cancer.org. Herrero et al. 2003;. World Health Organization. Geneva, Switzerland, 1999). Кроме злокачественной патологии, которая является наиболее опасным следствием персистенции вируса папилломы онкогенных типов, известен целый ряд заболеваний генитальной и негенитальной областей, обусловленных ВПЧ низкого онкогенного риска (чаще всего типами 6 и 11), таких, как экзофитные кондиломы, субклинические формы инфекции гениталий, цервикальная интраэпителиальная неоплазия низкой степени, респираторный папилломатоз и т. п.
Большинство случаев требуют деструктивного лечения, которое нередко является неэффективным, значительных финансовых затрат здравоохранения, вызывают у женщин чувство тревоги и снижения самооценки и качества жизни в целом.
В настоящее время активно идут исследования по созданию терапевтических вакцин, которые нацелены на онкобелки Е6 и Е7 ВПЧ. Терапевтическая вакцина призвана помочь иммунной системе разрушить вирус, индуцировать клеточный иммунный ответ, направленный на элиминацию атипически измененных клеток. Вакцина должна быть эффективна при наличии предракового или даже ракового заболевания. Однако пока реальных результатов не получено.
Наибольшие успехи достигнуты в создании профилактической вакцины. Профилактическая квадривалентная вакцина против ВПЧ разных типов является методом первичной профилактики РШМ, экзофитных кондилом, заболеваний вульвы, влагалища, пениса и, возможно, части анальных раков. Она уже стала большим достижением современной медицины, зарегистрирована в целом ряде стран, в их числе и РФ. Квадривалентная вакцина внесена в Национальные календари многих стран, утверждена для тотальной профилактической вакцинации девочек 10-11 лет в США, Австралии и некоторых странах Евросоюза. Данная вакцина призвана помогать иммунной системе распознать и разрушить ВПЧ на ранней стадии контакта с возбудителем, тем самым предотвратить развитие клинических симптомов при инфицировании и обеспечить элиминацию из организма клеток, пораженных вирусом.
Механизм действия профилактической вакцины
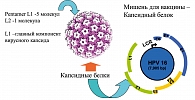
Процесс создания вакцины против ВПЧ был чрезвычайно сложным, поскольку до сих пор этот вирус не размножается и не выращивается на искусственных средах, в связи с чем его изучение затруднено. Мишенью реализации превентивного эффекта вакцины явился капсидный белок ВПЧ L1.
Как известно, сферическая поверхность вируса представлена 72 пентамерами, состоящими из двух капсидных белков L1 и L2 (так называемых поздних, от англ. late), из которых первый представляет собой главный компонент капсида (Baker et al., 1991). Капсидные белки образуют оболочку вируса, в которую упаковывается вирусная ДНК.
На ранних этапах инфицирования вирусом папилломы в эпителиальных тканях отмечается продукция большого количества поздних капсидных белков, которые и характеризуют начальную, продуктивную фазу вирусной инфекции. Именно поэтому белок L1, который выделяется вирусом максимально, был избран мишенью для создания профилактической вакцины (рисунок 1).
Механизмы иммунного ответа в человеческом организме известны, и принципы вакцинации базируются на двух главных характеристиках адаптивного иммунитета: специфичности и клеточной памяти. Иммунитет против ВПЧ является типоспецифическим или приобретенным в процессе контакта с инфекционным агентом. Введение вакцины приводит к значительной стимуляции выработки нейтрализующих антител, т.е. специальных протеинов, цель которых – распознавание и нейтрализация конкретных чужеродных белков, в данном случае – капсидных белков ВПЧ L1.
Антитела синтезируются В-лимфоцитами, которые имеют определенную ограниченную по продолжительности жизнь, поэтому стимуляция клеточной памяти при вакцинации – чрезвычайно важный компонент. Благодаря клеточной памяти при будущем контакте с возбудителем антигеном запускается процесс новой выработки нейтрализующих антител, что важно для создания долговременного иммунитета. Контакт с антигеном приводит к созданию комплекса антиген–антитело, которое легко распознается цитотоксическими клетками организма (макрофагами и т.п.), пораженная клетка разрушается, лизируется и выводится из организма вместе с генным материалом ВПЧ.
Дополнительно к антигену в вакцину обычно вводятся специальные вещества-адъюванты (например, соли алюминия, которые используются во многих современных вакцинах), которые значительно усиливают иммунный ответ. Работа над созданием более специфических и эффективных адъювантов непрерывно продолжается (18).
Революционной вехой в истории создания вакцины против ВПЧ явилось изобретение австралийскими учеными рекомбинантной вирусоподобной частицы, которая была синтезирована искусственным путем и которая не содержит геномного материала, т.е. ДНК ВПЧ. Вирусоподобная частица (VLP), которая в данной вакцине играет роль антигена, создается путем экзогенной экспрессии белка L1 в различных клеточных средах (дрожжи, бактерии, клетки насекомых и др.). Она не инфекционна, при электронной микроскопии не отличима от вириона ВПЧ, не способна вызвать инфицирование папилломавирусом, однако успешно стимулирует продукцию нейтрализующих антител, которые впоследствии связываются с капсидом вируса папилломы при инфицировании.
Клинические испытания и виды вакцин против ВПЧ
Предварительные испытания на животных, инфицированных вирусом папилломы, позволили доказать способность данной вакцины стимулировать антителообразование. Положительный предклинический результат in vivo тестирования послужил основой для дальнейшего развития и клинической оценки кандидатных вакцин против ВПЧ типа 16, затем типов 18, 6 и 11.
Сегодня завершена II стадия и проводится III стадия клинических испытаний разных видов вакцин, разработка которых реально началась в начале 80-х гг. XX в. Было показано, что вакцина вызывает образование иммуноглобулинов к белку L1 вируса папилломы, высокий уровень которых в эпителии генитального тракта и в крови поддерживается в течение длительного времени.
Клинические испытания на людях-добровольцах начались с 90-х гг. На первом этапе работ были сделаны уточнения дозировок, сравнение комбинированных вакцин с моновалентной вакциной, были предложены различные адъюванты, получены первые доказательства эффективности и приемлемости вакцин сначала на небольших популяциях, оценена иммуногенность разных вакцин, изучена скорость антителообразования после первой, второй и третьей доз вакцин, оценены титры антител.
Первоначальные данные послужили базой для проведения широкомасштабных плацебо-контролируемых клинических испытаний не только у женщин различных возрастных групп, но и у детей. За прошедшее время отмечены значительные успехи в процессе совершенствования вакцин и получены доказательства их эффективности и безопасности.
В настоящее время максимальный срок наблюдения в таких испытаниях составляет более 5 лет, продолжаются испытания на женщинах более старшего возраста, в том числе инфицированных ВПЧ и при наличии ВПЧ-ассоциированных заболеваний, а также на мужчинах и мальчиках (6-9). В настоящее время имеется информация о результатах испытаний трех видов вакцин.
Моновалентная вакцина, которая направлена против ВПЧ одного 16 типа, была предложена первой в мире. Содержит адъювант алюминия гидроксифосфата сульфат. Предварительные данные клинических испытаний на женщинах 16-23 лет (n = 2392) были опубликованы в 2002 г. и показали 100-процентную эффективность против персистирующей инфекции (Koutsky et al., 2002). В настоящее время данных о дальнейшем развитии данной вакцины нет. Предпочтение отдается комбинированным вакцинам, эффективным против разных серотипов ВПЧ.
Бивалентная вакцина, направленная против ВПЧ 16 и 18 типов, характеризуется новым адъювантом. Содержит адъювант алюминия гидроксид с монофосфорилом липида А. Первые серьезные результаты были опубликованы в 2004 г. (n = 1113, возраст (15-25 лет) – 100-процентная эффективность (D. Harper et al., 2004).
Квадривалентная вакцина, которая направлена против четырех типов ВПЧ (16, 18, 6, 11), содержит адъювант алюминия гидроксифосфата сульфат, показала высокую эффективность в профилактике не только РШМ, но и экзофитных кондилом (генитальных бородавок), а также рака вульвы и вагины. (Villa L.L. et al., 2005).
Клинические испытания вакцин, в которых приняли или принимают участие уже более 60 тыс. человек, проведенные в последние годы и проводимые в настоящее время, направлены на сравнительную оценку с группой плацебо следующих параметров:
- эффективность предотвращения – персистенции ПВИ, развития CIN I-III и РШМ, VIN II-III \ VaIN II-III, генитального кондиломатоза;
- иммуногенность – оценка уровня антителообразования при использовании разных адъювантов, подсчет титра антител;
- безопасность – побочные эффекты, осложнения, влияние на беременность, влияние на лактацию, состояние здоровья.
Квадривалентная вакцина Гардасил
В настоящее время более чем в 104 странах мира зарегистрирована квадривалентная вакцина Гардасил компании MSD, которая эффективна против ВПЧ типов 16, 18, 6, 11, следовательно, против РШМ, дисплазий шейки матки, вульвы и влагалища (CIN I-III,VIN II-III, VaIN II-III) и экзофитных генитальных кондилом. Она уже стала доступной для практического врача во многих странах, в том числе и России, и даже входит в Национальный календарь вакцинации в 6 странах, в том числе США.
Вакцина Гардасил содержит антигены в дозе 20 мкг ВПЧ-6, 40 мкг – ВПЧ-11, 40 мкг – ВПЧ-16 и 20 мкг – ВПЧ 18. Адъювант – 225 мкг аморфного алюминия гидроксифосфата сульфата. При создании данной вакцины системой экспрессии явились клетки грибов. Период наблюдения за вакциной на широких популяциях составил почти 6 лет (16). Схема введения: вакцина вводится внутримышечно в дельтовидную область недоминирующей руки в виде 3 инъекций с повторением через 2 и 6 месяцев (0-2-6). Иммуногенность вакцины чрезвычайно высока, и после третьей инъекции значимый титр антител определяется почти у 100% пациенток.
В программе клинических исследований вакцины Гардасил для оценки клинической эффективности были использованы суррогатные показатели: интраэпителиальные неоплазии шейки матки, влагалища и вульвы. Как видно из таблицы 1, эффективность против развития CIN составила 100% (таблица 1). Так, в группе 8460 женщин, получавших плацебо в течение 2-4 лет наблюдения, было диагностировано 53 случая цервикальной неоплазии. В группе вакцинированных не было выявлено ни одного случая.
При этом отмечено, что Гардасил оказывает выраженный протективный эффект на вульварный и вагинальный предрак. Так, в совокупной группе 8667 женщин, получавших плацебо, было диагностировано 24 случая указанной патологии, в группе 8641 вакцинированной женщины не было отмечено ни одного случая вагинальной или вульварной неоплазии. В отношении защиты от развития генитальных кондилом, вызванных входящими в состав вакцины штаммами ВПЧ, отмечена также почти 100-процентная эффективность.
Высокая клиническая эффективность и безопасность Гардасила подтверждена в совокупном анализе 4 рандомизированных плацебо-контролируемых клинических испытаний, выполняемых в соответствии с фазами II и III, участниками которых явились 20887 девочек и женщин от 16 до 26 лет.
В исследования безопасности и эффективности Гардасила были включены более 1000 подростков, в том числе здоровые девочки 10-15 лет (n = 506) и мальчики (n = 510). По результатам данного исследования доказано, что показатели иммуногенности при вакцинации детей и юных подростков (10-15 лет) профилактической вакциной L1 VLPs ВПЧ (6, 11, 16, 18 типов) не уступают показателям иммуногенности, полученным у молодых женщин 16-23 лет.
Показано, что частота местных и общих побочных эффектов не превышала 1% и отмечалась несколько чаще, чем в группе плацебо.
На Международной консенсус-конференции по ВПЧ-инфекции (2006) были представлены данные о том, что Гардасил нейтрализовал 2 дополнительных онкогенных штамма ВПЧ-31 и ВПЧ-45. Исследования в данном направлении продолжаются. Данная вакцина отнесена к категории В по беременности, что означает, что данных за негативное влияние вакцины на фертильность, беременность или плод не получено. Ее разрешено вводить кормящим женщинам.
Вакцина Церварикс
В нашей стране зарегистрирована и другая, бивалентная, вакцина (против 16 и 18 типов ВПЧ) – Церварикс компании GSK, результаты исследования которой опубликованы после почти 5 лет применения (5). Данная вакцина на сегодня зарегистрирована в Австралии, Великобритании и ряде других стран, в том числе в Евросоюзе.
Вакцина содержит антиген в дозе 20 мкг HPV-16, 20 мкг HPV-18. Система экспрессии – клетки насекомых. В данной вакцине используется новый адъювант АSO4 (Al + MPL) производства GSK. Схема вакцинации: 0, 1, 6 месяцев, вводится внутримышечно в дельтовидную область руки. Сероконверсия через 7 месяцев от начала вакцинации отмечается у 100% женщин, через 5 лет наблюдения титр стойко сохраняется у 98% пациенток (таблица 2). Отмечено, что среднегеометрические титры антител выше у более молодых женщин (3).
При клиническом испытании была показана 100-процентная эффективность вакцин для профилактики CIN и персистирующей ПВИ. Продолжаются наблюдения за более чем 18 000 женщин в возрасте от 15 до 25 лет, более 12 000 – от 18 до 25 лет. В настоящее время идут клинические испытания на женщинах старше 26 лет (D. Harper et al., 2006).
Считается, что использование нового адъюванта в бивалентной вакцине обеспечивает более высокий титр антител, но клиническая значимость более высоких уровней неизвестна, так как обе вакцины обеспечивают 100-процентную защиту от ВПЧ-инфекции.
Следует подчеркнуть, что бивалентная вакцина также безопасна и очень эффективна для молодых женщин и девочек для предотвращения развития цервикальных неоплазий и персистенции папилломавирусной инфекции. (D. Harper et al., 2004).
Отмечен ряд побочных эффектов, свойственных практически любой вакцине: возможность повышения температуры тела и появление кратковременного озноба, образование отека, припухлости в месте инъекции, болезненность, крапивницы. Значимой разницы в возникновении симптоматики в сравнении с группой плацебо не выявлено ни в одном испытании. Обще число осложнений, связанных с вакциной, невелико (таблица 3).
Внедрение профилактической вакцины в практику и перспективы
Как известно, комплексный подход к профилактике и борьбе против РШМ включает в себя различные виды воздействия в рамках широкого спектра мероприятий – от первичной профилактики с помощью внедрения образовательных программ с целью снижения факторов риска развития РШМ и вакцинации до раннего обнаружения, лечения и паллиативной терапии.
Достигнуты определенные успехи в программах цитологического скрининга, в разработке усложненных высокотехнологичных подходов с использованием ВПЧ-теста, внедрения биомаркеров, жидкостной цитологии, а также в разработке упрощенного подхода к раннему обнаружению предраковых состояний при помощи визуального осмотра шейки матки с помощью сосудистых тестов для регионов с низким уровнем доходов (ВОЗ, 2007).
Реальные последствия широкомасштабной вакцинации, которая приведет к реальному снижению заболеваемости и смертности от злокачественной патологии, ассоциированной с ВПЧ, по оценкам ученых, станут достоянием наших знаний не ранее, чем через два десятилетия.
Как показывают результаты математического моделирования, внедрение вакцины позволит существенно снизить заболеваемость РШМ в развитых странах. Так, если вакцинировать 75-100% населения Германии, то заболеваемость РШМ снизится на 53-70% – эффект через 15 лет (A. Schneider et al., 2006). По прогнозам многих исследователей, вакцинация пока полностью не может заменить скрининговые программы, однако позволит значительно снизить заболеваемость и смертность от ВПЧ-ассоциированных заболеваний, сократить расходы здравоохранения за счет увеличения интервала в скрининговых программах.
Первая лицензированная в нашей стране вакцина Гардасил зарегистрирована сегодня для использования у девочек и мальчиков до начала половой жизни, начиная с 9 лет, и женщин до 26 лет.
Продолжающиеся исследования, надо надеяться, позволят ответить на многочисленные вопросы, касающиеся вакцинации, сегодня остающиеся неясными. Более зрелые женщины, как полагают, также могут получить профилактический эффект, но не во всех случаях одинаковый. Так, ВПЧ-16/18 негативные женщины и ВПЧ-16/18 позитивные, но без титра антител, несомненно получат пользу от вакцинации имеющимися сегодня вакцинами. Для ВПЧ позитивных с наличием титра антител в крови перспектива пока считается неясной.
Не уточнены пока и другие вопросы, в частности, по необходимости тотальной вакцинации мальчиков, которую некоторые исследователи считают целесообразной для создания коллективного иммунитета и защиты от генитальных кондилом, однако эту точку зрения разделяют не все специалисты в связи с экономическими аспектами. Неясны вопросы по возможному замещению вакцинных типов вирусами других типов. Обсуждается также необходимость создания мультивалентной вакцины.
Следует еще раз подчеркнуть, что указанные вакцины являются профилактическими, а не лечебными.
Необходимость усиления образовательных программ среди врачей и населения
В связи с новыми знаниями в сфере генитальной папилломавирусной инфекции и изобретения вакцины против ВПЧ многие вопросы тактики ведения женщин пересматриваются и меняются. Конечно, создание вакцин против папилломавирусов открывает новые возможности профилактики заболеваний, которые ассоциированы с данным возбудителем. Как указывается ВОЗ, вакцины против ВПЧ могут служить важным дополнением и отправной точкой при введении в действие разработанной ВОЗ «Глобальной стратегии профилактики и борьбы с инфекциями, передаваемыми половым путем: 2006-2015 годы», одобренной 59 сессией Всемирной Ассамблеи здравоохранения в мае 2006 г. Программа вакцинации против ВПЧ дает также возможность усилить профилактические меры против ИППП в целом, поскольку в ходе ее реализации подростков убеждают отложить начало половой жизни на поздний срок и пользоваться презервативами. Вопросы внедрения вакцин в практику тесно связаны с развитием образовательных программ как среди медицинского персонала, так и среди населения.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.