Применение интерферона-α в форме суппозиториев для лечения ВПЧ-ассоциированной цервикальной интраэпителиальной неоплазии низкой степени
- Аннотация
- Статья
- Ссылки


Рак шейки матки (РШМ) является одной из наиболее часто встречающихся форм онкологической патологии женской репродуктивной системы (1, 11). Он составляет 12% всех злокачественных новообразований у женщин, занимая второе место по распространенности после рака молочной железы (36). В 2000 г. во всем мире диагноз РШМ был поставлен 468 тыс. женщин, 233 тыс. женщин умерли от этой болезни (13, 14).
Многочисленные эпидемиологические и молекулярно-биологические исследования подтверждают связь между злокачественным перерождением клеток и наличием в них генетического материала ВПЧ (3, 40). 99,7% случаев РШМ вызвано различными типами ВПЧ как при плоскоэпителиальных карциномах, так и при аденокарциномах (25, 37). В настоящее время роль вирусов папилломы человека в канцерогенезе рака шейки матки считается доказанной, а сам РШМ относится к заболеваниям, передаваемым половым путем, что отражено в пресс-релизе ВОЗ в 1996 г. (39).
Методы генодиагностики позволили установить, что ВПЧ 16 типа и родственные ему типы – 31, 33, 35, 52 и 58 – обнаружены в 67-69%, а ВПЧ 18-39, 45, 59, 68 – в 27% опухолей. В остальных 6% случаев выявлены ВПЧ умеренного риска – 53, 55, 56, 62, 66 (25, 37).
Ситуацию усугубляет широкое распространение ВПЧ-инфекции. Так, имеются данные, что почти 8% здорового населения выделяют с мочой вирус папилломы человека 16 типа, а среди пациенток гинекологических клиник этот показатель достигает 49% (2). Только в США ежегодно выявляется от 1 млн до 5,5 млн новых случаев ВПЧ-инфекции (26).
Классификация, предложенная Национальным институтом по изучению рака США (Bethesda system, 1988 г., пересмотрена в 1991 г.), подразделяет ВПЧ-ассоциированные плоскоклеточные интраэпителиальные поражения (SIL – squamous intraepithelial lesions) на две категории: низкой и высокой степени (LSIL и HSIL – low & high grade соответственно). Клеточные элементы, которые трудно поддаются классификации, обозначаются как атипические клетки плоского эпителия неопределенного значения (ASCUS – atypical squamous cells of undetermined significance). Плоскоклеточные интраэпителиальные поражения низкой степени тяжести объединяют цитологические изменения, указывающие на слабую дисплазию (CIN I) и ВПЧ-индуцированные морфологические изменения (койлоцитотическая атипия). SIL высокой степени тяжести включают умеренную дисплазию (CIN II), тяжелую дисплазию и карциному in situ (CIN III) (32).
Причиной недостаточной эффективности деструктивных методов лечения ВПЧ-инфекции шейки матки, наиболее широко использующихся в клинической практике, является удаление только поверхностного слоя эпителия без санации клеток базального слоя, которые являются постоянным источником новых инфицированных эпителиальных клеток, проходящих затем последовательные стадии дифференцировки с персистирующим репликативно неактивным вирусом (9).
В этой связи приобретают особую актуальность терапевтические методы, направленные на коррекцию показателей местного и системного иммунитета, которые повышают вероятность элиминации вируса эффекторными механизмами иммунной системы организма-хозяина.
Известно, что ВПЧ оказывает выраженное модифицирующее влияние на различные показатели иммунного гомеостаза, резко снижающее вероятность его элиминации и способствующее длительной персистенции.
В частности, ВПЧ не обладает цитопатическими свойствами и не разрушает кератиноциты, в которых происходит его размножение, ограничивая тем самым выход вирусных антигенов и их презентацию антигенпрезентирующими клетками (АПК). Отсутствие фазы виремии и очень медленный синтез капсидных белков за счет особенностей генетического кода еще более тормозят развитие противовирусного иммунитета (15). Продуцируемые ВПЧ белки Е6 и Е7 вызывают ингибирование биологических эффектов интерферона за счет блокирования ряда индуцируемых интерфероном генов и инактивации фактора регуляции интерферона IRF, который является фактором транскрипции генов, активируемых при действии на клетки интерферонов-a и -g. Интерфероны-a и -g, в свою очередь, подавляют продукцию данных белков ВПЧ, и итог этого противостояния определяется состоянием иммунной системы индивидуума (10, 34, 35). Помимо этого, белок Е6 связывается с интерлейкином-18, являющимся основным индуктором интерферона-g, что приводит к блокаде реакций клеточного цитотоксического иммунитета (28). Изучение уровня эндогенных ИФН-a и -g показало, что у больных с ПВИ отмечается угнетение их выработки до 40% и 50% соответственно (5). При этом ВПЧ-инфекция сопровождается снижением количества нормальных киллеров (NK) и HLA-DR-экспрессирующих клеток, с наибольшим угнетением у больных, инфицированных ВПЧ 16 типа (4).
Среди средств, применяемых для коррекции показателей иммунитета (в т.ч. супрессированных под влиянием ВПЧ), в отечественной и зарубежной практике наиболее широкое применение получили препараты интерферона-a.
Интерферон-a оказывает противовирусное, иммуномодулирующее и антипролиферативное действие. Противовирусный эффект опосредован активацией таких внутриклеточных ферментов, как протеинкиназа R, 2’-5’-олигоаденилатсинтаза и белки Mx, которые оказывают прямое ингибирующее действие на репликацию вирусов. Иммуномодулирующее действие проявляется в первую очередь усилением клеточно-опосредованных реакций иммунной системы, что повышает эффективность иммунного ответа в отношении вирусов, внутриклеточных паразитов и клеток, претерпевших опухолевую трансформацию. Интерферон-a активирует CD8+ Т-киллеры, NK-клетки, усиливает дифференцировку В-лимфоцитов и продукцию ими антител, активирует моноцитарно-макрофагальную систему и фагоцитоз, а также повышает экспрессию молекул главного комплекса гистосовместимости I типа, что увеличивает вероятность распознавания инфицированных клеток клетками иммунной системы (6, 7, 8, 17, 21).
Наиболее предпочтительной лекарственной формой интерферона-a для лечения заболеваний репродуктивной системы и, в частности, поражений шейки матки представляется форма суппозиториев. Особенности фармакокинетики интерферонов при их назначении в форме суппозиториев позволяют обеспечить максимальную концентрацию ИФН-a в органах и тканях малого таза, а также более длительное действие по сравнению с инъекционными формами. Активизация под воздействием интерферона при местном его применении лейкоцитов, содержащихся во всех слоях слизистой оболочки, обеспечивает их активное участие в ликвидации патологических очагов; кроме того, за счет влияния интерферона достигается восстановление продукции секреторного иммуноглобулина А. Это приводит к усилению защитных факторов эпителия слизистой оболочки и повышает терапевтическую эффективность интерферона при лечении урогенитальной патологии (12, 17).
Наиболее современным среди препаратов данной группы является отечественный препарат Генферон в форме суппозиториев, который с 2005 г. успешно используется в лечении урогенитальных заболеваний различной этиологии. Помимо интерферона человеческого рекомбинантного альфа-2b, данный препарат имеет в своем составе эпителизирующий и обезболивающий активные компоненты – таурин и анестезин (бензокаин), а также вспомогательные вещества, обеспечивающие потенцирование и пролонгирование терапевтического действия (16, 19).
Принимая во внимание широкий спектр терапевтических эффектов данного препарата (иммуномодулирующее, противовирусное, противоопухолевое, репаративное, противовоспалительное, мембранопротекторное, антиоксидантное и нормализующее метаболические процессы действие), он представляется перспективным для лечения цервикальной интраэпителиальной неоплазии, ассоциированной с высокоонкогенными типами ВПЧ.
Цель исследования – изучение терапевтической эффективности препарата Генферон (ЗАО «БИОКАД», Россия) для лечения плоскоклеточных интраэпителиальных поражений шейки матки низкой степени, ассоциированных с вирусами папилломы человека (ВПЧ) высокоонкогенного риска.
Материалы и методы
Дизайн исследования: сравнительное рандомизированное двойное слепое плацебо-контролируемое клиническое исследование.
В НЦАГиП Росмедтехнологий (Москва), НИИ акушерства и гинекологии им. Д.О. Отта РАМН (Санкт-Петербург) и УрНИИДВиИ МЗ и СР РФ (Екатеринбург) проводилось скрининговое обследование амбулаторных пациенток, включающее Пап-тест. В случае выявления признаков интраэпителиального поражения шейки матки низкой степени (LSIL или ASCUS) (выявление койлоцитоза или цервикальной интраэпителиальной неоплазии (CIN-I)), женщину знакомили с сущностью и условиями проведения исследования. После подписания пациенткой формы информированного согласия проводилось взятие материала для выявления ВПЧ методом Digene в референс-лаборатории.
В случае выявления ВПЧ высокого онкогенного риска по данным Digene-теста, пациентка включалась в исследование. Если на момент включения в исследование со дня забора материала для проведения Пап-теста прошло более месяца, проводился повторный Пап-тест. У всех пациенток, включенных в исследование, проводились кольпоскопия, бактериоскопический анализ вагинального мазка, а также ПЦР-диагностика вируса простого герпеса I и II типов (ВПГ I и II), цитомегаловируса (ЦМВ) и Chlamydia trachomatis в соскобе эпителия цервикального канала.
По результатам проводимой рандомизации включенные в исследование пациентки распределялись в одну из двух групп – опытную (получавшую исследуемый препарат) или контрольную (получавшую плацебо). Исследуемый препарат и плацебо поставлялись в исследовательские центры в белых неотличимых друг от друга упаковках, маркированных числом, соответствующим зашифрованному номеру серии. Шифровка и расшифровка номеров серий исследуемого препарата и плацебо осуществлялась в ГИСК им. Л.А. Тарасевича. Рандомизация (распределение случайным образом) пациенток в группы, получающие Генферон или плацебо, осуществлялась так называемым конвертным методом. Спонсор (ЗАО «Биокад») поставлял в исследовательские центры запечатанные конверты, в которых содержались зашифрованные номера серий. После включения пациентки в исследование выбранный случайным образом конверт вскрывался, и ей назначался препарат с соответствующим кодом.
Условием включения пациентки в исследование было ее соответствие критериям включения и несоответствие критериям исключения. Критериями включения были следующие: возраст 18-50 лет, интраэпителиальное поражение шейки матки низкой степени (LSIL или ASCUS), наличие ВПЧ высокоонкогенного риска, по данным Digene-теста, а также способность выполнять требования Протокола исследования и предоставление информированного согласия. К критериям исключения относились беременность и лактация, соматические заболевания в стадии декомпенсации, гиперчувствительность к любым компонентам исследуемого препарата, применение противовирусных или иммуномодулирующих препаратов в течение 3 предшествующих месяцев, HSIL или рак шейки матки, подтвержденная ВИЧ-инфекция, а также наличие психоневрологических заболеваний.
Методы лабораторной и инструментальной диагностики включали Digene-тест, Пап-тест, ПЦР-диагностику, бактериоскопию и кольпоскопию. Digene-тест – единственный метод, одобренный FDA для цервикального скрининга и зарегистрированный Федеральной службой по надзору в сфере здравоохранения и социального развития РФ. Для проведения ПЦР-диагностики были использованы тест-системы, зарегистрированные в МЗ и СР РФ и/или получившие сертификаты производства ГИСК им. Л.А. Тарасевича. Цитологическое исследование цервикального мазка на наличие признаков атипии с окрашиванием по Папаниколау (Пап-тест) является международным стандартом цитологической диагностики полученного из шейки матки материала. Забор мазка осуществлялся при помощи специальных щеток – эндобрашей и шпателей Эйра, полученный материал окрашивался по Папаниколау, после чего результаты оценивались в соответствии с цитологической классификацией Bethesda. Кольпоскопия проводилась при помощи кольпоскопа фирмы Leisegang, Германия, с использованием традиционных сосудистых тестов и увеличением ´7,5, ´15, ´30.
Согласно Протоколу исследования, введение суппозиториев Генферон в дозировке 500 000 МЕ или внешне неотличимых от них суппозиториев плацебо, не содержащих ИФН-a и таурин, осуществлялось интравагинально 2 р/сут в течение 10 дней с последующим назначением 1 р/сут через день в течение 3 месяцев.
На протяжении всего исследования женщины использовали барьерные методы контрацепции и вели дневник, в котором отмечались побочные эффекты терапии, их выраженность и продолжительность.
Через 3 месяца (визит 2) после первого введения суппозиториев проводились Пап-тест, кольпоскопия, Digene-тест на ВПЧ высокого онкогенного риска, бактериоскопический анализ содержимого влагалища, осуществлялась ПЦР-диагностика на другие инфекции в соскобе эпителия цервикального канала.
Через 6 месяцев (3 визит) женщинам, включенным в исследование, проводились Пап-тест, Digene-тест и кольпоскопия, проверялись дневники, где были записаны все препараты, которые пациентки принимали на протяжении исследования с момента подписания информированного согласия до заключительного визита. Оценивались локальные и системные эффекты, которые могли бы быть связаны с использованием препарата. Переносимость и безопасность препарата оценивались по частоте и выраженности нежелательных явлений.
Возможность досрочного выбывания из исследования была предусмотрена на любом этапе клинических испытаний – как по инициативе пациентки, так и по инициативе исследователя. Причины выбывания указывались в истории болезни и индивидуальной регистрационной карте (ИРК). В случае проведения хирургического лечения плоскоклеточного интраэпителиального поражения шейки, а также применения противовирусных препаратов в процессе исследования, пациентка исключалась из исследования.
ИРК пациенток заполнялись на основании опроса и осмотра, данных клинического обследования и лабораторных исследований.
По завершении исследования формировались два массива данных, которые подвергались анализу.
Критериями эффективности применения препарата являлись регресс ВПЧ-ассоциированных изменений шейки матки по данным Пап-теста и кольпоскопии, а также достижение отрицательного результата Digene-теста на ВПЧ высокого онкогенного риска.
В зависимости от поставленных конкретных задач, типа и вида распределения данных использовались соответствующие статистические критерии. Полученные данные обрабатывались методами вариационной статистики, использовались описательная статистика и непараметрический анализ данных (критерий Хи-квадрат с поправкой Йейтса). Для статистического анализа частотных показателей использовался метод углового преобразования Фишера (вычисление ФИ* критерия). Различие между сравниваемыми величинами признавалось достоверным при p < 0,05.
Результаты
Из 78 женщин, принимавших участие в исследовании, завершили исследование 72, из них 38 получавших Генферон, и 34 получавших плацебо. 5 пациенток выбыли из исследования по собственной инициативе (не пришли на заключительный визит), одна была исключена ввиду выявленного на мониторинговом визите нарушения критериев включения.
Проведенная рандомизация позволила сформировать группы сравнения, достаточно однородные по исходным характеристикам. У 100% пациенток обеих групп имел место положительный результат Digene-теста, статистически значимых различий по результатам Пап-теста не отмечалось. В группе, получавшей Генферон, была выявлена несколько большая частота встречаемости патологических изменений при кольпоскопии (81,5% и 65%, соответственно; p < 0,05), а также большая частота отклонений от нормальной картины при бактериоскопии (11 и 5 случаев, соответственно), что говорит о несколько худшей клинической картине у пациенток опытной группы. Результаты статистической обработки исходных данных по кольпоскопии и Пап-тесту приведены в таблице 1.
Результаты бактериоскопии и ПЦР. У пациенток, получавших Генферон, на день 0 было выявлено 11 случаев различных отклонений от нормальной картины (лейкоцитоз, бактериальный вагиноз, выявление дрожжевых грибов и т.д.). На 90-й день нормализация была отмечена у 9 пациенток, у 2 картина осталась без динамики, и еще у двух, у которых ранее была нормальная картина, был выявлен лейкоцитоз. ПЦР-диагностика выявила наличие у 3 пациенток вируса простого герпеса (ВПГ) и у одной – хламидий на день 0. На день 90 у трех пациенток возбудители были элиминированы, у одной сохранялся ВПГ.
В контрольной группе на день 0 было выявлено 5 случаев различных отклонений от нормальной картины (бактериальный вагиноз, лейкоцитоз и т.д.). На 90-й день нормализация была отмечена у 4 пациенток, у одной сохранялся бактериальный вагиноз, и еще у одной, у которой ранее была нормальная картина, были выявлены дрожжевые грибы. Проведение ПЦР в день 0 выявило у 1 пациентки, получавшей плацебо, наличие ВПГ 1 типа и цитомегаловируса (ЦМВ), на 90-й день у этой пациентки был выявлен только ВПГ 1 типа. Кроме того, у 1 пациентки на 90-й день был выявлен ВПГ 1 типа, не обнаруженный в день 0.
Результаты кольпоскопии. Отклонения от нормы при кольпоскопии представляли собой патологические зоны трансформации эпителия шейки матки. Обнаруживались участки ацетобелого эпителия вне и в пределах зоны трансформации шейки матки, йоднегативная и йодпозитивная мозаика, пунктация, гиперкератоз, йоднегативные участки. У 7 пациенток были также кольпоскопически выявлены остроконечные кондиломы. Нормальная кольпоскопическая картина при скрининге наблюдалась у 7 из 38 пациенток опытной и у 12 из 34 пациенток контрольной группы.
В результате трехкратного проведения кольпоскопии у 16 пациенток из 31 (51,6%), имевших отклонения от нормы при кольпоскопии на скрининге и получавших Генферон, и у 10 пациенток из 22 (45,5%), получавших плацебо, выявлен регресс патологических изменений эпителия шейки матки (p > 0,05). Таким образом, статистически значимых различий между группами по данному критерию выявлено не было.
Результаты цитологического исследования. Пап-тест при скрининге выявил патологические изменения у всех участвовавших в исследовании пациенток. Основным цитологическим признаком цервикальной интраэпителиальной неоплазии считается наличие клеток с койлоцитозом, которые были обнаружены в мазках у подавляющего большинства пациенток, кроме того, часто наблюдались дискератоцитоз, дискариоз, многоядерные клетки. В зависимости от локализации материала мазка и наличия эктопии с зоной трансформации, в мазки также попадали неизмененные клетки многослойного плоского эпителия, метапластические клетки, базальные/парабазальные клетки и клетки цилиндрического эпителия. Исходно картина, соответствующая LSIL, была установлена у 30 (79%) пациенток опытной и у 26 (76,5%) пациенток контрольной группы, ASCUS – у 8 (21%) и 7 (20,5%) женщин, соответственно.
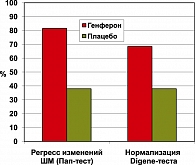
У 31 из 38 пациенток (81,5%), получавших Генферон, трехкратное проведение Пап-теста выявило полный или частичный регресс ВПЧ-ассоциированных изменений шейки матки. У 22 пациенток результат ПАП-теста был нормальным к 180-му дню, а у 14 – уже к 90-му дню. На 180-й день полный или частичный регресс ВПЧ-ассоциированных изменений шейки матки наблюдался у 13 из 34 пациенток (38%), получавших плацебо, у двух пациенток была отмечена некоторая прогрессия. Таким образом, были установлены статистически высокодостоверные (p < 0,001) различия по данному критерию между группами, получавшими Генферон или плацебо.
Результаты Digene-теста. У 26 из 38 пациенток (68,5%), получавших Генферон, трехкратное проведение Digene-теста выявило достижение отрицательного результата (менее 0,8 ЕД). У 4 пациенток (19%) результат Digene-теста на 180-й день был сомнительным (от 0,8 до 1,0 ЕД), у 4 пациенток количество ВПЧ достоверно снизилось, и у 4 наблюдалось прогрессирование содержания ВПЧ. Таким образом, применение Генферона в 89,5% случаев приводило к элиминации ВПЧ или снижению его содержания. В группе пациенток, получавших плацебо, отрицательный результат Digene-теста был достигнут у 13 из 34 женщин (38%), у 4 пациенток наблюдалось прогрессирование содержания ВПЧ, а у 5 – его незначительный регресс. Статистические различия по данному критерию между опытной и контрольной группами также были высокодостоверны (p < 0,01).
Результаты Пап-теста и Digene-теста отражены графически на рисунке 1.
Данные статистической обработки результатов кольпоскопии, цитологического исследования и Digene-теста приводятся в таблице 2.
Нежелательные явления наблюдались у 6 (16%) пациенток, получавших Генферон, и у 2 (6%) пациенток, получавших плацебо. Нежелательные явления проявлялись в виде легкой головной боли или зуда половых органов в первые дни лечения, характеризовались как легкие, носили преходящий характер, не требовали медикаментозной коррекции и не привели к выбыванию пациенток из исследования. Лишь у одной пациентки, получавшей Генферон, возникли зуд и гиперемия вульвы, потребовавшие приостановки лечения на 3 дня, после чего оно было возобновлено; при этом повторного появления описанных симптомов не отмечалось. Таким образом, можно утверждать, что вагинальное применение препарата Генферон в дозе 500 000 МЕ на протяжении более чем 3 месяцев безопасно и хорошо переносится больными.
Обсуждение результатов
В настоящее время имеется значительное число данных проведенных в зарубежных странах клинических исследований эффективности применения интерферона-a для лечения ВПЧ-инфекции, в том числе и цервикальной интраэпителиальной неоплазии. При этом наблюдается достаточно четкая закономерность, когда местное применение (преимущественно в виде инъекционного введения интерферона в очаг поражения, а также аппликаций содержащего интерферон крема) позволяет добиться достаточно высокой эффективности (24, 27, 29, 30, 38), в то время как системное инъекционное введение оказывается безрезультатным (22, 23, 31, 33). Вероятно, системное применение интерферона не позволяет создать его концентрацию в очаге инфекции, необходимую для элиминации возбудителя, что достигается при местном применении. Кроме того, системное введение интерферона часто сопровождается рядом побочных эффектов, в частности – гриппоподобным синдромом, что ставит под сомнение целесообразность системного применения ИФН при лечении ВПЧ-инфекции репродуктивной системы.
Среди лекарственных форм интерферона для местного применения наибольшего внимания заслуживают суппозитории, т.к. при их применении риск передозировки и связанных с этим нежелательных явлений гораздо ниже, чем при инъекционном введении. Кроме того, их применение обеспечивает максимальную концентрацию ИФН-a в органах и тканях малого таза и более длительное действие по сравнению с инъекционными формами. Еще одним безусловным преимуществом является удобство амбулаторного применения суппозиториев и отсутствие дискомфорта для пациента.
Наиболее прогрессивную комбинацию активных компонентов среди препаратов интерферона в форме суппозиториев имеет препарат Генферон. Сочетание интерферона-a, таурина и анестезина обеспечивает иммуномодулирующее, противовирусное, противоопухолевое, репаративное, противовоспалительное, обезболивающее, мембрано- и гепатопротекторное, антиоксидантное, радиопротекторное и нормализующее метаболические процессы действие. Эффективность данного препарата при лечении ВПЧ-инфекции уже была продемонстрирована в нескольких ранее проведенных клинических исследованиях (18, 20).
В данном исследовании продемонстрирована эффективность Генферона при лечении ВПЧ-ассоциированной цервикальной интраэпителиальной неоплазии низкой степени. Были получены статистически достоверные результаты, свидетельствующие о значительно большей частоте случаев элиминации ВПЧ по данным Digene-теста, и регресса ВПЧ-ассоциированных цитологических изменений шейки матки в группе, получавшей Генферон, по сравнению с плацебо. Есть основания полагать, что достигнутый показатель эффективности связан с оптимально подобранной дозировкой (500 000 МЕ) и схемой применения препарата – при назначении после основного 10-дневного курса в режиме 1 свеча через день в течение 3 месяцев достигались более стойкие положительные изменения показателей местного иммунитета, а также повышалась вероятность элиминации возбудителя. Кроме того, очевидно, что достигнутый результат был бы невозможен в отсутствие комбинированного действия активных веществ, входящих в состав препарата Генферон. Сочетание интерферона и таурина обусловливает более длительное действие интерферона, а также эпителизирущий эффект в отношении участков эрозирования и нормализующее влияние на дифференцировку эпителиоцитов. Эти факторы повышают эффективность терапии цервикальной интраэпителиальной неоплазии низкой степени.
Необходимо отметить, что с учетом двойного слепого рандомизированного плацебо-контролируемого дизайна исследования, полученные данные полностью валидны с точки зрения доказательной медицины.
Выводы
- Генферон эффективен в терапии плоскоклеточных интраэпителиальных поражений шейки матки низкой степени тяжести, ассоциированных с вирусами папилломы человека высокоонкогенного риска.
- Было установлено, что исследуемый препарат безопасен и обладает хорошей переносимостью.
- Целесообразно рекомендовать препарат Генферон к широкому применению в клинической практике по данному показанию.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.