Влияние сахароснижающей терапии на провоспалительную активацию моноцитов/макрофагов у пациентов с сахарным диабетом 2 типа
- Аннотация
- Статья
- Ссылки
- English
Цель исследования – оценить влияние сахароснижающих препаратов на базальную и стимулированную секрецию провоспалительных цитокинов, таких как интерлейкины (ИЛ) 1β, 6 и 8, моноцитарный хемотаксический протеин 1 (МСР-1) и фактор некроза опухоли α (ФНО-α), в первичной культуре моноцитов/макрофагов у пациентов с впервые выявленным СД 2 типа.
Материал и методы. Проведено рандомизированное открытое сравнительное исследование, в которое были включены 60 пациентов с впервые выявленным СД 2 типа и 20 человек без СД 2 типа, составивших контрольную группу. Больные СД 2 типа были рандомизированы на подгруппы монотерапии метформином, дапаглифлозином и эмпаглифлозином. Всем пациентам проведены клинико-лабораторное обследование, а также исследование базальной и стимулированной секреции ИЛ-1β, ИЛ-6, ИЛ-8, МСР-1, ФНО-α.
Результаты. Уровень базальной секреции провоспалительных цитокинов ФНО-α, МСР-1, ИЛ-6 и ИЛ-8 оказался достоверно выше у лиц с СД 2 типа (р < 0,001). Стимулированная липополисахаридом (ЛПС) секреция ИЛ-6, МСР-1, ИЛ-1β была также выше при СД 2 типа, но достоверно не отличалась от таковой в отсутствие СД 2 типа. Уровень повторно стимулированной секреции ИЛ-6, ИЛ-8, МСР-1, ФНО-α был достоверно больше у больных СД 2 типа. При этом уровень повторно стимулированной секреции ИЛ-6, ИЛ-8 и ФНО-α у лиц с и без СД 2 типа оказался значительно ниже, чем уровень секреции после первой стимуляции. Повторно стимулированная секреция МСР-1 в группе СД 2 типа значительно превосходила таковую в контрольной группе (р = 0,004). Через три месяца приема метформина пролонгированного действия достоверно снизилась базальная секреция ИЛ-1β (р = 0,023) и ФНО-α (р = 0,033), а также повторно стимулированная секреция ФНО-α (р = 0,037). У принимавших дапаглифлозин в течение того же периода отмечалось снижение только базальной секреции ФНО-α (р < 0,001). Терапия эмпаглифлозином через три месяца привела к достоверному повышению повторно стимулированной секреции ФНО-α (р = 0,022).
Заключение. У пациентов с СД 2 типа выявлена провоспалительная активация моноцитов/макрофагов. Метформин, дапаглифлозин и эмпаглифлозин способствовали снижению провоспалительного статуса, что позволяет рассматривать их как средства патогенетического лечения заболевания.
Цель исследования – оценить влияние сахароснижающих препаратов на базальную и стимулированную секрецию провоспалительных цитокинов, таких как интерлейкины (ИЛ) 1β, 6 и 8, моноцитарный хемотаксический протеин 1 (МСР-1) и фактор некроза опухоли α (ФНО-α), в первичной культуре моноцитов/макрофагов у пациентов с впервые выявленным СД 2 типа.
Материал и методы. Проведено рандомизированное открытое сравнительное исследование, в которое были включены 60 пациентов с впервые выявленным СД 2 типа и 20 человек без СД 2 типа, составивших контрольную группу. Больные СД 2 типа были рандомизированы на подгруппы монотерапии метформином, дапаглифлозином и эмпаглифлозином. Всем пациентам проведены клинико-лабораторное обследование, а также исследование базальной и стимулированной секреции ИЛ-1β, ИЛ-6, ИЛ-8, МСР-1, ФНО-α.
Результаты. Уровень базальной секреции провоспалительных цитокинов ФНО-α, МСР-1, ИЛ-6 и ИЛ-8 оказался достоверно выше у лиц с СД 2 типа (р < 0,001). Стимулированная липополисахаридом (ЛПС) секреция ИЛ-6, МСР-1, ИЛ-1β была также выше при СД 2 типа, но достоверно не отличалась от таковой в отсутствие СД 2 типа. Уровень повторно стимулированной секреции ИЛ-6, ИЛ-8, МСР-1, ФНО-α был достоверно больше у больных СД 2 типа. При этом уровень повторно стимулированной секреции ИЛ-6, ИЛ-8 и ФНО-α у лиц с и без СД 2 типа оказался значительно ниже, чем уровень секреции после первой стимуляции. Повторно стимулированная секреция МСР-1 в группе СД 2 типа значительно превосходила таковую в контрольной группе (р = 0,004). Через три месяца приема метформина пролонгированного действия достоверно снизилась базальная секреция ИЛ-1β (р = 0,023) и ФНО-α (р = 0,033), а также повторно стимулированная секреция ФНО-α (р = 0,037). У принимавших дапаглифлозин в течение того же периода отмечалось снижение только базальной секреции ФНО-α (р < 0,001). Терапия эмпаглифлозином через три месяца привела к достоверному повышению повторно стимулированной секреции ФНО-α (р = 0,022).
Заключение. У пациентов с СД 2 типа выявлена провоспалительная активация моноцитов/макрофагов. Метформин, дапаглифлозин и эмпаглифлозин способствовали снижению провоспалительного статуса, что позволяет рассматривать их как средства патогенетического лечения заболевания.
![Таблица 2. Секреция провоспалительных цитокинов культивируемыми моноцитами/макрофагами у участников исследования, пг/мл (Me [Q1; Q3])](/upload/resize_cache/iblock/a96/195_350_1/Bochkareva2.jpg)
![Таблица 3. Влияние сахароснижающей терапии на секрецию ИЛ-1β культивируемыми моноцитами у пациентов с СД 2 типа, пг/мл (Me [Q1; Q3])](/upload/resize_cache/iblock/096/195_350_1/Bochkareva3.jpg)
![Таблица 4. Влияние сахароснижающей терапии на секрецию ФНО-α культивируемыми моноцитами у пациентов с СД 2 типа, пг/мл (Me [Q1; Q3])](/upload/resize_cache/iblock/986/195_350_1/Bochkareva4.jpg)

Введение
В патогенезе сахарного диабета (СД) 2 типа ведущую роль играет хроническое воспаление [1]. Необходимо отметить, что хроническое субклиническое воспаление слабой степени регистрируется еще до дебюта СД 2 типа – при развитии метаболического синдрома и инсулинорезистентности. Воспалительные процессы участвуют и в прогрессировании диабетических осложнений, таких как нефропатия, ретинопатия и полинейропатия.
В формировании инсулинорезистентности большое значение отводится макрофагам из-за продукции ими воспалительных цитокинов. Результаты последних исследований позволяют рассматривать нарушение толерантности воспалительного ответа циркулирующих моноцитов и макрофагов как важный механизм развития хронического воспаления [2]. На сегодняшний день мало изучено влияние на толерантность иммунного ответа сахароснижающей терапии, в том числе это касается новых групп сахароснижающих препаратов, таких как ингибиторы натрий-глюкозного котранспортера 2 (иНГЛТ-2).
Известно, что иНГЛТ-2 способствуют снижению не только гликемии (глюкозоцентрический подход), но и риска развития осложнений, таких как хроническая сердечная недостаточность, хроническая болезнь почек, неалкогольная болезнь печени (кардио-рено-метаболический подход). Данных о положительном воздействии иНГЛТ-2 на толерантность иммунного ответа, о связи уровня провоспалительных цитокинов с сердечно-сосудистыми факторами риска и показателями атеросклероза на фоне приема препаратов данного класса у пациентов с СД 2 типа недостаточно. Так, противовоспалительный эффект иНГЛТ-2 продемонстрирован в нескольких исследованиях на животных моделях и был связан со снижением экспрессии маркеров воспаления. Речь, в частности, идет о моноцитарном хемотаксическом протеине 1 (MCP-1), интерлейкине 6 (ИЛ-6) и p38. На моделях хронической болезни почек показано, что иНГЛТ-2 эмпаглифлозин ослаблял ИЛ-1β-индуцированное воспаление в нормогликемических клетках проксимальных канальцев почек человека. Это указывает на глюкозонезависимое противовоспалительное действие иНГЛТ-2, которое реализуется за счет влияния на гены CXCL8/IL8, LOX, NOV, PTX3 и SGK1 [3]. Было также выявлено, что иНГЛТ-2 дапаглифлозин подавлял регуляцию инфламмасомы NLRP3, опосредованную итаконатом, на животной модели прогрессирующей хронической болезни почек [4]. Применение эмпаглифлозина при неалкогольном стеатогепатите приводило к снижению долькового воспаления [5].
Изучение провоспалительной активации моноцитов/макрофагов у пациентов с СД 2 типа и связи между уровнем провоспалительных цитокинов, клинико-лабораторными показателями атеросклероза и факторами риска развития сердечно-сосудистой патологии, особенно в дебюте заболевания, имеет важное значение для профилактики возникновения осложнений и улучшения сердечно-сосудистого прогноза.
Цель исследования
Целью настоящего исследования стала оценка влияния сахароснижающих препаратов на базальную и стимулированную секрецию провоспалительных цитокинов ИЛ-1β, ИЛ-6, ИЛ-8, МСР-1 и фактора некроза опухоли α (ФНО-α) в первичной культуре моноцитов/макрофагов у пациентов с впервые выявленным СД 2 типа.
Материал и методы
Проведено рандомизированное открытое сравнительное исследование. В исследование были включены 80 человек, из них 60 с впервые выявленным СД 2 типа (группа СД 2 типа) и 20 без СД 2 типа (контрольная группа).
Исследование было одобрено локальным комитетом по этике ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Министерства здравоохранения РФ (Сеченовский Университет) (протокол от 18.07.2024 № 18–24).
Все включенные в исследование подписали добровольное информированное согласие на участие в нем.
Пациенты с СД 2 типа были рандомизированы на три подгруппы монотерапии. Первая подгруппа (n = 20) получала метформин пролонгированного действия в дозе 2000 мг/сут, вторая подгруппа (n = 20) – дапаглифлозин в дозе 10 мг/сут, третья подгруппа (n = 20) – эмпаглифлозин в дозе 25 мг/сут.
Всем участникам исследования до и через три месяца после терапии проведены общеклиническое обследование, включавшее клинический анализ крови и мочи, биохимический анализ крови с оценкой, в частности, уровня гликированного гемоглобина (HbA1c), липидного спектра (холестерин, триглицериды, липопротеины низкой плотности (ЛПНП), липопротеины очень низкой плотности, липопротеины высокой плотности (ЛПВП)), уровня аспартатаминотрансферазы (АСТ), аланинаминотрансферазы (АЛТ), глюкозы, креатинина, мочевины, инструментальное обследование (ультразвуковое сканирование сонных артерий (СА), эхокардиграфия), а также специальное исследование уровня провоспалительных цитокинов ИЛ-1β, ИЛ-6, ИЛ-8, МСР-1 и ФНО-α.
Первичная культура моноцитов/макрофагов крови участников исследования была получена путем выделения лейкоцитарной фракции при центрифугировании в градиенте фиколл-пак с последующей селективной магнитной сортировкой CD14+-клеток с использованием колонок LS Columns и парамагнитных наночастиц CD14 MicroBeads, human (Miltenyi Biotec Inc., США). Клетки помещали в культуральный планшет в количестве 500 тыс. в лунку. В одной лунке стимуляция для оценки базальной секреции цитокинов не проводилась. В другой лунке провоспалительная стимуляция осуществлялась с помощью липополисахарида (ЛПС) в концентрации 1 мкг/мл дважды – в первые сутки для оценки клеточного ответа на воспалительную стимуляцию, на шестые сутки для оценки толерантности иммунного ответа на повторную стимуляцию. Анализ провоспалительной активации моноцитов/макрофагов включал измерение базальной и стимулированной концентрации цитокинов в культуральной жидкости через 24 часа инкубации. После забора образцов культуральной жидкости среды сменяли и культивируемые клетки инкубировали в течение пяти суток без воспалительной стимуляции. На шестые сутки в культуру клеток в опытной лунке, в которой ранее проводилась стимуляция ЛПС, для повторной стимуляции еще раз добавляли ЛПС. Через 24 часа инкубации получали образцы культуральной жидкости для измерения концентрации провоспалительных цитокинов с целью оценки толерантности иммунного ответа моноцитов. Концентрацию ФНО-α, ИЛ-1β, ИЛ-6, ИЛ-8, высокочувствительного С-реактивного белка и МСР-1 в культуральной жидкости определяли методом иммуноферментного анализа с использованием коммерческих наборов Human TNF-alpha/TNFSF1A, IL-1beta/IL-1F2, CCL2/MCP-1 IL-6 и IL-8 DuoSet ELISA (R&D Systems, США). Толерантность иммунного ответа оценивали по секреции цитокинов через 24 часа инкубации после повторной стимуляции ЛПС относительно секреции цитокинов в ответ на первичную стимуляцию.
Статистический анализ данных проводили с помощью программы SPSS 27.0.
Для проверки типа распределения использовался W-критерий Шапиро – Уилка.
Данные представляли в виде среднего значения (М) и стандартного отклонения (SD), а также в виде медианы (Me) и верхнего и нижнего квартилей [Q1; Q3].
Для оценки различий в секреции провоспалительных цитокинов между группами был использован U-критерий Манна – Уитни. Критерий Вилкоксона применяли для внутригрупповых сравнений динамики клинических данных и воспалительной реакции моноцитов после терапии сахароснижающими препаратами с целью выявления наиболее эффективных из них. Корреляционный анализ с использованием коэффициента Пирсона проводили для выявления ассоциации секреции цитокинов культивируемыми моноцитами с клинико-лабораторными характеристиками участников исследования, а также с проводимой сахароснижающей терапией для определения препаратов с более выраженной противовоспалительной активностью.
Результаты
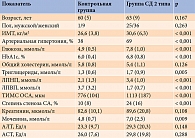
В исследование включены 80 пациентов, из них 60 с впервые выявленным СД 2 типа и 20 без диабета. Клинико-лабораторная характеристика участников исследования представлена в табл. 1. Группа с СД 2 типа и контрольная группа были сопоставимы по возрасту и полу. Так, средний возраст пациентов в группе СД 2 типа составил 63 (9) года, лиц в контрольной группе – 60 (5) лет. Индекс массы тела (ИМТ) у больных СД 2 типа оказался выше по сравнению с лицами без СД 2 типа – 30,6 (6,3) и 26,6 (3,8) кг/м2 соответственно (р < 0,001). В группе СД 2 типа нормальный вес имел место у 7%, избыточная масса тела – у 27%, ожирение первой или второй степени – у 66%. В контрольной группе с нормальным ИМТ было 35% человек, с избыточным весом – 45%, с ожирением первой степени – 20%. У пациентов с СД 2 типа отмечена достоверно более высокая гликемия. Так, средний уровень глюкозы натощак составил 7,8 (1,0) ммоль/л в группе СД 2 типа и 4,9 (0,5) ммоль/л в контрольной группе (р < 0,001), средний уровень HbA1c – 6,8 (0,8) и 6,0 (0,4)% соответственно (р < 0,001).
Провоспалительную активацию моноцитов оценивали по базальной и ЛПС-стимулированной секреции ФНО-α, ИЛ-6, ИЛ-8, ИЛ-1β и МСР-1. Данные о базальной, стимулированной секреции и секреции на повторную стимуляцию представлены в табл. 2.
Уровень базальной секреции ФНО-α, МСР-1, ИЛ-6 и ИЛ-8 был достоверно выше у больных СД 2 типа. В группе СД 2 типа ЛПС-стимулированная секреция ИЛ-6, МСР-1 и ИЛ-8 превосходила таковую в контрольной группе, достоверные различия показателей между группами получены в отношении МСР-1 и ИЛ-8. Уровень повторно стимулированной секреции ИЛ-6, ИЛ-8, МСР-1 и ФНО-α оказался достоверно больше у пациентов с СД 2 типа. При этом в обеих группах уровень повторно стимулированной секреции ИЛ-6, ИЛ-8 и ФНО-α был значительно ниже уровня секреции после первой стимуляции, что демонстрирует наличие толерантности иммунного ответа макрофагов в отношении секреции ФНО-α, ИЛ-6 и ИЛ-8. Толерантность иммунного ответа принято рассматривать как сниженный ответ на повторную стимуляцию после возвращения клеток в неактивированное состояние. В группе СД 2 типа в отличие от контрольной группы наблюдалась значительно более высокая повторно стимулированная секреция МСР-1 и ИЛ-8, что свидетельствует о нарушении толерантности иммунного ответа в отношении секреции этих цитокинов.
Динамику провоспалительных цитокинов на фоне терапии метформином пролонгированного действия, дапаглифлозином и эмпаглифлозином оценивали по уровню ИЛ-1β и ФНО-α. Полученные результаты представлены в табл. 3 и 4.
Нами установлено, что через три месяца приема метформина пролонгированного действия достоверно снизилась базальная секреция ИЛ-1β и ФНО-α, а также повторно стимулированная секреция ФНО-α. Это отражает толерантность иммунного ответа на фоне приема метформина пролонгированного действия.
Через три месяца применения дапаглифлозина отмечалось снижение секреции ИЛ-1β и ФНО-α во всех точках, за исключением стимулированной секреции ФНО-α, однако достоверное изменение выявлено в отношении базальной секреции ФНО-α и повторно стимулированной секреции ИЛ-1β. Терапия эмпаглифлозином не повлияла положительно на секрецию ИЛ-1β. Положительный эффект в отношении секреции ФНО-α выражался в снижении уровня его базальной секреции (р = 0,040). Однако также выявлено достоверное повышение повторно стимулированной секреции данного цитокина (р = 0,022). Это свидетельствует о нарушении толерантности иммунного ответа и прогрессировании воспаления.
Корреляционный анализ, проведенный для оценки связи уровня секреции провоспалительных цитокинов в первичной культуре моноцитов с клинико-лабораторными характеристиками участников исследования, показал, что у пациентов с СД 2 типа имела место достоверная корреляция между базальной секрецией ИЛ-6 и уровнем общего холестерина и триглицеридов в сыворотке крови (r = 0,369, р = 0,043 и r = 0,435, р = 0,001 соответственно), а также корреляция между базальной секрецией МСР-1 и уровнем триглицеридов в сыворотке крови (r = 0,385, р = 0,003). Кроме того, уровень базальной и стимулированной секреции ФНО-α коррелировал с гликемией (r = 0,427, p = 0,012 и r = 0,372, p = 0,037 соответственно). У больных СД 2 типа также отмечена положительная корреляция между уровнем креатинина и секрецией МСР-1 после повторной стимуляции (r = 0,426, p = 0,001).
В ходе анализа корреляции уровня секреции провоспалительных цитокинов со степенью атеросклероза СА установлено, что у лиц с СД 2 типа ЛПС-стимулированная секреция ФНО-α и ИЛ-8 коррелировала со степенью атеросклеротического стеноза в бассейне СА (r = 0,498, p < 0,001 и r = 0,656, p < 0,001 соответственно).
В подгруппе дапаглифлозина при обследовании через три месяца отмечалось достоверное увеличение фракции выброса левого желудочка (ФВ ЛЖ) с 61,6 (4,0) до 62,2 (3,7)%, динамика – +0,6 (1,2)% (р = 0,040) (табл. 5).
Обсуждение
В ходе исследования нами были выявлены повышенные значения провоспалительных цитокинов ИЛ-6, МСР-1, ИЛ-1β и ФНО-α у пациентов с впервые выявленным СД 2 типа по сравнению с лицами, не страдавшими СД 2 типа. Кроме того, нами впервые обнаружено нарушение толерантности иммунного ответа в отношении МСР-1.
Провоспалительные цитокины ИЛ-1β и ФНО-α ингибируют действие инсулина в жировой ткани и приводят к нарушению секреции инсулина, что вызывает развитие инсулинорезистентности. Повышенная секреция ФНО-α и ИЛ-1β также может быть одной из ведущих причин ускоренного прогрессирования атеросклероза при СД 2 типа, а также развития сердечно-сосудистых заболеваний как при СД, так и в его отсутствие [1, 6]. Установлена роль провоспалительных цитокинов в формировании хронической сердечной недостаточности, в сердце обнаружены два подтипа рецепторов ФНО-α [7].
В исследованиях EMPA-REG OUTCOME [8] и DECLARE-TIMI 58 [9] по оценке сердечно-сосудистых исходов на фоне приема дапаглифлозина и эмпаглифлозина влияния данных препаратов на маркеры воспаления продемонстрировано не было.
Нами также впервые был изучен эффект дапаглифлозина и эмпаглифлозина, оказываемый на секрецию ИЛ-1β и ФНО-α, и проведен корреляционный анализ для установления связи уровня секреции провоспалительных цитокинов в первичной культуре моноцитов с клинико-лабораторными характеристиками участников исследования, а также с сердечно-сосудистыми факторами риска. Так, на фоне приема дапаглифлозина в течение трех месяцев выявлено достоверно значимое снижение базальной секреции ФНО-α. Применение эмпаглифлозина в аналогичный период не привело к уменьшению секреции провоспалительных цитокинов. Кроме того, таковое ассоциировалось с нарушением толерантности иммунного ответа в отношении ФНО-α. Особого внимания заслуживает уменьшение толщины интимо-медиального слоя общей сонной артерии (ТИМС ОСА) с 1168 (182) до 1043 (134) мкм (р = 0,021) на фоне терапии эмпаглифлозином и увеличение ФВ ЛЖ на 0,6 (1,2)% на фоне приема дапаглифлозина. В ранее проведенных исследованиях на экспериментальных моделях атеросклероза выявлено, что антиатеросклеротическая эффективность иНГЛТ-2 обусловлена их комплексным воздействием на механизмы атерогенеза, в частности подавлением воспаления в сосудистой стенке, окислительного стресса и дисфункции эндотелия, а также снижением активации тромбоцитов [10]. В крупных исследованиях по оценке сердечно-сосудистых исходов у пациентов с СД 2 типа показано, что иНГЛТ-2 улучшали сердечно-сосудистые и почечные исходы, включая количество госпитализаций по поводу сердечной недостаточности, причем этот эффект распространялся и на пациентов без СД с сердечной недостаточностью со сниженной ФВ ЛЖ [11]. Положительный эффект может быть связан со снижением уровня ИЛ-6, ИЛ-8, МСР-1 и ФНО-α [12], что также подтверждают данные нашего исследования.
Заключение
В ходе исследования нами была выявлена провоспалительная активация моноцитов/макрофагов у пациентов с СД 2 типа. Сахароснижающая терапия как метформином, так и дапаглифлозином и эмпаглифлозином способствовала снижению провоспалительного статуса моноцитов/макрофагов, поэтому может быть использована в качестве патогенетического лечения заболевания.
В целях определения тактики по профилактике развития сердечно-сосудистых заболеваний и других осложнений СД 2 типа требуется изучение провоспалительной активности моноцитов/макрофагов на более ранних стадиях нарушения углеводного обмена (нарушение толерантности к глюкозе, нарушение гликемии натощак).
Необходимо также рассмотреть перспективы использования иНГЛТ-2 на стадии предиабета.
L.A. Bochkareva, L.V. Nedosugova, MD, PhD, Prof., I.A. Kuzina, Yu.V. Markina, PhD, T.V. Kirichenko, PhD, N.A. Petunina, Corresponding member of the RASci., MD, PhD, Prof.
I.M. Sechenov First Moscow State Medical University
Russian Research Center for Surgery named after Academician B.V. Petrovsky
Contact person: Leyla A. Bochkareva, lejlani@mail.ru
Impaired tolerance of the inflammatory response of monocytes is considered as an important mechanism of the pathogenesis of chronic inflammation in type 2 diabetes mellitus (T2DM).
Aim of this study to evaluate the impact of glucose-lowering drugs on the basal and stimulated secretion of proinflammatory cytokines IL-1β, IL-6, IL-8, MCP-1 and TNF-α in the primary culture of monocytes/macrophages of patients with newly diagnosed T2DM.
Material and methods. A randomized open comparative study was conducted, 60 patients with newly diagnosed T2DM and 20 control group without T2DM were included. Patients with T2DM were randomized to monotherapy groups with metformin, dapagliflozin and empagliflozin. All patients underwent clinical and laboratory examination and a study basal and stimulated secretion of IL-1β, IL-6, IL-8, MCP-1, TNF-α.
Results. The level of basal secretion of proinflammatory cytokines TNF-α, MCP-1, IL-6, and IL-8 were significantly higher in patients with type 2 diabetes (p < 0.001). LPS-stimulated secretion of IL-6, MCP-1, IL-1β was higher in type 2 diabetes, but did not differ significantly. The level of re-stimulated secretion of IL-6, IL-8, MCP-1, TNF-α was significantly higher in patients with type 2 diabetes, while the level of re-stimulated secretion of IL-6, IL-8, and TNF-α in both groups was significantly lower than the level of secretion after the first stimulation. Re-stimulated secretion of MCP-1 was significantly higher in the T2DM group compared to the control group (p = 0.004). After 3 months of metformin extended-release treatment, basal secretion of IL-1β (p = 0.023) and TNF-α (p = 0.033), as well as re-stimulated secretion of TNF-α (p = 0.037) significantly decreased. In the dapagliflozin group, only a decrease in basal secretion of TNF-α was observed (p < 0.001). In the empagliflozin group, after 3 months, a significant increase in re-stimulated secretion of TNF-α was detected (p = 0.022).
Conclusion. Proinflammatory activation of monocytes/macrophages was revealed in patients with T2DM. Metformin, dapagliflozin and empagliflozin contributed to a decrease in the pro-inflammatory status, which allows them to be considered as means of pathogenetic treatment of the disease.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.