Биомаркеры тяжести течения COVID-19: сравнение собственных результатов с данными литературы
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Проведены одноцентровое ретроспективное исследование и статистическая обработка лабораторных и инструментальных методов диагностики: общих, биохимических, коагулологических анализов крови, компьютерных томографических и рентгенологических заключений 208 пациентов с COVID-19, госпитализированных в Городскую клиническую больницу им. В.М. Буянова в период с января по февраль 2021 г. Проанализирована отечественная и зарубежная научная литература, посвященная изучению прогностических показателей крови, маркеров слезы и внутренних жидких сред глаза для оценки их влияния на структуру сетчатки. Для поиска необходимой литературы использовались базы данных PubMed, ScienceDirect, eLibrary.
Обсуждение. SARS-CoV-2 – высококонтагиозная вирусная инфекция, нередко приводящая к тяжелым клиническим состояниям и исходам, в том числе летальным. Все изученные нами показатели крови оказались информативны в той или иной степени, но наиболее важными для витального прогноза были С-реактивный белок, D-димер, протромбин по Квику, креатинфосфокиназа (МВ-фракция) и лактатдегидрогеназа. В летальных случаях зафиксированы множественные отклонения этих показателей, что говорит о полиорганном поражении и более тяжелом клиническом состоянии пациентов. Кроме того, нами изучена зарубежная научная литература, в которой описано влияние ранних типов коронавируса на глаза животных моделей с выявлением последующих дегенеративных изменений в сетчатке с обнаружением провоспалительных цитокинов и ангиогенных факторов во внутриглазных жидких структурах. На сегодняшний день лишь немногими учеными исследована слезная жидкость у пациентов в остром периоде COVID-19 с определением в ней различных биомаркеров, дальнейшее изучение которых может дать более широкое представление о возможном воздействии SARS-CoV-2 на орган зрения.
Заключение. SARS-CoV-2 часто вызывает тяжелые осложнения, а именно острый респираторный дистресс-синдром и полиорганную недостаточность, тяжесть которых ярко отражена в общих, биохимических и коагулологических анализах крови. Кроме того, по данным некоторых исследователей SARS-CoV-2 и более ранних типов коронавируса, как в слезе, так и в жидких средах глазного яблока обнаруживаются провоспалительные цитокины и ангиогенные факторы, способствующие развитию необратимых дегенеративных изменений в слоях сетчатки. В слезе на фоне COVID-19 у пациентов обнаружены фактор некроза опухоли альфа, VEGF и интерлейкины, но их значимость еще предстоит выяснить.
Материал и методы. Проведены одноцентровое ретроспективное исследование и статистическая обработка лабораторных и инструментальных методов диагностики: общих, биохимических, коагулологических анализов крови, компьютерных томографических и рентгенологических заключений 208 пациентов с COVID-19, госпитализированных в Городскую клиническую больницу им. В.М. Буянова в период с января по февраль 2021 г. Проанализирована отечественная и зарубежная научная литература, посвященная изучению прогностических показателей крови, маркеров слезы и внутренних жидких сред глаза для оценки их влияния на структуру сетчатки. Для поиска необходимой литературы использовались базы данных PubMed, ScienceDirect, eLibrary.
Обсуждение. SARS-CoV-2 – высококонтагиозная вирусная инфекция, нередко приводящая к тяжелым клиническим состояниям и исходам, в том числе летальным. Все изученные нами показатели крови оказались информативны в той или иной степени, но наиболее важными для витального прогноза были С-реактивный белок, D-димер, протромбин по Квику, креатинфосфокиназа (МВ-фракция) и лактатдегидрогеназа. В летальных случаях зафиксированы множественные отклонения этих показателей, что говорит о полиорганном поражении и более тяжелом клиническом состоянии пациентов. Кроме того, нами изучена зарубежная научная литература, в которой описано влияние ранних типов коронавируса на глаза животных моделей с выявлением последующих дегенеративных изменений в сетчатке с обнаружением провоспалительных цитокинов и ангиогенных факторов во внутриглазных жидких структурах. На сегодняшний день лишь немногими учеными исследована слезная жидкость у пациентов в остром периоде COVID-19 с определением в ней различных биомаркеров, дальнейшее изучение которых может дать более широкое представление о возможном воздействии SARS-CoV-2 на орган зрения.
Заключение. SARS-CoV-2 часто вызывает тяжелые осложнения, а именно острый респираторный дистресс-синдром и полиорганную недостаточность, тяжесть которых ярко отражена в общих, биохимических и коагулологических анализах крови. Кроме того, по данным некоторых исследователей SARS-CoV-2 и более ранних типов коронавируса, как в слезе, так и в жидких средах глазного яблока обнаруживаются провоспалительные цитокины и ангиогенные факторы, способствующие развитию необратимых дегенеративных изменений в слоях сетчатки. В слезе на фоне COVID-19 у пациентов обнаружены фактор некроза опухоли альфа, VEGF и интерлейкины, но их значимость еще предстоит выяснить.


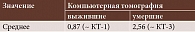
Введение
Первая коронавирусная инфекция была зарегистрирована в 1965 г. J.D. Almeida и D.A. Tyrrell. Несмотря на длительное наблюдение за коронавирусом этими учеными и их последователями вплоть до сегодняшнего дня, вирус продолжает оставаться неизученным. Вызвав три известные мировые пандемии, коронавирус унес жизни миллионов людей. В настоящем исследовании мы наряду с другими авторами проанализировали показатели крови, определили наиболее важные маркеры, указывающие на тяжесть клинического состояния и возможное скорое развитие неблагоприятных исходов у госпитализированных пациентов. Кроме того, рассмотрели влияние биомаркеров слезы и жидких внутриглазных структур по данным научной литературы и осложнения со стороны глаз, возникшие на фоне коронавирусной инфекции.
Материал и методы
Проведены одноцентровое ретроспективное исследование и статистическая обработка лабораторных и инструментальных методов диагностики: общих, биохимических, коагулологических анализов крови, компьютерных томографических и рентгенологических заключений 208 пациентов с COVID-19, госпитализированных в Городскую клиническую больницу им. В.М. Буянова в период с января по февраль 2021 г. Подробно изучены уровни гемоглобина, гематокрита, общего белка, альбумина, лактатдегидрогеназы (ЛДГ), креатинфосфокиназы (КФК и КФК-МВ), прокальцитонина (PCT), количество эритроцитов, лейкоцитов, лимфоцитов, нейтрофилов, моноцитов, С-реактивного белка (СРБ), тропонина, а также коагулограмма, включавшая фибриноген, протромбин по Квику, международное нормализованное отношение (МНО), D-димер. Проанализирована отечественная и зарубежная научная литература, посвященная изучению прогностических показателей крови, маркеров слезы и внутренних жидких сред глаза для оценки их влияния на структуру сетчатки. Для поиска необходимой литературы использовались базы данных PubMed, ScienceDirect, eLibrary.
Обсуждение
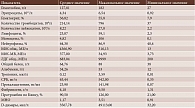
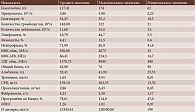
По нашим данным, из 208 госпитализированных 17 умерли. У 167 пациентов СРБ был повышен. Средний показатель СРБ у выживших составил 63,4 мг/л, у умерших – 139,1 мг/л (табл. 1 и 2). Причем уровень СРБ был повышенным у всех умерших.
Многие авторы утверждают, что СРБ – один из главных прогностических маркеров крови. Зачастую этот показатель повышен у пациентов с тяжелым течением болезни. Выживаемость при высоком уровне СРБ, как правило, невелика, что подтверждают и результаты нашего исследования. СРБ – один из наиболее важных прогностических маркеров. В ряде исследований установлена корреляция между его уровнем и тяжестью течения, а также распространенностью воспалительной легочной инфильтрации и смертностью [1].
SARS-CoV-2 способен активировать интерлейкин (ИЛ) 1, который в свою очередь стимулирует выработку других провоспалительных цитокинов [2]. Накопление ИЛ в крови обусловливает возникновение цитокинового шторма, приводящего к пироптозу, гибели клеток в результате воспаления. Далее развивается полиорганная недостаточность вследствие множественного повреждения органов и тканей. СРБ вырабатывается гепатоцитами в ответ на генерализованное воспаление, сопровождаемое массивным выбросом цитокинов [3, 4]. При анализе крови установлена прямая корреляция между уровнем ИЛ-6 и уровнем СРБ [5]. A. Hasanvand отмечал значительное повышение уровней ИЛ-6 и ИЛ-8 у умерших [2, 6]. По результатам наблюдения G. Bivona, у тяжелых пациентов ИЛ-6 повышен в среднем в три раза по сравнению с нетяжелыми пациентами, а СРБ у умерших выше нормальных значений в десять раз. Многократное повышение ИЛ-6, как и СРБ, напрямую коррелирует с объемом поражения легких и требует подключения пациентов к аппарату искусственной вентиляции легких [1, 7, 8]. В нашем исследовании у умерших высокий уровень СРБ действительно коррелировал с поражением легких в десяти из 17 случаев. Минимально СРБ у умерших был повышен в два раза, максимально – почти в 38 раз.
Ряд авторов отмечали отклонения в коагулограмме, играющие особую роль в жизненном прогнозе. В настоящем исследовании у большинства пациентов, как у выживших, так и у умерших, выявлены изменения, связанные с отклонением показателей фибриногена, протромбина по Квику, МНО и D-димера. У выживших уровень фибриногена в среднем составил 4,18 г/л, у умерших – 4,23 г/л. Средние значения протромбина у выживших и умерших – 90,5 и 78,6%, МНО – 1,17 и 1,26 соответственно. Средний показатель D-димера у выживших – 3567,8, у умерших – 13345,4 мкг/л (табл. 1 и 2). Как видно, наиболее значимыми прогностическими показателями являются D-димер, уровень которого у умерших в четыре раза превосходит уровень у выживших, и протромбин по Квику, уровень которого у умерших снижен по сравнению с выжившими. Другими словами, пациенты с тяжелым течением COVID-19 имеют значительную предрасположенность к тромботическим осложнениям и высокий риск летального исхода.
Имеются сообщения о непосредственной связи между высокими уровнями СРБ и коагулограммой. При гипервоспалении, возникающем на фоне высоких уровней СРБ, интерлейкинов, и в ходе выброса других медиаторов воспаления в первую очередь повреждаются клетки сосудистой стенки, перициты и эндотелиоциты. Поскольку все иммунные клетки циркулируют в русле крови и с ее током поступают в органы, главной мишенью становятся сначала сосуды, затем и паренхима, что приводит к полиорганной недостаточности. Вследствие повреждения сосудистой стенки циркулирующими иммунными комплексами и развития воспалительной реакции, васкулита активируется гемокоагуляция, необходимая для закрытия вазальных дефектов. В результате множественных дефектов сосудов возникает избыточное тромбообразование, и, как следствие, повышается риск тромбоэмболии [8–15].
В периоде острого воспаления нередко встречается анемия, что продемонстрировано и в нашем исследовании. Анемия зафиксирована в 59 случаях из 208. Усредненные показатели гемоглобина умерших мужчин с анемией – 84,67 г/л, умерших женщин – 94 г/л (табл. 3). Среди выживших госпитализированных пациентов с анемией уровень гемоглобина составил 88,64 г/л у женщин и 112,47 г/л у мужчин (табл. 4). Количество эритроцитов и уровень гематокрита были также снижены у всех пациентов с анемией.
По данным различных авторов, исследовавших уровень гемоглобина у пациентов с COVID-19, анемия утяжеляет течение заболевания. Китайские ученые во главе с Z. Tao провели ретроспективное когортное исследование. Один из главных выводов, к которым пришли исследователи, – наличие корреляции между тяжестью течения анемии и COVID-19. Анемия располагает к более интенсивному воспалению, нарушению свертываемости крови, обширному повреждению органов. Ученые также отметили, что у пациентов с анемией уровни лейкоцитов, лимфоцитов, нейтрофилов, эозинофилов, эритроцитов, тромбоцитов, гематокрита снижены более существенно, чем у пациентов без анемии. Эти же показатели имеют тенденцию к дальнейшему снижению при прогрессировании анемии [16, 17].
Другие китайские ученые выдвинули теорию о патогенезе анемии при COVID-19. W. Liu предположил, что SARS-CoV-2 способен опосредованно атаковать эритроциты в результате связывания не входящих в структуру вируса белков, кодируемых вирусной РНК, с бета-цепью гемоглобина. Впоследствии ионы железа высвобождаются из порфириновых ядер, что приводит к гипоксемии различных тканей и органов [18, 19]. Чем тяжелее течение COVID-19, тем выше потребность тканей в кислороде. Поскольку организм претерпевает дефицит оксигенации тканей и органов, защитные силы истощаются, развивается полиорганная дисфункция [20].
По мнению G. Bergamaschi, анемия может развиваться под воздействием SARS-CoV-2 на эритропоэз. Фактор некроза опухоли (ФНО) альфа, вырабатываемый при воспалительных процессах, оказывает ингибирующий эффект в отношении ретикулоцитов и сокращает продолжительность жизни эритроцитов [21].
Важная роль в жизненном прогнозе отводится количеству тромбоцитов. Отклонение от нормы данного показателя несет в себе риск тромботических осложнений. Прежде всего опасность проявляется в снижении уровня тромбоцитов в крови, что сопряжено с развитием ДВС-синдрома. По мнению G. Bivona, содержание тромбоцитов – надежный маркер тяжести состояния [8]. При этом следует помнить, что антикоагулянты инициируют развитие тромбоцитопении, повышающей риск геморрагий [22, 23]. По данным D. Gorog, низкий уровень тромбоцитов нередко сопровождается высокой смертностью вследствие развития ДВС-синдрома [5, 24]. Это же было доказано в ретроспективном исследовании китайского ученого W. Guan. В его наблюдении низкий уровень тромбоцитов отмечался у 36,2% госпитализированных пациентов. SARS-CoV-2 инициирует активацию и агрегацию тромбоцитов, что вызывает тромбоз и уменьшение количества тромбоцитов в кровяном русле. По мнению S. Zhang, S-белок вируса непосредственно активирует тромбоциты с высвобождением факторов свертывания крови, что сопровождается лейкоцитарно-тромбоцитарной агрегацией. В свою очередь это приводит к тромбозу и стабилизации тромба [12, 25, 26]. По версии других авторов, уровень тромбоцитов не относится к прогностическим маркерам смертности, но предсказывает тяжесть течения COVID-19 [27].
В нашем исследовании получены следующие результаты. У выживших среднее значение тромбоцитов составило 214,1, у умерших – 148 × 109/л. Следует отметить, что у восьми из 17 умерших количество тромбоцитов было снижено, минимальное число – 21, максимальное – 129 × 109/л (табл. 1 и 2). У выживших минимальное и максимальное значения тромбоцитов составили 37 и 146 × 109/л соответственно. Среднее по низким уровням тромбоцитов у выживших – 119,4 × 109/л, у умерших – 87,1 × 109/л.
Кроме того, ряд авторов указывают на важность соотношения тромбоцитов и лимфоцитов. Повышение этого соотношения свидетельствует о риске дальнейшего ухудшения состояния, но не влияет на смертность [27]. При оценке уровня тромбоцитов в нашем случае показатели соответствовали 8,8 у умерших и 9,3 у выживших. Иными словами, отношение тромбоцитов к лимфоцитам действительно не влияет на смертность, но связано с тяжестью состояния.
Уровень лейкоцитов – значимый биомаркер в прогнозе заболевания. У госпитализированных пациентов в остром периоде инфекции уровень лейкоцитов может варьироваться, понижаться, повышаться или соответствовать референсным значениям на протяжении периода болезни. В нашем наблюдении у выживших пациентов средний показатель лейкоцитов составил 8,2 × 109/л, у умерших – 11,6 × 109/л. У восьми из 17 умерших уровень лейкоцитов было значительно повышен, максимальное значение составило 25,6 × 109/л (табл. 1 и 2). Такие результаты обычно говорят о присоединении вторичной бактериальной инфекции у тяжелых пациентов, что сопровождается повышением содержания лейкоцитов [17, 28]. В соответствии с временными федеральными методическими рекомендациями, у большинства пациентов с диагностированным COVID-19 определяется нормальное количество лейкоцитов и лишь у одной трети обнаруживается лейкопения [1]. По мнению американских исследователей, в остром периоде COVID-19 лейкоцитоз встречается реже, чем лейкопения. При этом у умерших наблюдался лейкоцитоз, а также повышение уровня нейтрофилов и снижение содержания лимфоцитов [29].
S. Kaur указал на то, что для прогноза тяжести состояния оценивают соотношение нейтрофилов и лимфоцитов. Чем выше это соотношение, тем хуже прогноз. На это указывали многие авторы, поскольку такие данные несут в себе важную информацию. Как правило, при инфекционном процессе количество лимфоцитов снижается, поскольку SARS-CoV-2 уничтожает иммунные клетки [1, 11, 17, 22, 29]. При лимфоцитопении наблюдается тенденция к незавершенным иммунным реакциям, в результате которых развивается пневмония, коррелирующая с выраженным снижением числа лимфоцитов [30]. Если иммунная система не в состоянии продуцировать большее количество клеток и восполнять их потери, увеличивается смертность [17, 31, 32]. Наши данные соответствуют результатам других авторов. Отношение нейтрофилов к лимфоцитам (NLR) у выживших составило в среднем 2,8, у умерших – 4,3. Таким образом, разница NLR у выживших и умерших составляет 1,5. Для вычисления соотношения мы использовали показатели лимфоцитов и нейтрофилов, рассчитанные в процентах. Минимальные и максимальные значения лимфоцитов у умерших – 5,3 и 44,7%, нейтрофилов – 41,4 и 85,9%. Минимальные и максимальные значения нейтрофилов у выживших – 40,4 и 86,9%, лимфоцитов – 2,3 и 59,1% соответственно (табл. 1 и 2).
A. Karimi в своей научной работе описал значимость отношения лимфоцитов и моноцитов (LMR) и отметил, что данный показатель коррелирует с полиорганной недостаточностью. Этот маркер применяется реже, чем NLR, поскольку является предиктором тяжести течения в меньшей степени. Хотя NLR обладает меньшей ценностью по сравнению с NLR и PLR (соотношение тромбоцитов и лимфоцитов), некоторые исследователи убеждены в его потенциале в аспекте прогнозирования вероятности дальнейшей госпитализации пациентов в отделение интенсивной терапии (ОИТ) [27, 32, 33]. По нашим данным, LMR у выживших – 4,8, умерших – 3,8. Минимальное и максимальное значения моноцитов у умерших – 0,6 и 15,5% соответственно (табл. 1 и 2). Моноциты – незрелые клетки, выходящие из кровеносного русла в ткани, где они дифференцируются в макрофаги. SARS-CoV-2 способен внедряться и размножаться внутри этих зрелых клеток и снижать их численность. Таким образом, вирус захватывает незрелые и зрелые клеточные формы, моноциты и макрофаги, как и лимфоциты [34, 35]. По отклонениям в биохимических показателях крови можно судить об объеме поражения тканей и органов и прогнозировать дальнейшее течение заболевания.
Креатинфосфокиназа входит в состав скелетной мускулатуры и сердечной мышцы (MB-фракция). Ее повышение связано с повреждением мышечных волокон. Результаты исследований показывают, что SARS-CoV-2 может напрямую или опосредованно повреждать мышечные ткани. Данный маркер имеет большое значение в прогнозе выживаемости инфицированных COVID-19. По данным G. Ponti, у невыживших нередко имел место повышенный уровень КФК [9, 36]. По мнению P. Malik, SARS-CoV-2 вызывает вирусный миозит, обусловленный воспалением и повреждением мышц [10]. Эти изменения развиваются под воздействием иммунной системы. В случае повышения MB-фракции КФК повреждается миокард, что сопровождается сердечно-сосудистыми осложнениями [1, 11]. В нашем исследовании среднее значение КФК у выживших составило 316,1, у умерших – 650,1 МЕ/л. Это в три раза выше нормы. Усредненное КФК-MB у умерших – 66,4 МЕ/л, у выживших – 34,9. Причем максимальные значения КФК и КФК-МВ у невыживших пациентов равны 2675 и 234,3 МЕ/л (табл. 1 и 2). Надежность этих показателей безусловна.
При повышенном значении КФК, в частности МВ-фракции, у возрастных пациентов стоит обратиться к такому показателю, как тропонин. Это специфичный маркер повреждения миокарда при сердечно-сосудистых поражениях. В нашем наблюдении уровень тропонина у умерших был значительно выше, чем у выживших, – в среднем 1,65 и 0,12 г/л соответственно. Максимальный показатель у выживших – 3,59, у умерших – 9,9 г/л (табл. 1 и 2). Уровень тропонина оказался повышен у девяти из 17 невыживших. У этих же пациентов были диагностированы острые сердечно-сосудистые патологии.
По результатам наблюдений D. Bataglini, уровень тропонина повышается исключительно в остром периоде COVID-19 [11]. По данным других авторов, у 7–17% пациентов с повышенным содержанием тропонина лечение проходило в стационаре, а 22–31% пациентов с высоким специфическим маркером повреждения миокарда были госпитализированы в ОИТ. Китайские ученые провели метаанализ исследований, посвященных отклонениям содержания тропонина у пациентов с COVID-19, и изучили биохимические анализы крови 46 248 инфицированных. 7% имели диагностированное повреждение миокарда, из которых 22% были госпитализированы в ОИТ, поскольку их состояние оценивалось как тяжелое. Такие изменения, как правило, сопровождались высокой внутрибольничной смертностью [1, 6, 36–38]. По некоторым данным, смертность среди госпитализированных возрастала в четыре раза на фоне повышения уровня тропонина и обширного сердечного повреждения, сопровождавшегося миокардитом и инфарктом миокарда [9, 22]. При ишемической болезни сердца инфицирование вирусом SARS-CoV-2 обычно усугубляет кардиологическое состояние пациентов и дальнейший исход [8].
Лактатдегидрогеназа – ценный маркер в прогнозировании тяжести течения COVID-19 и смертности [16]. ЛДГ отражает массивность разрушения клеток и тканей. Этот биомаркер необходим для косвенного понимания активности и тяжести легочного фиброза в исходе пневмонии [39].
По данным американских исследователей, уровень ЛДГ, в пять раз превышающий норму, ассоциируется со снижением оксигенации, поскольку лактат приводит к чрезмерному повреждению легочной ткани [10].
Некоторые авторы отмечают связь между значениями ЛДГ, белков и лимфоцитов. При повышении содержания ЛДГ уровни общего белка и альбумина снижаются, что говорит об утяжелении состояния.
Кроме того, высокое содержание ЛДГ в ряде случаев сопровождается лимфопенией в результате спада относительного и абсолютного числа Т-лимфоцитов, при том что количество B-лимфоцитов растет. Тем не менее такой рост не связан с увеличением уровня иммуноглобулинов M и G [19, 40].
В соответствии с действующими федеральными временными методическими рекомендациями, при развитии острого респираторного дистресс-синдрома (ОРДС) необходимо проводить мониторинг прежде всего таких лабораторных показателей, как ИЛ-6, D-димер, ферритин, СРБ, фибриноген, ЛДГ [1]. В нашем исследовании средний показатель ЛДГ у выживших составил 683,04, у умерших – 1570,7 МЕ/л (табл. 1 и 2). Уровень ЛДГ был повышен во всех летальных случаях. При этом альбумин был снижен в восьми смертельных случаях, а общий белок лишь в семи. Лимфоциты снижены в десяти из 17 случаев.
Мало изучена связь SARS-CoV-2 с уровнем белков крови. Некоторые зарубежные исследователи предполагают, что отношение альбумина к фибриногену (AFR) более значимо, чем изолированная оценка уровня альбумина. Чем ниже это отношение, тем хуже прогноз [27]. Наши результаты согласуются с этими данными: 7,6 – среднее AFR у умерших и 8,2 – среднее AFR у выживших. Кроме того, как указывалось ранее, уровень общего белка снижается и во время болезни [19, 40].
Исходом вирусного процесса может быть присоединение бактериальной инфекции, сепсиса. Прокальцитонин – высокоспецифичный маркер коинфекции. Инфекция у пациентов с повышенным уровнем прокальцитонина чаще всего сопровождается неблагоприятными исходами, поскольку коррелирует с тяжестью течения заболевания [1, 19, 30, 36]. У умерших повышенное содержание прокальцитонина отмечалось в пяти из 17 случаев, минимальное значение – 0,45, максимальное – 6,43 нг/мл, среднее – 2,86 нг/мл. Интерес представляет уровень прокальцитонина у выживших: среднее значение – 23,9, максимальное – 141,9, минимальное – 0,07 нг/мл (табл. 1 и 2). Такие значительные числовые колебания прокальцитонина у выживших можно объяснить тем, что в процессе лечения и наблюдения пациентов перевели в другие медицинские учреждения прижизненно, и мы не знаем об их дальнейшей судьбе.
Каждый описанный показатель крови несет в себе важную прогностическую информацию в отношении тактики наблюдения за пациентами и интенсивности лечения. Чем больше отклонений в анализах, тем выше риск органных дисфункций, прежде всего легочных поражений. При статистической обработке мы также оценили летальность при соответствующих компьютерных томографических (КТ) и рентгенологических картинах легочных полей. Наиболее часто смерть наступала у пациентов с диагностированной степенью КТ-3, равной 50–75% поражения легких. Среднее значение КТ у умерших – 2,56, у выживших – 0,87 (табл. 5).
Кроме исследования показателей крови и их прогностической значимости важно изучать биомаркеры, обнаруживаемые в слезе у пациентов в острой фазе COVID-19. На сегодняшний день немногими авторами подробно исследованы биомаркеры слезы и еще меньше – маркеры жидких внутриглазных структур.
A. Niedźwiedź и соавт. изучили такие маркеры слезы, как интерферон (ИФН) гамма, ФНО-альфа, ИЛ-2, 1-бета, 4, 5, 6, 8, 10, 12, гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF). Наиболее значимыми оказались ИФН-гамма, ФНО-альфа, ИЛ-5, ИЛ-8, GM-CSF. Причем перечисленные маркеры обнаруживались именно у пациентов с положительным конъюнктивальным мазком на COVID-19. Тяжесть состояния пациентов с COVID-19 соответствовала частоте обнаружения провоспалительных цитокинов в больших концентрациях. Наибольшее количество цитокинов выявлено у пациентов с диагностированной пневмонией. В слезе, по данным A. Niedźwiedź, в большей степени преобладали ИФН-альфа и ФНО-альфа. Благодаря ИФН-альфа происходит очищение глазной поверхности от инфицированных клеток за счет стимулирования цитотоксических Т-клеточных ответов, а также активации макрофагов. ФНО-альфа высвобождается локально в слезную жидкость конъюнктивального мешка и участвует в местном иммунном ответе [41]. Кроме того, ФНО-альфа воздействует на эпителиальные клетки роговицы, что в свою очередь стимулирует продукцию ИЛ-8 в наружном роговичном слое. GM-CSF обладает способностью усиливать высвобождение провоспалительных цитокинов.
В одном из исследований других типов коронавируса, наиболее ранних, ФНО-альфа обнаружили при проведении испытаний на животных моделях [42]. В исследовании L. Hooper вирус вводили мышам интравитреально. Имели место две фазы. Первая фаза, ранняя, характеризовалась воспалением, поскольку вирус обнаруживался в сетчатке, пигментном эпителии. Далее отмечали инфильтрацию иммунными клетками с высвобождением провоспалительных медиаторов. Вторая фаза, поздняя, сопровождалась потерей фоторецепторов и ганглиозных клеток, истончением нейроретинального эпителия и выработкой аутоантител к пигментному эпителию сетчатки в отсутствие вирусного агента. В результате были сформированы две группы мышей: одна – устойчивая к вирусным воздействиям и дегенеративным изменениям, другая – восприимчивая. Во второй группе были зарегистрированы нарушения целостности сетчатки, связанные с вирусной амплификацией или иммунными реакциями. Коронавирусная инфекция усиливает экспрессию ФНО-альфа в сетчатке, что ведет к ее необратимым дегенеративным изменениям [42–44].
В другом исследовании при введении коронавируса интравитреально отмечали увеличение VEGF-фактора у восприимчивых мышей в поздней фазе, что сопровождалось дегенерацией сетчатки. При этом наблюдались разрушение гематоретинального барьера, деструкция пигментного эпителия сетчатки. Исследование также включало две фазы. В первой фазе регистрировали сосудистые изменения, характерные для васкулита. Во второй, спустя десять дней, отмечали дегенеративные процессы в сетчатке. Более того, поскольку для этого исследования выполняли энуклеацию инфицированных глазных яблок, проводили подробную микроскопию, при которой вследствие разрушения гематоретинального барьера был обнаружен альбумин, локализованный в субретинальном пространстве [45].
По данным S.G. Robbins, к десятому дню вирус обнаруживался в ганглиозном слое сетчатки, а через 14 дней большая часть ретинальных слоев атрофировалась [46–48].
По данным B. Burgos, при исследовании 27 биомаркеров слез у пациентов, инфицированных SARS-CoV-2, в большом количестве выявляются ИЛ-9, ИЛ-15, G-CSF, GM-CSF, ИФН-гамма, GM-CSF, PDGF, VEGF. Интересно, что ИФН-гамма обнаруживается у пациентов с положительным результатом конъюнктивального мазка, и этот маркер не сопряжен с тяжестью состояния. Кроме того, наблюдается повышение VEGF, который оказывает проангиогенное, митогенное и антиапоптотическое действие на эндотелиальные клетки. Возникающие сосудистые изменения связаны с повреждением легких и ОРДС. Увеличение факторов ангиогенеза связано с прокоагулянтным состоянием пациентов, инфицированных SARS-CoV-2 [49]. Помимо этого VEGF стимулирует выработку ИЛ-1 и ИЛ-6, повышение которых отмечается в периоде острой инфекции, вызванной SARS-CoV-2 [50].
Заключение
Полученные нами результаты свидетельствуют о том, что SARS-CoV-2 часто вызывает тяжелые осложнения, а именно ОРДС и полиорганную недостаточность, тяжесть которых ярко отражена в общих, биохимических и коагулологических анализах крови. Кроме того, по данным некоторых исследователей SARS-CoV-2 и более ранних типов коронавируса, как в слезе, так и в жидких средах глазного яблока обнаруживаются провоспалительные цитокины и ангиогенные факторы, способствующие развитию необратимых дегенеративных изменений в слоях сетчатки. На сегодняшний день в слезе на фоне COVID-19 у пациентов выявлены ФНО-альфа, VEGF и интерлейкины, но их значимость еще предстоит выяснить.
Авторы заявляют об отсутствии конфликта интересов.
Никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
U.S. Plyaskina, M.A. Frolov, PhD, I.V. Vorobyeva, PhD, V.V. Biryukov, S. Shallakh, A.M. Frolov, PhD
Peoples' Friendship University of Russia
City Clinical Hospital named after V.M. Buyanov, Moscow
Russian Medical Academy of Continuous Professional Education
Contact person: Ulyana S. Plyaskina, plyaskina.ulyana@yandex.ru
Purpose. To identify the most significant prognostic biomarkers of disease severity in patients with COVID-19 in blood tests, as well as in eye fluids, with an assessment of their impact on the development of retinal degenerative processes.
Material and methods. A single-center retrospective study and statistical processing of laboratory and instrumental diagnostic methods, namely: general, biochemical, coagulological blood tests, as well as computed tomography and radiological conclusions, were carried out in 208 patients with COVID-19 hospitalized in the City Clinical Hospital named after. V.M. Buyanov from January to February 2021. The domestic and foreign scientific literature devoted to the study of prognostic indicators of blood, markers of tears and internal fluids of the eye was analyzed to assess their effect on the structure of the retina. The following databases were used to search for the necessary literature: PubMed, ScienceDirect, elibrary.
Discussion. SARS-CoV-2 is a highly contagious viral infection that often leads to severe clinical conditions and outcomes, including death. All the blood parameters we studied turned out to be informative to one degree or another, but among them we singled out the most important for vital prognosis: C-reactive protein, D-dimer, Quick prothrombin, creatine phosphokinase (MB-fraction) and lactate dehydrogenase. In lethal cases, we recorded multiple deviations of these blood parameters, which indicates multiple organ damage and a more severe clinical condition of such patients. In addition, we studied foreign scientific literature describing the effect of early types of coronavirus on the eyes of animal models with the identification of subsequent degenerative changes in the retina with the detection of pro-inflammatory cytokines and angiogenic factors in intraocular fluid structures. Also, to date, only a few scientists have studied the lacrimal fluid in patients during the acute period of COVID-19 with the determination of a wide range of different biomarkers in it, further study of which can give a broader idea of the various effects of SARS-CoV-2 on the organ of vision.
Conclusion. Thus, analyzing our results, it is necessary to point out that SARS-CoV-2 often causes severe complications, namely ARDS and multiple organ failure, the severity of which is clearly reflected in general, biochemical, coagulological blood tests. Moreover, according to some researchers of SARS-CoV-2 and earlier types of coronavirus, both in the tear and in the liquid media of the eyeball, pro-inflammatory cytokines and angiogenic factors were found that contribute to the development of irreversible degenerative changes in the layers of the retina. To date, TNF-α, VEGF, and interleukins have been found in tears from COVID-19 patients, but their significance remains to be elucidated.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.