Возможности энерготропной терапии в комплексном лечении раннего детского аутизма
- Аннотация
- Статья
- Ссылки
- English

Введение
Нарушения психологического развития и поведения широко распространены и часто входят в симптомокомплексы различных, в том числе наследственных, заболеваний детского возраста [1, 2]. Вопросы, связанные с дифференциальной диагностикой и лечением детей с различными неврологическими заболеваниями с нарушениями познавательных функций, решены далеко не полностью. Не определены патогенетические механизмы большинства форм таких нарушений, недостаточно применяются соответствующие диагностические маркеры.
Нарушения нервно-психического развития, в значительной степени обусловливая инвалидизацию детей, представляют актуальную проблему педиатрии, которая, в свою очередь, имеет не только медицинское, но и огромное медико-социальное значение [3]. Одним из наиболее сложных заболеваний как в диагностике, так и в коррекции является ранний детский аутизм. К собственно детскому аутизму относятся аутистическое расстройство, инфантильный аутизм, инфантильный психоз, синдром Каннера. Первые описания этого расстройства принадлежат Генри Модсли (Henry Maudsley, 1867). В 1943 г. Лео Каннер (Leo Kanner) в труде «Аутистические расстройства аффективного общения» дал четкое описание этого синдрома, назвав его «инфантильным аутизмом» [4].
Этиология и патогенез возникновения раннего детского аутизма в настоящее время неизвестны. Однако существует ряд клинически и экспериментально подтвержденных гипотез, согласно которым в основе этиопатогенеза этого расстройства лежат слабость инстинктов и аффективной сферы; информационная блокада, связанная с расстройствами восприятия; нарушение переработки слуховых впечатлений, ведущее к блокаде контактов; нарушение активизирующего влияния ретикулярной формации ствола мозга; нарушение функционирования лобно-лимбического комплекса, ведущее к расстройству мотивации и планирования поведения; нарушение обмена серотонина и функционирования серотонинергических систем мозга; нарушение парного функционирования полушарий головного мозга. Наряду с этим выделяют психологические и психоаналитические причины возникновения аутизма. Существенную роль играют генетические факторы – в семьях, страдающих аутизмом, данное заболевание встречается чаще, чем среди населения в целом. Аутизм в какой-то мере связан с органическими поражениями головного мозга (часто в анамнезе присутствуют сведения об осложнениях в период внутриутробного развития и при родах), в 2% случаев отмечается корреляция с эпилепсией (по некоторым данным, в популяции детей с эпилепсией аутизм встречается в 3,5%). У некоторых больных выявлены диффузные неврологические аномалии – «мягкие признаки». Специфические изменения на электроэнцефалограмме отсутствуют. Распространенность детского аутизма составляет 4–5 случаев на 10 000 детей. Преобладают перворожденные мальчики (в 3–5 раз чаще, чем девочки). Но у девочек аутизм имеет более тяжелое течение, при этом, как правило, имеется семейный анамнез когнитивных нарушений.
Первоначально описанные Л. Каннером [5] основные признаки аутизма используются до настоящего времени. Начало аутистических расстройств наблюдается чаще всего в возрасте до 2,5–3 лет, иногда после периода нормального развития в раннем детстве. Обычно это красивые дети с как будто прорисованным карандашом задумчивым, сонным, отрешенным лицом – «лицо принца».
Первоначально Л. Каннер полагал, что умственные способности у детей с аутизмом нормальны. Однако около 40% детей с аутизмом имеют IQ ниже 55 усл. ед. (тяжелая умственная отсталость); 30% – от 50 до 70 усл. ед. (легкая отсталость) и около 30% имеют показатели выше 70 усл. ед. У некоторых детей обнаруживаются способности к определенной сфере деятельности – «осколки функций», несмотря на снижение других интеллектуальных функций [5].
Основными критериями постановки диагноза являются:
- невозможность устанавливать полноценные отношения с людьми с начала жизни;
- крайняя отгороженность от внешнего мира с игнорированием средовых раздражителей до тех пор, пока они не становятся болезненными;
- недостаточность коммуникативного использования речи;
- отсутствие или недостаточность зрительного контакта;
- страх изменений в окружающей обстановке («феномен тождества» по Л. Каннеру);
- непосредственные и отставленные эхолалии («граммофонная попугайная речь»), задержка развития «Я»; стереотипные игры с неигровыми предметами;
- клиническое проявление симптоматики не позднее 2–3 лет.
При использовании этих критериев важно учитывать, что неспособность к установлению контакта с другими людьми создает условия для социальной депривации, ведущей к симптомам вторичных задержек развития и компенсаторных образований.
Динамика стержневых для детского аутизма расстройств имеет ряд закономерностей. В отличие от шизофрении, они характеризуются малой процессуальной прогредиентностью и имеют тенденцию к разной степени положительной динамике. Однако диагноз детского аутизма сохраняется в любом возрасте. У пациентов младшего возраста (до 5 лет) прогноз зависит от тяжести собственно аутистических проявлений, наличия или отсутствия органических поражений, темпа развития интеллекта и речи, времени начала лечения. У 10–20% может наблюдаться улучшение состояния в возрасте 4–6 лет; 10–20% пациентов могут находиться дома; у 60% отмечается только незначительное улучшение.
Патогенетический эффект лекарственных средств максимален в возрасте до 7–8 лет, после чего медикаменты оказывают симптоматическое действие. Перспективы медикаментозной терапии зависят от сроков начала, регулярности приема, индивидуальной обоснованности и от включенности в общую систему лечебно-реабилитационной работы. Огромная роль отводится психотерапевтической работе с ребенком, родителям. Большинство аутичных детей не в состоянии обучаться в обычной школе и нуждаются в специальном обучении.
В последнее десятилетие в медицине активно развивается так называемое метаболическое направление, формирующее представление о роли митохондриальных нарушений (тканевой гипоксии) в развитии и течении самых разнообразных патологических процессов [6]. В то же время нарастающее число научных работ и эмпирически выявляемая эффективность энерготропной терапии в отношении оптимизации функционирования нервной системы свидетельствуют о том, что большую роль в развитии вышеуказанных патогенетических механизмов играют нарушения энергообмена [5, 7]. Результаты популяционного исследования R.H. Haas выявили у 7,2% пациентов с аутизмом митохондриальные нарушения [8]. Однако авторы другого популяционного исследования, проведенного Американской медицинской ассоциацией (American Medical Association, AMA), предполагают наличие митохондриальной дисфункции у 80% детей с ранним детским аутизмом [9]. Такая вариативность данных литературы может объясняться разными критериями выявления митохондриальных нарушений. В этой связи особое внимание следует уделить разработке новых клинических и лабораторных диагностических подходов к определению нарушений тканевого энергообмена при синдроме раннего детского аутизма. Результаты таких исследований могут обосновывать новые способы лечения при данном состоянии [10, 11].
Основной целью настоящего исследования явилось изучение патологических процессов, связанных с митохондриальной дисфункцией, при различных проявлениях раннего детского аутизма.
Материалы и методы исследования
На базе клинических подразделений ФГБУ «Московский НИИ педиатрии и детской хирургии» Минздрава России было проведено исследование по изучению клинических проявлений раннего детского аутизма с точки зрения их патогенеза, характера нарушений тканевого энергетического метаболизма для обоснования целесообразности энерготропной терапии и оценки ее эффективности.
Группу детей с ранним детским аутизмом составили 32 ребенка в возрасте от 3 до 12 лет (средний возраст – 7,52 ± 0,52 года), имевших клинические признаки специфического нарушения развития (расстройства речи и моторики, стереотипность деятельности и поведения), что приводило к нарушениям социального взаимодействия. Детям, включенным в исследование, проводилось комплексное клиническое психоневрологическое обследование, исследование уровня активности митохондриальных ферментов и лактатдегидрогеназы исходно и после курса терапии. Дети с ранним детским аутизмом получили курс комбинированной энерготропной терапии продолжительностью 5 месяцев (схема курса: прием 2 месяца – перерыв 1 месяц – повторный прием 2 месяца), включавший прием препаратов левокарнитина в дозе в среднем 500–600 мг/сут, в сочетании с коферментом Q10 в дозе 90–120 мг/сут, раствором ацетиламиноянтарной кислоты 250 мг/сут. В терапии использовался лекарственный препарат Элькар® – раствор L-карнитина для приема внутрь, который относится к фармакологической группе «метаболическое средство» и выпускается отечественной компанией «ПИК-ФАРМА» во флаконах по 25, 50 и 100 мл. Препарат давался с учетом суточной биоритмической активности в первой половине дня.
Нами обследованы 27 мальчиков (84,4%) и 7 девочек (15,6%)*. При проведении исследования неврологического статуса данных за патологию нервной системы не выявлено. При проведении электроэнцефалографического обследования не зарегистрировано ни «замедление» основной активности, ни типичная эпилептическая активность.
В рамках исследования проводилось анкетирование родителей детей, имеющих клинические проявления раннего детского аутизма, исходно и после курса энерготропной терапии, а также психологическое тестирование и определение цитохимической активности митохондриальных ферментов лимфоцитов периферической крови. Психологическое тестирование включало проведение 4 тестов, оценивающих концентрацию и активность внимания ребенка, исследование слуховой вербальной кратковременной и долговременной памяти; образной (зрительной) памяти, утомляемости. Использованы следующие методы: анализ когнитивных функций путем исследования памяти, внимания с помощью методики «10 слов» (А.Р. Лурия, 2000); корректурной пробы (по Д. Векслеру, 1971); методики «10 слов» на зрительные стимулы и др. Оценка приведенных тестов проводилась в баллах.
Цитохимическое выявление активности митохондриальных ферментов – сукцинатдегидрогеназы (СДГ), альфа-глицерофосфатдегидрогеназы (альфа-ГФДГ), глутаматдегидрогеназы (ГДГ), а также цитозольного фермента – лактатдегидрогеназы (ЛДГ) в лейкоцитах цельной крови проводилось по методу Р.П. Нарцисова (1986). Оценка результатов проведена визуальной морфометрией с помощью светооптического микроскопа (увеличение 15 × 70 под водной иммерсией или 10 × 90, 15 × 90 под масляной иммерсией). Активность ферментов при визуальной морфометрии выражена в условных единицах, соответствующих среднему числу гранул формазана, приходящихся на одну клетку. Исследована активность следующих ферментов:
- СДГ – основной энергетический фермент, катализирует окисление янтарной кислоты, позволяет с высокой степенью достоверности судить о функциональной активности всего митохондриального аппарата. Локализуется на внутренней мембране митохондрий;
- альфа-ГФДГ – фермент, отражающий работу глицерофосфатного челночного механизма по транспорту электрон-эквивалентов из цитоплазмы в митохондрии, а также обмен фосфолипидов;
- ЛДГ – фермент, катализирующий обратимое восстановление пировиноградной кислоты до молочной в процессе гликолиза. В организме представлен 5 изоферментами;
- ГДГ – фермент класса оксидоредуктаз, катализирующий взаимопревращения L-глутаминовой и 2-оксоглутаровой кислот.
Поскольку разнонаправленные изменения активности ферментов могут нивелировать их средние показатели, дети из каждой группы были разделены на две подгруппы: «А» – дети с более высоким значением активности СДГ и «Б» – дети с относительно более низким значением активности СДГ. Мы считаем такое деление целесообразным в случаях обследования детей без грубых «первичных митохондриальных» нарушений, так как оно, по нашему мнению, отражает два варианта (стадии) дизэнергетического состояния: относительное повышение активности указанного фермента свидетельствует о компенсированной реакции клеточного энергообмена на тот или иной патологический процесс, а снижение – об относительно декомпенсированной реакции.
Выбор ферментного статуса лейкоцитов, как индикатора воздействия, основывается на многих клинико-экспериментальных исследованиях, в которых убедительно доказано, что лейкоциты – это клетки, выполняющие не только специальные функции иммунной защиты, но и являющиеся элементами единой информационной системы, точно отражающей состояние организма и процесс его развития. Кроме того, лейкоциты, будучи мигрирующими клетками, способны отражать изменения во всех клеточных популяциях организма [6].
Тестирование у всех детей исходно и после курса терапии проводилось в одно и то же время, в первой половине дня.
Результаты исследования
Проведенное биохимическое исследование крови выявило признаки митохондриальной дисфункции и тканевой гипоксии у детей с различными проявлениями аутизма. В результате проведенных цитохимических исследований у 28 детей с аутизмом (87,5%) были выявлены признаки полисистемной митохондриальной дисфункции. Из них у 12 (37,5%) пациентов установлено наличие отклонений от нормативных показателей по двум ферментам, у 13 (40,6%) – по трем ферментам и у 3 (9%) – по всем четырем ферментам. В данной группе признаки тканевой гипоксии проявлялись снижением уровня активности альфа-ГФДГ у 18 (56%), активности ГДГ – у 19 (59%), повышения активности ЛДГ – у 21 (66%) обследованного ребенка. В то же время уровень активности СДГ у 9 (28%) детей был ниже, а у 13 (40,6%) превышал показатели контрольной группы. Результаты исследования показателей активности ферментов представлены в таблице. При этом средние показатели активности ГДГ были статистически достоверно ниже (p < 0,05), чем в контрольной группе, но по остальным ферментам средние показатели достоверно не различались.
В связи с вышеприведенными результатами оценки цитохимических показателей, имеющих разнонаправленные изменения, не учитываемые при изучении средних значений, в исследовании данные параметры были раздельно оценены у детей с относительно сниженными и повышенными показателями активности СДГ. Такой подход представляется целесообразным, так как позволяет дифференцированно оценивать детей с признаками компенсаторного напряжения полисистемной митохондриальной активности (группа с повышенными значениями активности СДГ) и детей с вероятными более серьезными нарушениями (декомпенсацией) тканевого энергообмена (группа со снижением активности СДГ).
Углубленный анализ цитохимических показателей в группе из 9 детей со сниженным относительно контрольных показателей уровнем СДГ показал: у 7 (77,8%) из обследованных детей выявлено также снижение уровней активности альфа-ГФДГ и ГДГ и только у 2 (22%) отмечено повышение уровня активности ЛДГ. В то же время среди 13 детей с исходно повышенным относительно контрольных показателей уровнем активности СДГ у 6 выявлено только повышение активности СДГ и ЛДГ. Среди данной группы у 5 (38%) пациентов было также установлено повышение активности вышеперечисленных ферментов и сниженное содержание альфа-ГФДГ и ГДГ.
При анализе результатов в группе детей с исходно низкими (16,24 ± 0,45 усл. ед.; контроль – 20,6 ± 0,83 усл. ед.) показателями активности СДГ до курса энерготропной терапии отмечается статистически достоверное (p < 0,05) снижение активности митохондриальных ферментов: альфа-ГФДГ – 8,01 ± 0,58 усл. ед. (контроль – 12,5 ± 0,56 усл. ед.), ГДГ – 7,56 ± 0,59 усл. ед. (контроль – 12,4 ± 0,83 усл. ед.). Уровень активности ЛДГ в данной группе превышал контрольные показатели и составлял 17,43 ± 1,63 усл. ед. при нормальных величинах 13,5 ± 1,14 усл. ед.
По результатам проведенного анализа, в группе детей с исходно повышенными показателями активности СДГ (24,94 ± 0,58 усл. ед.; контроль – 20,6 ± 0,83 усл. ед.) до курса энерготропной терапии отмечается статистически достоверное (p < 0,05) повышение активности ЛДГ – 20,32 ± 0,97 усл. ед. (контроль – 13,5 ± 1,14 усл. ед.). При этом снижались средние показатели активности альфа-ГФДГ – 10,67 ± 0,56 усл. ед. (контроль – 12,5 ± 0,56 усл. ед.) и ГДГ – 11,09 ± 0,82 усл. ед. (контроль – 12,4 ± 0,83 усл. ед.).
Таким образом, при проведении цитохимического исследования у детей с клиническими проявлениями раннего детского аутизма были выявлены различные митохондриальные нарушения. Полученные данные позволяют предположить патогенетическую роль нарушений энергообмена в развитии проявлений раннего детского аутизма.
На момент обследования все дети получали препарат рисперидон (производное бензизоксазола, характеризующийся нейролептическим, антипсихотическим действием) в индивидуальных дозировках. На фоне курса энерготропной терапии изменений дозировок и комбинаций психотропного препарата не проводилось.
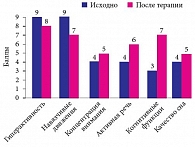
При оценке клинических проявлений раннего детского аутизма у детей после курса комплексной энерготропной терапии, как представлено на рис. 1, было отмечено в среднем по группе изменение следующих показателей относительно исходных значений: уменьшение выраженности стереотипных движений на 25%, уменьшение гиперактивности на 12,5%, улучшение познавательных функций на 57%, повышение концентрации внимания на 20%, увеличение на треть объема активной речи.
При анализе цитохимических показателей у детей с аутизмом после применения энерготропной терапии отмечается нормализация активности ферментов СДГ и повышение альфа-ГФДГ и ГДГ. Результаты исследования показателей активности ферментов до и после курса энерготропной терапии представлены в таблице.
При более детальном анализе эффективности комплексной энерготропной терапии по группам в зависимости от исходного уровня СДГ было установлено, что клинически наилучшие результаты получены в группе детей с исходно сниженными значениями активности СДГ, чем в группе с повышенной активностью данного фермента.
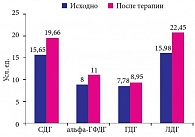
Как видно из данных рис. 2, у детей с исходно низкими показателями активности СДГ после курса терапии отмечалось повышение активности и достижение нормальных показателей СДГ (исходно 16,24 ± 0,45 усл. ед.; после курса терапии 19,66 ± 0,38 усл. ед.), альфа-ГФДГ (исходно 8,01 ± 0,58 усл. ед.; после курса терапии 11,04 ± 1,42 усл. ед.) и ГДГ (исходно 7,56 ± 0,59 усл. ед.; после курса терапии 8,96 ± 0,69 усл. ед.). После курса энерготропной терапии отмечалась тенденция к повышению активности ЛДГ (исходно 17,43 ± 1,63 усл. ед.; после курса терапии 23,11 ± 2,37 усл. ед.).
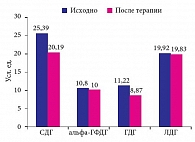
У детей с ранним детским аутизмом с исходно повышенными показателями активности СДГ после курса энерготропной терапии отмечалась общая тенденция к снижению уровня активности ферментов: альфа-ГФДГ – с 10,67 ± 0,56 усл. ед. до 10,01 ± 2,02 усл. ед.; ГДГ – с 11,09 ± 0,82 усл. ед. до 8,88 ± 2,13 усл. ед.; ЛДГ – с 20,32 ± 0,97 усл. ед. до 19,88 ± 2,55 усл. ед. При исследовании в динамике отмечено достижение нормальных показателей СДГ (исходно 24,94 ± 0,58 усл. ед.; после курса терапии 20,19 ± 2,44 усл. ед.) (рис. 3).
Обсуждение результатов
При проведении цитохимического исследования у детей с клиническими проявлениями раннего детского аутизма нами выявлены гетерогенные признаки нарушений клеточного энергообмена. Полученные данные позволяют предположить патогенетическую роль нарушений энергообмена в развитии проявлений аутизма у детей. У 46,8% пациентов (с повышением активности СДГ) можно говорить о неспецифическом «напряжении» митохондриальных функций, что наиболее вероятно объясняется компенсаторными механизмами. Эффективность энерготропной терапии у таких детей относительно невысока. У 31% пациентов (с пониженной активностью СДГ), очевидно, имеет место энергодефицитное состояние, такие пациенты более чувствительны к энерготропной терапии. Важно отметить, что в этой группе детей с аутизмом характер лабораторных показателей (выраженное снижение активности альфа-ГФДГ и ГДГ, повышение концентрации продуктов перекисного окисления липидов, изменение коэффициента «лактат/пируват») указывает на наличие более серьезной полисистемной митохондриальной дисфункции, возможно, играющей значительную патогенетическую роль в развитии нарушений высшей нервной деятельности.
Важным, с нашей точки зрения, является использование в качестве «базового» препарата раствора L-карнитина. Известно, что карнитин принимает непосредственное участие в катаболизме липидов, обеспечивая перенос длинноцепочечных жирных кислот в виде сложных эфиров (ацилкарнитинов) из цитоплазмы через наружную и внутреннюю митохондриальные мембраны в матрикс митохондрий. Внутри митохондрий транспортированные жирные кислоты подвергаются бета-окислению с образованием ацетил-кофермента А (КоА), который служит субстратом для цикла трикарбоновых кислот Кребса и последующего синтеза аденозинтрифосфата (АТФ) в организме. Наряду с этим окисление жирных кислот – главный путь кетогенеза, а кетоновые тела являются дополнительным энергетическим источником для периферических тканей и головного мозга. Влияние карнитина на жировой обмен осуществляется также его участием в цитоплазматическом синтезе жирных кислот путем обратного переноса необходимых для этого ацетильных групп митохондриального ацетил-КоА через митохондриальную мембрану в цитоплазму. Помимо перечисленного, карнитин регулирует отношение «ацил-КоА/свободный КоА» в митохондриях. Связывая ацильный радикал, он высвобождает КоА и тем самым активирует интенсивность энергетического метаболизма в тканях. Исключительное значение карнитина становится очевидным в условиях высокого расходования энергетических ресурсов – при заболеваниях, усиленных физических или эмоциональных нагрузках, а также при недостаточном питании. После истощения запасов углеводов липиды становятся главным источников синтеза АТФ в организме.
Другая важная функция карнитина заключается в его способности образовывать соединения с различными органическими кислотами, являющимися промежуточными продуктами окислительных процессов. Данные вещества, накапливаясь в митохондриях и цитоплазме клеток, оказывают мембранотоксическое действие и ингибируют активность ряда ферментов. Выведение этих токсичных органических соединений из организма происходит через почки в виде ацилкарнитинов.
Таким образом, обоснованное теоретически применение препарата L-карнитина – Элькара – получило в нашей работе убедительное подтверждение его эффективности при нарушениях психологического развития у детей.
Нет сомнения, что полученные результаты, так же как и расширение спектра доступных энерготропных препаратов, таких, например, как Кудевита (лекарственный препарат коэнзима Q10), являются весомым основанием для дальнейшего развития подобных исследований.
В заключение отметим, что комплексная энерготропная терапия раннего детского аутизма способствует улучшению клинической картины заболевания. У пациентов улучшаются поведенческая (отмечается уменьшение выраженности стереотипных движений и гиперактивности) и познавательная функции, повышается концентрация внимания, увеличивается объем активной речи, что в целом способствует повышению качества жизни пациентов с аутизмом и их семей.
Opportunities of energotropic therapy in combination treatment of early childhood autism
A.I. Krapivkin, V.S. Sukhorukov, I.P. Kireyeva
Federal State Budgetary Institution ‘Federal Research Institute for Pediatrics and Children’s Surgery’ of the Ministry of Health of Russia, Moscow
Contact person: Aleksey Igorevich Krapivkin, krapivkin@pedklin.ru
Results of cytochemical study conducted in 32 children aged between 3 and 12, with clinical manifestations of early childhood autism who were found to have heterogenous signs of impaired cellular energy turnover are analyzed. The data obtained allow to assume that disturbances of energy turnover play a pathogenetic role in development of autism in children. Activity of succinate dehydrogenase (SDH) was increased in 46.8% patients evidencing about a non-specific “exertion” of mitochondrial functions that most plausibly was due to compensatory mechanisms. It is worth noting that energotropic therapy in these patients was not highly effective. Energy deficiency was documented in 31% patients with reduced SDH activity. When clinical picture of disease in such children was assessed after applying a course of combination therapy they were found to have improved behavioral function (reduced intensity of stereotyped movements by 25%, reduced hyperactivity by 12.5%) as well as improved cognitive function by 57%, increased attention concentration by 20%, increased active speech level by 33%. Enzyme activity was normalized after using energotropic therapy in children with autism as assessed by cytochemical assays.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.