Окислительный стресс и мужское бесплодие – взаимосвязанные пандемии XXI в. Современные фармакотерапевтические возможности патогенетической коррекции нарушений сперматогенеза препаратами L-карнитина/ацетил-L-карнитина
- Аннотация
- Статья
- Ссылки
- English
![Рис. 1. Золотой треугольник оксидативного баланса в норме [6]](/upload/resize_cache/iblock/67c/195_350_1/spermaktin1.jpg)
![Рис. 2. Модуляция редокс-потенциала биологической среды при физиологическом и патологическом окислительном стрессе [7]](/upload/resize_cache/iblock/8df/195_350_1/spermaktin2.jpg)
![Рис. 3. Полиорганная мультифакторная патология, индуцируемая патологическим ОС [8]](/upload/resize_cache/iblock/048/195_350_1/spermaktin3.jpg)
![Рис. 4. Этиологические факторы спермального окислительного стресса [33]](/upload/resize_cache/iblock/814/195_350_1/spermaktin4.jpg)
Введение
Согласно определению Всемирной организации здравоохранения, понятие «здоровый человек» подразумевает, наряду с психическим и социальным здоровьем, репродуктивное. С сожалением приходится констатировать неблагополучие всех трех указанных параметров в XXI в. Наибольшее опасение вызывают современные негативные тенденции, характеризующие состояние репродуктивной функции. В России сохраняется один из самых высоких показателей семейного бесплодия, достигающий 19–20% (в Европе около 15%). Сложившаяся ситуация может привести к существенному сокращению численности населения страны в ближайшие десятилетия, если не брать в расчет рост населения за счет иммиграции.
Роль мужского бесплодия начала переосмысливаться только сейчас, когда доля «мужского» фактора в структуре семейного бесплодия стала катастрофически расти и достигла 50%. При этом мужское бесплодие неполноценно диагностируется и лечится. Несмотря на множество причин нарушения мужской фертильности, все формы мужского бесплодия имеют общие универсальные клеточно-молекулярные механизмы реализации негативных эффектов этиологических факторов на всех этапах сперматогенеза. В качестве одного из универсальных патогенетических факторов рассматривается окислительный стресс (ОС). Способность ОС запускать мультифакторную полиорганную патологию, включая репродуктивные нарушения как у мужчин, так и у женщин, обусловливает медицинскую научно-практическую значимость этой проблемы [1].
Окислительный стресс: общие патофизиологические механизмы, понятие о физиологическом и патологическом окислительном стрессе
Окислительно-восстановительные реакции (ОВР), или редокс-реакции (от англ. reduction oxidation – восстановление/окисление), – ключевые физиологические процессы, необходимые для жизнедеятельности любого живого организма. Энергия, освобождающаяся в ходе этих реакций, расходуется на поддержание всех параметров гомеостаза и обеспечение нормального функционирования всех структурных элементов клеток и тканей [1].
С химической точки зрения ОВР – это встречно-параллельные химические реакции. Они протекают с изменением степеней окисления атомов (ионов) реагирующих веществ. Изменение реализуется путем перераспределения электронов между атомом-окислителем (акцептором) и атомом-восстановителем (донором). В аэробном организме человека ключевым окислителем выступает кислород, поэтому ОВР составляют суть нормальной физиологии. Физиологический ОС – одно из фундаментальных условий нормального функционирования всех живых аэробных клеток и систем. Около 95% всего потребляемого кислорода в клетке восстанавливается в митохондриях до воды в процессе окислительного фосфорилирования и синтеза АТФ. Остальные 5% в результате различных реакций неизбежно превращаются в активные формы кислорода, или свободные радикалы (СР) [2, 3].
В норме целый ряд биохимических процессов, протекающих в аэробных организмах, сопряжен с естественным образованием СР. Однако СР, образующиеся в ходе ОВР, существенно различаются прежде всего по функциональной нагрузке. Так, одни (первичные) СР полезны для организма, поскольку участвуют в целом спектре необходимых для нормальной жизнедеятельности физиологических реакций:
- регуляции клеточных процессов (клеточное деление, дыхание) через зависимый от активных форм кислорода сигналинг;
- обеспечении бактерицидного и онкостатического эффектов;
- активации иммунных реакций лейкоцитов;
- оказании противовоспалительного системного и локального ответа и т.д.
Наиболее значимы для организма такие первичные СР, как супероксидный анион-радикал (O2-), гидроксильный радикал (•ОН), перекись водорода (H2O2), синглетный кислород (1O2), гипохлорная кислота (HOCl), оксид азота (NO.), пероксинитрит (ONOO-) [1–3]. Вторичные СР, в отличие от первичных, не выполняют физиологически полезных функций, напротив, они разрушительно действуют на клеточные структуры, стремясь отнять электроны у «полноценных» молекул, вследствие чего «пострадавшая» молекула сама становится слабым СР (третичным) [1–3].
В норме клетки имеют особую систему защиты (антиоксидантную) от образующихся в процессе жизнедеятельности СР. Антиоксидантная система образована низкомолекулярными антиоксидантами и специализированными антиоксидантными ферментами. К ключевым антиоксидантным ферментам относятся ферменты специализированной ферментной системы, в которую входят супероксид-дисмутаза, каталаза и глутатион-пероксидаза. Они катализируют реакции, в результате которых СР и перекиси превращаются в неактивные соединения. Кроме того, существуют неспециализированные ферментные системы по инактивации свободных радикалов, представленные низкомолекулярными антиоксидантами ‒ витаминами А, Е, К, С, D, стероидными гормонами, флавоноидами, полифенолами (витамином Р, коэнзимом Q10, или убихиноном), тиол-дисульфидной системой на основе глутатиона (в частности, альфа-липоевой кислотой), ароматическими соединениями, мочевой кислотой, таурином, карнозином, ацетил-L-карнитином, ацетилцистеином, хелаторами ионов железа, цинком, селеном и др. [4, 5].
Многочисленные компоненты клеточной антиоксидантной системы, ингибируя избыточность СР, поддерживают ОС на физиологически адекватном уровне. «Физиологичность» сохраняется до тех пор, пока соблюдается принцип золотого треугольника оксидативного баланса. Только динамическое равновесие между уровнем продукции СР, активностью антиоксидантной системы и нормальным функционированием трансмиттерных (передающих биологические сигналы) биомолекул может обеспечить биологическую безопасность клетки и всего организма в целом (рис. 1) [6]. При нарушении золотого треугольника оксидативного баланса (гиперпродукции СР и/или недостаточной скорости их инактивации, дефиците/истощении факторов антиоксидантной системы или их сочетания) «физиологический» ОС быстро и незаметно переходит в избыточно выраженный патологический (рис. 2) [7].
Патологический ОС поражает практически все структуры организма, включая ДНК, белки и липиды мембран. На клеточно-тканевом уровне он проявляется различными патологическими процессами:
- нарушением гомеостаза, в частности дисбалансом между про- и противовоспалительными цитокинами (хроническое системное воспаление);
- ишемией (эндотелиальной дисфункцией); гипоксией (мембранопатии вследствие активации перекисного окисления липидов мембран клеток);
- апоптозом и некрозом клеток;
- нарушением клеточной рецепции и перцепции (арефлексия и гипорефлексия клетки);
- вегетативно-медиаторной дисфункцией клетки;
- энергетическими и метаболическими нарушениями (митохондриальная дисфункция) и др.
При патологическом ОС в клетке накапливаются кислые продукты деградации (нарушение клеточного редокс-потенциала), что ведет к сдвигу рН биологических жидкостей и цитоплазмы клеток в кислую сторону (закислению, или ацидозу). В итоге эти гомеостатические нарушения приводят сначала к функциональной, а при длительной персистенции и/или прогрессировании патологического ОС – и к органической клеточно-тканевой патологии. Она предопределяет развитие полиорганных и мультифакторных системных нарушений, включая репродуктивные потери (рис. 3) [8].
Следует заметить, что большинство клеток способны переносить умеренный ОС благодаря тому, что обладают репаративной системой, выявляющей и удаляющей поврежденные окислением молекулы, которые затем заменяются. Кроме того, клетки могут повысить антиоксидантную защиту в ответ на усиление ОС. Однако при патологическом ОС все молекулы живых организмов (липиды, белки, нуклеиновые кислоты и углеводы) становятся потенциальными мишенями окислительного повреждения [9–11]. Независимо от выраженности и природы ОС первый удар чаще всего принимают высокоспециализированные и наиболее энергопотребляющие клетки. Они чувствительны даже к минимальному нарушению процессов митохондриального синтеза энергии вследствие ОС, очень быстро и закономерно приводящему к изменению клеточного метаболизма и энергетического обмена. Такими клетками в организме человека являются нейроны (нервная система), миоциты (мышечная система) и половые клетки (репродуктивная система), а также быстро обновляющиеся клетки крови и кожного покрова [8, 12]. Вот почему даже незначительный патологический ОС способен привести к существенному снижению фертильности у практически здоровых мужчин [13–15].
Окислительный стресс и сперматогенез в норме и при мужском бесплодии
К основным физиологическим клеточным источникам СР в эякуляте относятся, как ни парадоксально, сами сперматозоиды, которые с самых ранних этапов сперматогенеза способны вырабатывать небольшие количества активных форм кислорода, представляющих собой не что иное как СР [16]. Эти активные молекулы вовлечены в процессы конденсации хроматина ДНК сперматозоидов и регулируют количество зародышевых клеток путем индукции апоптоза или пролиферации материнских сперматогенных клеток – сперматогоний [17]. В зрелом эякуляте активные формы кислорода, или СР, играют важную роль в обеспечении акросомальной реакции, стабильности митохондриальной ДНК и подвижности сперматозоидов. Они также могут функционировать как сигнальные молекулы (вторичные посредники клеточной сигнализации).
Известно несколько механизмов образования СР в нормальном эякуляте. Первый связан с присутствием ферментативного комплекса с участием HAДФ-оксидазы в наружной клеточной мембране сперматозоида, второй – с работой расположенных в хвостовой части сперматозоида митохондрий, которые пропускают электроны из дыхательной цепи с участием НАД-оксидоредуктазы (диафоразы). Последняя тесно связана с ксантиноксидазой, которая имеется как в сперматозоидах, так и в семенной плазме и также способна индуцировать синтез небольшого количества спермальных СР [18]. Клетки эякулята с нарушенной морфологией, преимущественно с цитоплазматическими аномалиями, указывающими на их незрелость и сниженный потенциал рождаемости, производят больше СР, чем сперматозоиды с нормальной морфологической структурой [19, 20]. Существует также разница между количеством СР, продуцируемых сперматозоидами на разных стадиях созревания [21].
Еще один источник СР в эякуляте – лейкоциты, которые в физиологических условиях производят их до 1000 раз больше, чем сперматозоиды. Такой высокий уровень продукции СР необходим для защиты клеток от инфекций и воспаления. Активированные лейкоциты инфильтрируют пораженный орган, выделяя большие количества СР, что ведет к ограничению и ликвидации большинства инфекционных агентов [22]. Повышенное количество лейкоцитов (лейкоцитоспермия) на фоне доказанного наличия инфекционных агентов в эякуляте (бактериоспермии) достоверно ассоциируется с ухудшением оплодотворяющей способности эякулята, в частности при хронических инфекционных простатитах [23].
Однако лейкоцитоспермия может быть также результатом воздействия факторов неинфекционной природы, например длительного сексуального воздержания или «компрессионной» патологии органов мошонки (варикоцеле, гидроцеле, пахово-мошоночные грыжи). В таких случаях при микробиологических исследованиях эякулята инфекционный агент чаще всего не культивируется [24–27].
В спермоплазме существует спермальная антиоксидантная система защиты. Она состоит как из ферментных, так и неферментных факторов и низкомолекулярных соединений с антиоксидантным потенциалом и обеспечивает сохранение оптимального оксидативного баланса эякулята. Главный компонент спермальной антиоксидантной системы называется «ферментативной триадой», так как состоит из трех ключевых ферментов-антиоксидантов: супероксиддисмутазы (СОД), каталазы и глутатион-пероксидазы [13].
СОД – металл-содержащие ферменты, катализирующие дисмутацию реакции супероксидного аниона и присутствующие как внутри клетки, так и вне ее. Две внутриклеточные формы СОД первого типа содержат медь и цинк (Cu-СОД и Zn-СОД) и локализуются в основном в цитоплазме сперматозоидов. Внутриклеточная форма СОД второго типа содержит марганец (Mn-СОД) и локализуется преимущественно в активных центрах митохондрий сперматозоидов. Формы СОД третьего типа (внеклеточные) могут находиться как в свободном виде, так и в связанном с полисахаридами состоянии. По структуре СОД третьего типа похожа на СОД второго типа, но вместо марганца содержит в активном центре медь и цинк [28]. Высокая антиоксидантная активность спермоплазмы в норме на 75% обеспечивается СОД первого типа и на 25% – СОД третьего типа, которые скорее всего синтезируются в предстательной железе [29].
Каталаза эякулята катализирует разложение пероксида водорода на молекулярный кислород и воду. Характерная особенность структуры каталазы – наличие системы гема с центрально расположенным атомом железа. Высокая активность каталазы была выявлена в пероксисомах, митохондриях, эндоплазматическом ретикулуме и цитозоле многих типов клеток и тканей, включая семенную плазму, в которой ее источником является секрет предстательной железы [30].
Третий специализированный фермент – глутатион-пероксидаза катализирует процессы превращения перекиси водорода и органических пероксидов, включая пероксиды фосфолипидов [28]. В активном центре глутатион-пероксидазы располагается селен в форме селеноцистеина. Фермент экспрессируется преимущественно в митохондриальной матрице сперматозоидов, хотя существует и его ядерная форма, защищающая ДНК сперматозоидов от ОС [31]. По имеющимся данным, источником глутатион-пероксидазы в спермоплазме, как и других антиоксидантных специализированных ферментов, является предстательная железа [32].
Кроме того, в спермоплазме в норме присутствуют неспециализированные ферменты-антиоксиданты, которые взаимодействуют со специализированной «ферментной триадой» эякулята и без которых полноценная работа спермальной антиоксидантной системы в целом невозможна: глутатион, пантотеновая кислота, коэнзим Q10, L-карнитин, витамины A, E, C и B, минералы (цинк, селен, хром, медь) [14, 33–35].
Таким образом, сперматогенез даже у здорового мужчины неизбежно сопровождается образованием физиологически минимального количества СР, необходимых для адекватного протекания всех этапов образования и созревания половых клеток. Контроль за «физиологичностью» спермального ОС осуществляет соответствующая спермальная антиоксидантная система, которая одновременно обеспечивает оптимальный уровень защиты от любой избыточной продукции или чрезмерной активности образующихся в эякуляте СР. Функциональная недостаточность любого из компонентов спермальной антиоксидантной системы может вызвать снижение общей антиоксидантной способности эякулята. Даже при физиологическом уровне образования СР это знаменует развитие уже патологического спермального ОС – универсального патогенетического механизма мужского бесплодия независимо от его причины (рис. 4) [33].
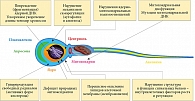
В настоящее время известны многие клеточно-молекулярные механизмы, посредством которых патологический ОС негативно влияет на все этапы сперматогенеза, от активации сперматогоний до окончательного созревания спермиев, существенно снижая мужскую фертильность (рис. 5) [36, 37].
Несмотря на такое многообразие вариантов стресс-индуцированных клеточных нарушений, наиболее критические патологические изменения, обусловленные негативным воздействием патологического ОС на половые клетки и достоверно снижающие оплодотворяющую способность эякулята, происходят в мембранах сперматозоидов (мембранопатия), митохондриях (митохондриальная дисфункция и мутации митохондриальной ДНК) и генетическом аппарате сперматозоидов (мутации и фрагментация ядерной ДНК) [38–45].
Современные возможности патогенетической коррекции патологического окислительного стресса при мужском бесплодии
В настоящее время ни у кого не вызывает сомнений необходимость проведения базовой метаболической антиоксидантной терапии мужского бесплодия независимо от непосредственной его причины (урологической, эндокринологической, иммуновоспалительной или при их сочетании), а тем более при неуточненных (идиопатических) формах. Кроме того, само по себе понятие «идиопатическое мужское бесплодие» вовсе не означает отсутствия у мужчины явных или скрытых гормонально-метаболических причин нарушения репродуктивной функции, роль которых явно недооценивается. К этим причинам относятся все случаи «необъяснимой» с точки зрения уролога-андролога патоспермии у молодых мужчин с ожирением, инсулинорезистентностью, сахарным диабетом, метаболическим синдромом, дефицитом витамина D, гипогонадизмом, нарушениями сна (дефицит мелатонина) и другими гормонально-метаболическими системными нарушениями. Указанные нарушения могут индуцировать системный и локальный (спермальный) ОС и обусловливать его неизбежное прогрессирование при отсутствии своевременной диагностики и максимально ранней патогенетической коррекции.
При подозрении на якобы идиопатическое бесплодие важно рассматривать метаболизм и гомеостаз системно, а не разделять организм на половую систему и «экстрагенитальную» патологию [46–51].
Согласно последним публикациям и метаанализам применение препаратов с антиоксидантным эффектом в качестве эмпирической терапии мужского бесплодия и в рамках подготовки к протоколу экстракорпорального оплодотворения (ЭКО) обоснованно и повышает вероятность достижения беременности и рождения ребенка в паре [52–55]. В таблице приведены только те лекарственные и биологически активные вещества, положительный эффект которых уже доказан и которые рекомендуются к применению в качестве эмпирической терапии бесплодия и подготовки мужчины к протоколу ЭКО [56–85].
L-карнитин/ацетил-L-карнитин: физиологическая роль в клеточном метаболизме
L-карнитин, или 3-аминомасляная кислота, – природное соединение, а также поливитаминное вещество, необходимое для нормального метаболизма практически всех клеток организма. L-карнитин активно участвует в клеточном метаболизме жирных кислот, будучи уникальным переносчиком длинноцепочечных жирных кислот из клеточного цитозоля через мембрану митохондрий в крипты их матрикса, где происходит их дальнейший метаболизм, направленный на синтез энергии (АТФ). Основные этапы синтеза АТФ в митохондриях: мобилизация ацетил-КоА (карнитиновый цикл), цикл трикарбоновых кислот (цикл Кребса) и перенос электронов в окислительное фосфорилирование (дыхательная цепь). Карнитиновый цикл – начальный важнейший этап энергетического метаболизма клетки. Именно L-карнитин транспортирует необходимые для дальнейшего «сгорания» в цикле Кребса жирные кислоты в матрикс митохондрий, где активно взаимодействует с ацетил-КоА. В результате происходит ацетилирование L-карнитина (ацетил-L-карнитин) и образуется КоА – важнейший ко-фермент цикла Кребса. При этом в митохондриях должно обязательно сохраняться динамическое метаболическое равновесие в системе «ацетил-КоА + L-карнитин <=> ацетил-L-карнитин + КоА». Эта система – одна из основных ацетильных буферных систем клетки, поддерживающих регенерацию митохондрий [86].
Самые высокие концентрации L-карнитина в мужской репродуктивной системе обнаружены в придатках яичек (в 2000 раз выше его концентрации в цельной крови) [87–89]. Высокий уровень жирных кислот в придатках яичек – результат активного секреторного процесса. В исследованиях показана положительная связь между начальным движением сперматозоидов, повышенным уровнем жирных кислот в придатках яичек и ацетил-L-карнитином в эякуляте [90–93]. Таким образом, от нормального уровня L-карнитина и образующегося из него ацетил-L-карнитина существенно зависит энергетический клеточный обмен. При этом только около 30% L-карнитина в организме имеет эндогенное происхождение, а 70% поступает с пищей. Именно алиментарный дефицит L-карнитина во многом предопределяет возможность развития нарушений клеточного энергетического обмена в любом возрасте и практически при любом заболевании, включая бесплодие [94].
Влияние препаратов L-карнитина/ацетил-L-карнитина на макрохарактеристики сперматозоидов
Результаты многочисленных экспериментальных исследований, подтвержденные большим клиническим опытом, свидетельствуют о высокой эффективности применения L-карнитина/ацетил-L-карнитина в консервативной терапии мужского бесплодия, включая идиопатическую патозооспермию. Данная комбинация достоверно приводит к увеличению общего количества сперматозоидов и морфологически нормальных сперматозоидов в эякуляте, повышению их общей и прогрессивной подвижности (за счет улучшения митохондриального синтеза энергии, необходимой для активной кинетики), а также способствует повышению «выживаемости» половых клеток [95].
В ряде двойных слепых контролируемых клинических исследований выявлена достоверная положительная связь между уровнями L-карнитина, ацетил-L-карнитина и подвижностью сперматозоидов у бесплодных мужчин. При этом связь была выраженнее у мужчин с более низкой исходной подвижностью сперматозоидов [60, 96].
G. Balercia и соавт. (2005) оценили влияние L-карнитина, ацетил-L-карнитина и их комбинации на кинетику сперматозоидов и общую способность поглощения свободных радикалов кислорода. В рандомизированном двойном слепом контролируемом исследовании приняли участие 60 мужчин с идиопатической астенотератозооспермией. Результаты шестимесячной терапии показали высокую эффективность препаратов L-карнитина и ацетил-L-карнитина. Во время терапии в парах, где мужчины принимали L-карнитин, было зарегистрировано девять беременностей и еще пять беременностей в парах, где мужчины получали комбинированную терапию L-карнитином и ацетил-L-карнитином [97].
A. Garolla и соавт. (2005) изучали эффективность L-карнитина у 30 мужчин с астенотератоспермией в рамках двойного слепого исследования. Пациенты получали плацебо в течение трех месяцев, а затем L-карнитин в суточной дозе 2 г ежедневно в течение трех месяцев. Было отмечено улучшение подвижности сперматозоидов в группе мужчин с нормальным уровнем глутатион-пероксидазной активности [98].
Позитивные результаты применения комплекса L-карнитина и ацетил-L-карнитина в лечении бесплодия у мужчин были получены в ряде недавно проведенных крупных российских клинических исследований [99–102].
В.В. Михайличенко и соавт. (2014) достоверно установили, что через три месяца применения комплекса L-карнитина и ацетил-L-карнитина (Спермактин®) доля сперматозоидов с поступательным движением (А+В) и доля морфологически нормальных форм сперматозоидов увеличились более чем в два раза, концентрация сперматозоидов в эякуляте выросла в 2,3 раза [101].
И.В. Виноградов и соавт. (2014) оценивали изменения в морфологии сперматозоидов после трехмесячного применения комплекса ацетил-L-карнитина и L-карнитина фумарата в комбинированной терапии с другими препаратами. Положительная динамика наблюдалась у 53,2% пациентов, значимых изменений не произошло у 44,3% пациентов, отрицательная динамика зафиксирована у 1,5% больных. Корреляционный анализ не выявил достоверной связи изменения морфологии сперматозоидов с остальными показателями спермограммы. Анализ по сопоставлению изменений доли морфологически нормальных форм сперматозоидов с числом беременностей у партнерш пациентов показал, что все беременности наступали при минимальном значении морфологии сперматозоидов в 8% [102].
По данным другого исследования, кратковременное применение L-карнитина может положительно повлиять на количество сперматозоидов и привести к успешной беременности при процедуре интрацитоплазматической инъекции сперматозоида в яйцеклетку [103].
Таким образом, позитивные эффекты L-карнитина/ацетил-L-карнитина в отношении кинематических и макроморфологических характеристик сперматозоидов установлены достаточно давно и хорошо изучены в исследованиях, выполненных на высоком доказательном уровне [59, 104, 105].
Влияние препаратов L-карнитина/ацетил-L-карнитина на микрохарактеристики (фрагментацию ДНК) сперматозоидов
В последние годы были проведены клинико-экспериментальные исследования, в которых среди прочих рутинных стандартных параметров эякулята (концентрация, подвижность и макроморфология) целенаправленно изучался спермальный ОС. В частности, оценивались частота и степень выраженности фрагментации ДНК сперматозоидов с помощью соответствующих тест-систем (TUNEL-теста). Оказалось, что кроме уже известного эффекта – улучшение энергетического обмена в сперматозоидах (ликвидация спермальной митохондриальной дисфункции), L-карнитин/ацетил-L-карнитин дополнительно нивелировал влияние патологического спермального ОС, повышая устойчивость генетического аппарата (ДНК) сперматозоидов. Это проявлялось снижением частоты и степени выраженности фрагментации ДНК. Так, по экспериментальным данным, L-карнитин при добавлении в охлажденный эякулят животных более существенно (на 15,6%) снижал выраженность повреждений ДНК окислительной природы (фрагментацию) по сравнению с пируватом (на 9,0% соответственно). Это позволяет рассматривать L-карнитин как потенциальный эффективный спермальный консервант [106]. В экспериментах также показана высокая эффективность L-карнитина в защите от воздействия акриламида – синтетического материала, который широко применяется и обладает определенными мутагенными эффектами [107].
Эксперименты с эякулятом самцов крыс свидетельствуют о том, что предварительное применение L-карнитина достоверно повышает устойчивость сперматозоидов к воздействию различных лекарственных тестикулярных токсинов, в частности онкологических препаратов. Этот факт крайне важен для решения актуальной проблемы сохранения фертильности у мужчин с онкологической патологией, поскольку прием химиопрепаратов в виде монотерапии или как компонента комбинированной терапии неизбежно сопровождается репродуктивными потерями, нередко необратимыми. Так, R.E. Cabral и соавт. (2014) в экспериментальной работе показали достаточно высокий протективный эффект L-карнитина в отношении часто применяемого в клинической практике мощного цитостатика доксорубицина. Через 64 дня эксперимента частота фрагментации ДНК сперматозоидов, оцененной по TUNEL-тесту, оказалась достоверно ниже у крыс, леченных L-карнитином/доксорубицином, по сравнению с крысами, получавшими только доксорубицин [108].
Добавление к криоконсервирующей среде L-карнитина в дозе 1–2 г приводило к значительному улучшению параметров человеческого эякулята после оттаивания по сравнению с образцами контрольной группы. В основной группе были лучше показатели общей и прогрессивной подвижности сперматозоидов, а также их жизнеспособности [109–111]. В другом исследовании добавление L-карнитина до процесса криоконсервации существенно снизило степень криоповреждений сперматозоидов как в астенозооспермических, так и в нормозооспермических образцах спермы, при этом защитный эффект был выраженнее именно при астенозооспермии [112].
Было показано, что дополнительное назначение поливитаминных препаратов, содержащих L-карнитин, в течение трех месяцев после оперативного лечения варикоцеле первой степени позволяло уменьшить частоту фрагментации ДНК на 22,1–34,3% и улучшить подвижность сперматозоидов в среднем на 31,3% на фоне увеличения общего количества сперматозоидов [113–115].
Каковы возможные механизмы защитного эффекта L-карнитина/ацетил-L-карнитина в отношении ДНК сперматозоидов? Одним из них может быть установленная способность L-карнитина/ацетил-L-карнитина существенно снижать уровень провоспалительных цитокинов и продуктов перекисного окисления липидов, в частности малондиальдегида, в спермоплазме. В результате достоверно снижается степень выраженности цитокинового воспаления и частота фрагментации ДНК сперматозоидов, увеличивается концентрация природных антиоксидантов (в частности, оксида азота NO) [116]. Другим потенциальным ДНК-протективным механизмом может быть способность L-карнитина/ацетил-L-карнитина обеспечивать первичную антиоксидантную защиту сперматозоидов, нивелируя негативные эффекты ОС в клеточном эндоплазматическом ретикулуме за счет снижения концентрации свободных жирных кислот и избыточного клеточного ацетил-коэнзима А [117, 118].
Препараты L-карнитина и ацетил-L-карнитина в рутинной российской практике
Вот уже почти 20 лет в России широко применяется оригинальный комплекс, состоящий из комбинации L-карнитина фумарата и ацетил-L-карнитина, обогащенной фруктозой и лимонной кислотой (Спермактин®). Комплекс оказывает метаболическое действие, стимулирующее сперматогенез, повышает концентрацию и общее количество сперматозоидов, улучшает их подвижность и морфологию (форму, строение и другие показатели).
L-карнитина фумарат и ацетил-L-карнитин обеспечивают нормальное созревание и увеличивают подвижность сперматозоидов. При этом L-карнитина фумарат лучше, чем L-карнитин, проникает через мембраны в матрикс митохондрий, будучи связанным с жирными кислотами. Поэтому L-карнитина фумарат интенсифицирует обменные процессы (включая энергетические) в мужских половых клетках, обеспечивает полноценное созревание сперматозоидов, стабилизируя их клеточные мембраны, снижает частоту фрагментации ДНК сперматозоидов.
Фруктоза – основной источник энергии для сперматозоидов, оказывает потенцирующее влияние на фертильные (оплодотворяющие) свойства эякулята. Лимонная кислота способствует разжижению семенной жидкости и активации гиалуронидазы – фермента, обеспечивающего проникновение сперматозоида в яйцеклетку [119].
Спермактин® прошел целый ряд доказательных клинико-лабораторных испытаний в России, поэтому рекомендован Лигой специалистов мужской репродукции для коррекции всех форм нарушений сперматогенеза и подготовки мужчин к протоколу ЭКО.
Совсем недавно в России стала доступна новая форма комплекса – Спермактин Форте®. В ней традиционный состав усилен еще одним мощным антиоксидантом-антигипоксантом с доказанным метаболическим эффектом (в том числе при мужском бесплодии) – альфа-липоевой кислотой (100 мг на саше) [120–123]. Это позволило оптимизировать и усилить антиоксидантные свойства комплекса, который, как и Спермактин®, имеет следующие официальные показания к применению:
- подготовка мужчин к зачатию;
- снижение подвижности и оплодотворяющей способности сперматозоидов;
- олигоастенозооспермия III–IV стадии;
- подготовка к проведению вспомогательных репродуктивных технологий (ЭКО, интрацитоплазматическая инъекция сперматозоида в яйцеклетку и др.);
- улучшение показателей эякулята при донорстве и криоконсервации;
- снижение фертильности, вызванное ОС.
Заключение
В настоящее время получены убедительные доказательства существенного негативного вклада ОС в патогенез практически всех заболеваний современного человека, а также установлены многие молекулярно-клеточные механизмы ОС. «Если энергетический баланс организма ниже среднего, организм не может сопротивляться болезненным агрессиям и безнадежно заболеет. Медицина калечащая должна уступить место медицине, старающейся повысить энергетический баланс», – так пророчески писал еще в 1963 г. в книге «Тайная мудрость человеческого организма» великий русский врач и философ А.С. Залманов.
Сегодня, пожалуй, никому не надо доказывать, что ОС – это универсальный механизм патогенеза всех возраст-ассоциированных заболеваний, при этом выраженность ОС усиливается с возрастом. Самыми первыми патофизиологическими мишенями любого ОС становятся высокоспециализированные и потому наиболее энергопотребляющие клетки организма, к которым относятся в том числе половые клетки (сперматозоиды у мужчин и яйцеклетки у женщин). Вот почему ОС сегодня – неизбежный атрибут бесплодия и его универсальный патогенетический механизм независимо от первопричины нарушения фертильности. ОС априори существует в организме мужчины (физиологический ОС), однако при бесплодии ОС приобретает патологический характер. Патологический ОС существенно ухудшает результаты любой профильной терапии мужского бесплодия, если пациенту одновременно не назначается метаболическая антиоксидантная терапия, способная эффективно нивелировать системные и локальные (тестикулярные) механизмы ОС.
В настоящее время на фармацевтическом рынке России имеется единственный комплекс с доказанным антиоксидантным действием – Спермактин Форте®. Его усиленная формула позволяет осуществлять эффективное фармакологическое сопровождение любых вариантов лечения мужского бесплодия независимо от их причины. Спермактин Форте® как базовый метаболический антиоксидантный компонент комплексной терапии любых форм мужского бесплодия обладает высокой эффективностью и безопасностью и позволяет реализовать главный принцип медицины «лечить больного, а не болезнь». Очевидно, что более широкое применение Спермактина Форте® в рутинной клинической практике позволит действительно осуществить прорыв в консервативной терапии любых форм мужской репродукции, в том числе идиопатического мужского бесплодия, высокая частота которого в России, достигающая 60–70%, не может не вызывать опасения.
S.Yu. Kalinchenko, I.A. Tyuzikov
Clinic of Professor Kalinchenko, Moscow
Peoples’ Friendship University of Russia, Moscow
Contact person: Igor Adamovich Tyuzikov, phoenix-67@list.ru
At present, an impact of male factor into familial infertility reaches up to 50%. However, in most cases the results of conservatively treated male infertility still remain unsatisfactory. Frequently, certain nosologies that might be caused by impaired male fertility are detected and corrected, but general universal mechanisms resulting in infertility are not taken into account. Oxidative stress in spermatozoa represents a direct pathogenetic mechanism of impaired spermatogenesis underlying virtually all types of male infertility. It has various manifestations generally being exhibited in developing mitochondrial dysfunction and sperm DNA fragmentation negatively affecting both macro- and microscopic features of gametes: from motility up to fertilizing capacity seemingly 'healthy' spermatozoa. By now, a great body of evidence database confirming efficacy of using antioxidant drugs in a combination therapy of male infertility has been accumulated in research literature and clinical practice. Antioxidant therapy increases rate of natural frequency of natural as well as IVF conceptions. L-carnitine/acetyl-L-carnitine complex is one of few antioxidants with verified positive effect on oxidative stress in spermatozoa. It allows recommending it as a basic metabolic antioxidant therapy for all types of male infertility regardless of underlying cause and correcting methods.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.