Возможности пробиотической терапии при хронических воспалительных заболеваниях ротоглотки
- Аннотация
- Статья
- Ссылки
- English
В последние годы в результате воздействия неблагоприятных экологических, алиментарных, производственных факторов, снижения местного иммунитета, аллергизации организма, нерационального назначения антимикробных, кортикостероидных и иммуносупрессивных препаратов отмечается устойчивый рост числа пациентов с хронической воспалительной патологией глотки, нередко с рецидивирующим течением [1]. Боль в горле различной интенсивности сопровождает все воспалительные заболевания глотки и является одной из наиболее частых причин самолечения или обращения за медицинской помощью и необоснованного применения антимикробных препаратов [2, 3]. Широкая распространенность данной патологии, рост резистентности микроорганизмов к проводимой терапии, развитие осложнений определяют актуальность проблемы и диктуют необходимость дальнейшего совершенствования методов лечения.
Концепция применения пероральных пробиотиков во врачебной практике является относительно новой [4, 5], ведь микрофлора, постоянно присутствующая в здоровом организме, – один из основных компонентов неспецифической защиты, в основе которой лежит конкурентное взаимодействие между родственными патогенными и непатогенными микроорганизмами. На сегодняшний день пробиотики, представляющие микрофлору кишечника (лакто- и бифидобактерии) и помогающие восстановить функцию желудочно-кишечного тракта, достаточно хорошо изучены и являются одними из основных препаратов в лечении антибиотик-ассоциированной диареи, синдрома раздраженного кишечника и т.д. [6]. В последнее время объектом пристального внимания становятся пробиотики – лантибиотики, обладающие антимикробной активностью, в том числе в отношении резистентных к медикаментам микроорганизмов [7–11]. Лантибиотики – класс пептидных антибиотиков, содержащих тиоэфирную аминокислоту лантионин и синтезируемых грамположительными бактериями (Streptococcus, Streptomyces) против других грамположительных бактерий – S. pyogenes, S. pneumoniae, грамотрицательных бактерий H. influenzaе и M. catarrhalis, а также грибов рода Candida.
S. salivarius – резидентный микроорганизм полости рта и глотки, не имеющий патогенных свойств. Пробиотический штамм S. salivarius K12 (SsK12), первоначально выделенный J.R. Tagg из глотки здорового новозеландского ребенка, продуцирует лантибиотики – саливарицин А2 и саливарицин В, обладающие ингибирующей активностью в отношении основных респираторных патогенов – S. pyogenes, S. pneumoniaе, H. influenzaе, M. сatarrhalis – у детей и взрослых [12–15].
После перорального приема пробиотический штамм SsK12 колонизирует полость рта, глотку и персистирует в течение месяца после приема последней дозы, конкурируя с патогенной микрофлорой [16, 17]. S. salivarius поддерживает микробный баланс полости рта, также препятствуя размножению микроорганизмов, обусловливающих неприятный запах изо рта [18–24]. Штамм SsK12 обладает превосходным профилем чувствительности к антибиотикам и высокими характеристиками обеспечения безопасности, что было продемонстрировано в клинических и экспериментальных исследованиях [4, 25–27].
Применение SsК12 у пациентов с рецидивирующими заболеваниями верхних дыхательных путей существенно снижает степень обсеменения слизистой оболочки ротоглотки патогенными микроорганизмами [25]. Отмечен выраженный профилактический эффект SsК12 у пациентов при рецидивирующей бактериальной инфекции – существенное уменьшение частоты стрептококковых тонзиллофарингитов, острых средних отитов на фоне его длительного применения [7, 8, 17, 26–29].
Основные показания для назначения пробиотического штамма SsК12 в составе препарата Бактоблис: восстановление природной микрофлоры после антибиотикотерапии; ОРВИ – с целью предупреждения бактериальных и вирусных осложнений; острый фарингит, тонзиллит, острый средний отит; хронический рецидивирующий тонзиллит/фарингит; профилактика респираторных инфекций; галитоз. Одна таблетка для рассасывания содержит не менее 1 × 109 колониеобразующих единиц SsК12.
SsК12 продуцирует бактериоциноподобную ингибиторную субстанцию BLIS K12 (ВacteriocinLike Inhibitory Substance), которая играет важную роль в сохранении естественной микрофлоры верхних дыхательных путей, предупреждении роста респираторных патогенов и развитии бактериальных осложнений; запатентован в 42 странах мира, включая США, страны Евросоюза. SsK12 имеет международно признанный профиль безопасности GRAS (Generally Recognized As Safe) Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США (Food and Drug Administration, FDA), разрешающий его применение у детей с раннего возраста. В России пробиотик, содержащий штамм SsК12, известен под названием Бактоблис.
Цель исследования – оценка эффективности и безопасности, а также возможных побочных эффектов препарата Бактоблис, содержащего пробиотический штамм SsK12, при лечении хронических воспалительных заболеваний ротоглотки.
Материал и методы
В наблюдательное исследование были включены 30 пациентов (18 женщин и 12 мужчин) в возрасте 18–65 лет с диагнозом «хронический фарингит», которым был назначен пробиотик Бактоблис в течение 21 дня по одной таблетке в сутки перед сном до полного растворения таблетки, желательно в вечернее время перед сном, после чистки зубов. Прием препарата в вечерние часы, когда выделение слюны уменьшается, повышает эффективность колонизации SsK12 полости рта и глотки. Полоскание горла раствором мирамистина (0,01%) за 30 минут перед первым приемом таблетки также способствует колонизации SsK12 путем создания очищенных от бактерий ниш в тканях полости рта и ротоглотки.
Для выявления жалоб, сбора анамнестических данных проводили опрос, ЛОР-осмотр и клинико-лабораторное исследование пациентов: общий анализ крови, мочи, микробиологическое исследование мазка со слизистой оболочки ротоглотки, экспресс-тест на наличие β-гемолитического стрептококка группы А (БГСА). Для диагностики стрептококковой инфекции, выявления антигенов БГСА в мазках из ротоглотки использовали иммунохроматографический экспресс-тест – cтрептатест.
Критерии включения в исследование: наличие клинической картины (боль при глотании, неприятные ощущения першения, саднения, сухости, инородного тела в горле, скопление вязкой слизи на задней стенке глотки, неприятный запах изо рта) и фарингоскопических данных (воспалительные изменения – гиперемия, отечность слизистой оболочки ротоглотки).
Критерии исключения из исследования: стрептококковая инфекция глотки, подтвержденная результатом стрептатеста; острые воспалительные процессы или обострения хронических заболеваний; новообразования глотки и гортани; иммунодефицитные состояния; тяжелые коморбидные заболевания, беременность.
Оценку клинической эффективности пробиотической терапии проводили еженедельно по динамике выраженности клинических признаков, интенсивности субъективной симптоматики и объективной оценке воспалительных изменений слизистой оболочки ротоглотки.
Субъективную оценку пациентом степени выраженности локальных симптомов – болевых, неприятных ощущений в горле и своего самочувствия – проводили с использованием 10-балльной визуальной аналоговой шкалы (ВАШ). Воспалительные изменения слизистой оболочки ротоглотки при фарингоскопии оценивали по четырехбалльной шкале: отсутствует – 0, слабо выражен – 1, умеренно выражен – 2, сильно выражен – 3. Результаты обследования и лечения регистрировали в специально разработанной индивидуальной карте. Бактериологическую эффективность препарата оценивали на основании результатов микробиологического исследования.
Результаты исследования
В результате проведенной терапии исчезли значительно ухудшавшие качество жизни симптомы, которые беспокоили больных в течение длительного времени и на момент осмотра. Ухудшения общего состояния и повышения температуры тела не наблюдалось. Патологические изменения показателей общего анализа крови и мочи не выявлены.
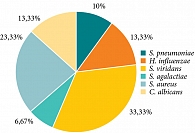
При первичном микробиологическом исследовании у 30 пациентов выявлен рост бактериальной и грибковой флоры в количестве 103–106 КОЭ/мл: S. pneumoniae – 3 (10%) пациента, H. influenzaе – 4 (13,33%), S. viridans – 10 (33,33%), S. agalactiae – 2 (6,67%), S. aureus – 7 (23,33%), C. albicans – 4 (13,33%) пациента (рис. 1).
При повторном микробиологическом исследовании отрицательный результат получен у 22 (73,33%) пациентов; персистирование бактериальной флоры (S. viridans, S. aureus) – у 6 (20%), грибковой флоры (C. albicans) – у 2 (6,67%) пациентов.
Выявление дрожжеподобных грибов C. albicans у четырех пациентов может быть связано с часто назначаемой антибактериальной терапией у данной категории пациентов. Пероральное применение пробиотика SsK12 приводит к уменьшению колонизации дрожжеподобных грибов рода Candida (C. albicans, C. tropicalis, C. parapsilosis) на слизистой оболочке полости рта и глотки, что обусловлено блокированием SsK12 адгезии Candida к эпителию слизистой оболочки [30].
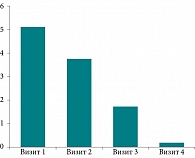
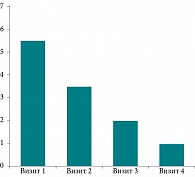
Результаты субъективной оценки симптомов по ВАШ на первом визите: выраженность боли при глотании – 5,47 ± 1,91 балла, дискомфорт в горле – 6,2 ± 1,51 балла (рис. 2, 3).
Среднее значение ВАШ более 5,0 баллов указывает на значительное снижение качества жизни пациентов. В результате приема препарата отмечен положительный клинический эффект – регресс исследуемых признаков заболевания (боли, дискомфорта в горле, воспалительных изменений ротоглотки) у всех пациентов на 7-й, 14-й и 21-й день наблюдения.
На втором, третьем визите отмечено значительное улучшение самочувствия пациентов. Выраженность боли при глотании уменьшилась с 5,47 ± 1,91 до 3,93 ± 1,26 и 2,03 ± 1,45 балла на 7-й и 14-й день наблюдения соответственно. При фарингоскопии наблюдалось уменьшение воспалительных изменений – гиперемии, отечности слизистой оболочки ротоглотки. После трех недель лечения выраженность болевого синдрома составила всего 0,37 ± 0,43 балла.
Степень дискомфорта в горле – чувства першения, саднения, сухости, инородного тела – уменьшилась с 6,2 ± 1,51 до 3,87 ± 1,40 балла на 7-й день и до 2,17 ± 1,21 балла на 14-й день наблюдения. На 21-й день степень слабовыраженного дискомфорта составила 1,13 ± 1,09 балла.
Ни в одном случае каких-либо побочных эффектов, аллергических и других нежелательных реакций на Бактоблис во время и после лечения у пациентов не зафиксировано.
Заключение
Пробиотический штамм SsK12 (Бактоблис) снижает степень колонизации слизистой оболочки ротоглотки патогенными микроорганизмами при хронических воспалительных заболеваниях ротоглотки, способствует клинически значимому регрессу основных признаков патологического процесса – боли, неприятных ощущений в горле. Препарат отличается хорошей переносимостью, безопасностью, отсутствием какого-либо токсического действия, подтверждает антимикробную активность пробиотиков в отношении патогенной и условно патогенной микрофлоры.
Применение SsK12 (Бактоблис) в амбулаторно-поликлинической практике способствует восстановлению нарушенного микробиоценоза глотки, в том числе после антибактериальной, антимикотической терапии.
Использование респираторных пробиотиков, подавляющих рост патогенной микрофлоры, с целью профилактики частых обострений воспалительных заболеваний и/или вторичной инфекции верхних дыхательных путей, а также в качестве возможной альтернативы антибиотикам представляется перспективным направлением, требующим дополнительных, плацебо-контролируемых исследований.
A.Yu. Ovchinnikov, PhD, Prof., N.A. Miroshnichenko, PhD, Prof., S.S. Egiyan, PhD, L.V. Akopyan, PhD
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
Contact person: Andrey Yu. Ovchinnikov, lorent1@mail.ru
The wide prevalence of chronic inflammatory pathology of the oropharynx, the growth of antimicrobial resistance to therapy, development of complications determine the relevance of this problem and dictate the need for further improvement of treatment methods. The article presents the clinical experience of using Bactoblis – drug containing probiotic strain S. salivarius K12 in patients with this pathology. Respiratory probiotic Streptococcus salivarius K12 is able to colonize the pharyngeal mucosa and inhibit the growth of the main respiratory pathogens – S. pyogenes, S. pneumoniae, H. influenzae, M. catarrhalis – in children and adults. The results of the carried out observational study, assessment of the subjective and objective condition of patients indicate the clinical efficacy, safety of use and good tolerability of the drug.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.