Эффективность пробиотической терапии при хроническом тонзиллите
- Аннотация
- Статья
- Ссылки
- English
Применение SsК12 в межрецидивном периоде у больных ХТ способствует уменьшению патогенной микробной обсемененности небных миндалин, коррекции дисбиотических состояний, улучшению клинического течения заболевания, сопровождается достижением длительной ремиссии в 32,5% случаев, что позволяет сократить количество планируемых оперативных вмешательств и избежать связанных с ними осложнений.
Применение SsК12 в межрецидивном периоде у больных ХТ способствует уменьшению патогенной микробной обсемененности небных миндалин, коррекции дисбиотических состояний, улучшению клинического течения заболевания, сопровождается достижением длительной ремиссии в 32,5% случаев, что позволяет сократить количество планируемых оперативных вмешательств и избежать связанных с ними осложнений.


Неуклонный рост заболеваемости хроническим тонзиллитом (ХТ), частоты обострений, локальных и генерализованных осложнений определяет актуальность и значимость проблемы, необходимость постоянного совершенствования методов диагностики и лечения данного заболевания [1, 2]. Согласно современным данным, хронической тонзиллярной патологией страдают 5–37% взрослого и 15–63% детского населения [3–5].
Персистенция патогенной микрофлоры в лимфоэпителиальных структурах при ХТ приводит к снижению их иммунорегуляторной и барьерной функций, нарушениям в клеточном, гуморальном механизмах иммунной защиты, мукозальном иммунитете (лат. mucosa – слизистая оболочка) – иммунитете барьерных тканей, в котором большое значение имеет колонизация ротоглотки представителями непатогенной микрофлоры, препятствующая адгезии и размножению патогенных микроорганизмов [6, 7].
Среди бактериальной флоры, вегетирующей в небных миндалинах больных ХТ, встречаются разнообразные по свойствам возбудители: стрептококки, стафилококки, пневмококки, гемофильная палочка, бактериально-грибковые ассоциации с представителями рода Candida, реже анаэробы (Bacteroides, Fusobacterium), внутриклеточные и мембранные паразиты [8, 9].
Бета-гемолитический стрептококк группы А (БГСА) рассматривается в качестве ведущего этиологического фактора, инициатора инфекционно-воспалительного процесса в небных миндалинах, токсико-аллергических реакций у 30–60% больных [10], 10–15% взрослых и 30% детей [8, 11].
К факторам, снижающим эффективность антибактериальной терапии, обусловливающим хронический и рецидивирующий характер течения заболевания, относят внутриклеточную персистенцию кокковой флоры в лимфоидной ткани глотки, а также способность колонизирующих небные миндалины патогенов к существованию в составе структурно организованных сообществ – биопленок, устойчивых к антимикробным агентам, физическим и химическим факторам внешней среды [12–14].
Видовой состав микробного пейзажа небных миндалин, частота выделения БГСА зависят от формы ХТ, степени выраженности токсико-аллергических реакций, ранее проведенной антибактериальной терапии, техники отбора проб биологического материала, состава питательной среды [15–18]. Особенностью токсико-аллергической формы (ТАФ) I ХТ является преобладание в видовом составе стафилококковой флоры над стрептококковой. Высеваемость Staphylococcus aureus от больных ТАФ I ХТ составляет 24,3 против 5,8% при ТАФ II, Streptococcus pyogenes – 16,7 и 39,7% соответственно [15].
Вызванный БГСА-инфекцией ХТ имеет наиболее неблагоприятное течение, может сопровождаться частыми рецидивами, осложнениями местного и общего характера, токсико-аллергическими реакциями, свойственными ТАФ [4, 9, 10, 15, 19].
Облигатная микрофлора, постоянно обитающая в орофарингеальной зоне, является одним из основных компонентов неспецифической защиты организма от респираторной инфекции, формирующейся у человека при рождении, в основе чего лежит конкурентное взаимодействие между родственными патогенными и непатогенными микроорганизмами.
Представителем резидентной микрофлоры полости рта и глотки, не имеющим патогенных свойств, является Streptococcus salivarius, пробиотический штамм которого SsK12 продуцирует лантибиотики (саливарицин А2 и саливарицин В) – лантионин-содержащие бактериальные низкомолекулярные пептиды, обладающие ингибирующей активностью в отношении респираторных антибиотикорезистентных патогенов – S. pyogenes, S. pneumoniaе, Haemophilus influenzae, Moraxella catarrhalis [20–27]. Антимикробный потенциал лантибиотиков, подавление зон роста стафилококков, стрептококков, протея, грибов рода Candida могут сохраняться в течение месяцев [28].
Бактериоцин-подобная ингибирующая субстанция SsК12 – BLIS (bacteriocin-like inhibitory substance) играет важную роль в сохранении естественной микрофлоры дыхательных путей, предупреждении и коррекции дисбиотических состояний. После приема штамм SsK12 колонизирует орофарингеальную зону и препятствует адгезии к эпителию слизистой оболочки и размножению патогенных [26, 29], а также обусловливающих галитоз микроорганизмов [30–34].
Термин «пробиотик», введенный D.M. Lilly и R.H. Stillwell в 1965 г. [35] как потенциальная альтернатива антибиотикам (греч. ἀντί – против, βίος – жизнь), означает буквально «в защиту жизни» (лат. pro – в пользу, в защиту, за). В наименовании пробиотика SsK12 отражены род, вид и буквенно-цифровое обозначение специфического штамма. SsK12 имеет международно признанный профиль безопасности GRAS (generally recognized as safe), разрешающий его применение у детей с раннего возраста. Зарегистрирован в России под названием БактоБЛИС (свидетельство о государственной регистрации № АМ.01.06.01.003.Е.000024.07.18 от 20.07.2018). Одна таблетка для рассасывания содержит 1 × 109 колониеобразующих единиц (КОЕ) SsК12.
У пациентов с рецидивирующими заболеваниями верхних дыхательных путей SsК12 существенно снижает степень колонизации орофарингеальной области респираторными патогенами [27, 36], оказывает профилактический и лечебный эффект при бактериальном тонзиллофарингите, остром среднем отите [37–42]. Основные показания для назначения штамма SsК12 в составе БактоБЛИСа: восстановление естественного баланса микрофлоры после антибиотикотерапии, предупреждение бактериальных и вирусных осложнений при острых респираторных вирусных инфекциях, острый и хронический фарингит/тонзиллит, острый средний отит, профилактика респираторных инфекций, галитоз.
Имеющиеся в современном арсенале врачей различные антибактериальные, нестероидные противовоспалительные, антисептические средства, назначаемые при воспалительной патологии глотки, наряду с купированием симптомов заболевания способствуют дисбалансу микробиоценоза ротоглотки, увеличению представительства условно-патогенной микрофлоры, снижению уровня местной иммунной защиты. В этой связи определенный научно-практический интерес вызывает микробиоценоз-регулирующая пробиотическая терапия хронической воспалительной патологии ротоглотки.
Цель – оценить клиническую эффективность и переносимость пробиотической терапии у больных ТАФ I ХТ.
Материал и методы
Проведено проспективное наблюдательное исследование пробиотического средства БактоБЛИС, включавшее четыре ежемесячных визита пациентов: в 1-й день (1-й визит), 31-й (2-й визит), 61-й (3-й визит), 91-й день (4-й визит, заключительный).
Обследованы 40 пациентов (24 женщины и 16 мужчин) в возрасте 18–49 лет (средний возраст – 32,4 ± 8,9 года) с давностью заболевания свыше трех лет, которым из-за отсутствия эффекта от консервативного лечения (повторных курсов системной антибиотикотерапии, промываний лакун миндалин), вновь возникающих рецидивов ангин планировалось выполнение двусторонней тонзиллэктомии (ТЭ).
Схема лечения. На 1-м визите включенным в исследование пациентам проводили предкурсовое промывание лакун миндалин 100 мл стерильного физраствора, что вместе с полосканием горла раствором антисептика за полчаса перед первым приемом препарата повышает эффективность орофарингеальной колонизации SsK12 путем создания очищенных от бактерий ниш в полости рта и глотке. Назначали ежедневный прием БактоБЛИСа (пробиотического штамма SsK12) по одной медленно растворимой во рту таблетке 1000 мг вечером перед сном в течение 90 дней.
Критерии отбора пациентов: давность заболевания не менее трех лет, частые обострения в виде ангин (до двух-трех раз в год), болевые и неприятные ощущения в горле, образование казеозно-гнойных пробок в миндалинах, «глоточный» кашель, неприятный запах изо рта, умеренно выраженные общие токсико-аллергические проявления ХТ (эпизоды субфебрильной температуры тела, немотивированная общая слабость, недомогание, повышенная утомляемость, снижение работоспособности), наличие местных признаков ХТ (двух и более) (казеозного детрита/жидкого гноя в лакунах миндалин, отечности верхних отделов небных дужек (признак Зака), гиперемии краев передних небных дужек (признак Гизе), валикообразного утолщения краев небных дужек (признак Преображенского), сращений и спаек между миндалинами и небными дужками, регионарного лимфаденита).
Критерии исключения: обострение ХТ в предшествующие три недели и во время исследования, общие и местные сопряженные с ХТ заболевания (в том числе нефрологические, ревматологические, суставной синдром, паратонзиллярный абсцесс), острые воспалительные процессы/обострения хронических заболеваний (в частности, лор-органов и зубочелюстной системы), постоянный субфебрилитет, устойчивые изменения на электрокардиограмме (ЭКГ), лабораторных показателей, белковых маркеров воспаления, высокие значения стрептококковых антител – АСЛ-О (> 200 МЕ/мл), новообразования верхних дыхательных путей, иммунодефицитные состояния, тяжелая коморбидная патология, сахарный диабет, аллергопатология, беременность, грудное вскармливание.
Для уточнения клинической формы и течения заболевания, оценки эффективности лечения проводились опрос – выявление жалоб больных, сбор анамнестических данных (предыдущее лечение и его эффективность), лор-осмотр, клинико-лабораторное исследование, включавшее определение ревматоидных показателей (С-реактивный белок, ревматоидный фактор, АСЛ-О), микробиологическое исследование микрофлоры миндалин, ЭКГ, при наличии показаний эхокардиография, рентгенография легких, консультации ревматолога, кардиолога, нефролога и других профильных специалистов.
Микробиологическое исследование содержимого лакун миндалин. Отбор проб из лакун небных миндалин осуществлялся стерильным тампоном диаметром 2–3 мм. Образцы биологического материала доставлялись в лабораторию в течение двух часов и подвергались высеванию на плотные питательные среды с последующей инкубацией, выделением чистой культуры и идентификацией возбудителей.
Эффективность пробиотической терапии оценивалась по результатам микробиологического исследования, динамике исходных субъективных и объективных симптомов, наличию или отсутствию нежелательных явлений, осложнений, рецидивов ангин.
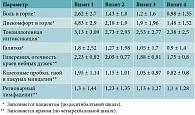
Оценка выраженности симптомов больным и врачом. Количественная оценка выраженности субъективных симптомов (локальных и общих) проводилась с использованием десятибалльной визуальной аналоговой шкалы (ВАШ), объективных симптомов (местных признаков ХТ) – по четырехбалльной шкале (0 – признак отсутствует, 1 – слабо выражен, 2 – умеренно выражен, 3 – значительно выражен) (табл. 1).
Данные субъективного и объективного исследования, результаты лечения регистрировались в специально разработанных индивидуальных картах.
Результаты
Пациенты на момент 1-го осмотра предъявляли жалобы на частую ангину (до двух-трех раз в год), боль в горле непостоянного характера (n = 21), неприятные ощущения першения, саднения, инородного тела/кома в горле (n = 32), образование казеозных/гнойных пробок в миндалинах (n = 24), кашель (n = 8), неприятный запах изо рта (n = 14); периодический субфебрилитет, общую слабость (не имеющую другой обоснованной причины), повышенную утомляемость, снижение работоспособности (n = 21).
На фоне пробиотической терапии у пациентов зафиксирован положительный клинический эффект – улучшение общего состояния, самочувствия, работоспособности, регресс клинической симптоматики (боли, дискомфорта в горле, воспалительных изменений в ротоглотке) уже в течение первого месяца.
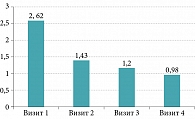
Результаты субъективной оценки болевых ощущений в горле по ВАШ продемонстрировали положительную динамику снижения ее интенсивности: на 1-м визите – 2,62 ± 2,7 балла, на 2–4-м визитах – 1,43 ± 1,8, 1,2 ± 1,6 и 0,98 ± 1,35 балла соответственно (рис. 1, табл. 2).
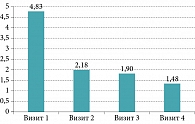
На фоне лечения БактоБЛИСом зарегистрирован регресс выраженности дискомфорта – неприятных ощущений першения, саднения, инородного тела в горле – 4,83 ± 2,9 балла на 1-м визите, 2,18 ± 1,9 – на 2-м, 1,9 ± 1,96 – на 3-м и 1,48 ± 1,52 балла – на 4-м визите (рис. 2), тонзиллогенной интоксикации: с 3,13 ± 3,09 балла в 1-й день до 2,38 ± 2,5 балла на 91-й день наблюдения (табл. 2).
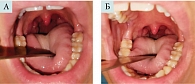
По завершении полного курса терапии отмечалось уменьшение степени выраженности типичных симптомов ХТ: интенсивности гиперемии, отечности, инфильтрации краев небных дужек, очищению лакун миндалин от казеозно-гнойного содержимого (отхождению пробок, по словам пациентов) (рис. 3 и 4, табл. 2).
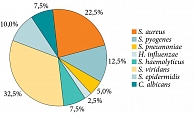
По данным первичного микробиологического исследования содержимого лакун небных миндалин, проведенного у 40 пациентов до начала лечения, в 67,5% случаев обнаружен рост патогенной, условно-патогенной, резидентной микрофлоры в количестве более 102 КОЕ/мл, S. aureus (9 (22,5%)), S. pyogenes (5 (12,5%)), S. pneumoniae (2 (5%)), H. influenzaе (1 (2,5%)), S. haemolyticus (3 (7,5%)), S. viridans (13 (32,5%)), S. epidermidis (4 (10,0%)), Candida albicans (3 (7,5%)) (рис. 5). В 12,5% случаев в исследуемом материале выявлены микробные ассоциации: C. albicans – S. viridans (2 (5,0%)), S. aureus – S. viridians (3 (7,5%)).
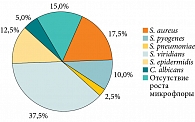
На фоне проведенной пробиотической терапии отмечались положительные изменения состава микробиоценоза небных миндалин – уменьшение их патогенной микробной обсемененности и повышение численности, активности непатогенной облигатной орофарингеальной флоры. При контрольном микробиологическом исследовании, выполненном по окончании курса, выявлены S. aureus (7 (17,5%)), S. pyogenes (4 (10,0%)), S. pneumoniae (1 (2,5%)), S. viridians, в том числе S. salivarius, S. mitis, S. sanguis (15 (37,5%)), S. epidermidis (5 (12,5%)), C. albicans (2 (5,0%)), отсутствие роста микрофлоры (6 (15,0%)) (рис. 6).
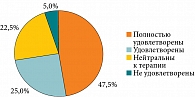
Ухудшения общего состояния, аллергических, системных и местных побочных реакций во время наблюдения не зарегистрировано. При лабораторном исследовании клинически значимые изменения не выявлены. Пациенты отмечали удобную схему приема и форму выпуска пробиотического средства БактоБЛИС, не красящего язык и не оставляющего налетов, свежее дыхание по утрам, улучшение состояния горла. Полностью удовлетворены результатами лечения 19 (47,5%) пациентов, удовлетворены – 10 (25,0%), нейтральны к терапии – 9 (22,5%), не удовлетворены – 2 (5,0%), крайне не удовлетворены – 0 (0%) (рис. 7).
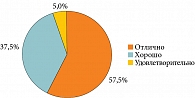
Отличную переносимость БактоБЛИСа отметили 23 (57,5%) пациента, хорошую – 15 (37,5%), удовлетворительную – 2 (5%) (рис. 8).
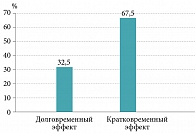
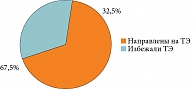
Ежедневный регулярный прием SsK12 на протяжении трех месяцев позволил защитить обследуемых больных (n = 40) от обострений ХТ. Однако у 27 (67,5%) пациентов эффект от проведенной терапии был кратковременным: примерно через месяц после окончания курса вновь возникли рецидивы ангин, вернулось первоначальное состояние, в лакунах миндалин появился гной. Вероятно, это было связано с персистенцией SsK12 в течение месяца после приема последней дозы [26, 29, 38] (рис. 9).
Больные, резистентные к терапии, направлены на ТЭ. Стойкий клинический эффект в течение шести месяцев катамнестического периода (отсутствие рецидивов ангин и других признаков декомпенсации) достигнут у 13 (32,5%) пациентов с ХТ, подлежащих динамическому наблюдению (рис. 10).
Заключение
Высокая хирургическая активность при ХТ (около 600 тыс. ТЭ в год в мире) неизбежно сопряжена с высоким риском развития крайне нежелательных интра- и послеоперационных осложнений: геморрагических (первичных и вторичных, ранних и поздних кровотечений у 1,5–13% оперированных) [43–46], сердечно-сосудистых, легочных (2,3%), тромбоэмболических, нефрологических и урологических, послеоперационных проявлений тошноты и рвоты, дегидратации, затрудненного приема пищи, боли в горле [47–50]. Кроме того, негативная психоэмоциональная окраска осложнений формирует у больных отрицательное отношение к качеству оказания медицинской помощи.
Представленные факторы подчеркивают необходимость ранней и точной диагностики клинической формы заболевания, дифференцированного подхода к каждому больному, обоснования показаний и взвешивания всех за и против при направлении пациентов на хирургическое или органосохраняющее консервативное лечение.
Пробиотическая терапия SsK12 при хронической тонзиллярной патологии способствует активации мукозальной защиты, снижению степени патогенной микробной обсемененности небных миндалин, коррекции дисбиотических состояний, улучшению клинического течения заболевания.
Трехмесячное применение SsК12 ассоциируется с профилактическим и терапевтическим эффектом у пациентов с ТАФ I ХТ. Препарат обладает высоким профилем безопасности, что делает возможным его применение не только у взрослых, но и у детей, беременных и кормящих женщин. SsK12 отличается хорошей переносимостью при длительном использовании, отсутствием побочных эффектов, какого-либо токсического, местно-раздражающего действия и подтвержденной антимикробной активностью в отношении патогенной микрофлоры, низким риском развития микробной полирезистентности.
Применение SsК12 в межрецидивном периоде сопровождается достижением длительной ремиссии воспалительного процесса (32,5% случаев), что позволяет сократить количество планируемых оперативных вмешательств и избежать связанных с ними осложнений, психоэмоционального напряжения у пациентов.
Включение пробиотиков в практику предоперационной подготовки больных ХТ ТАФ I, направленных на плановое хирургическое лечение, может способствовать улучшению клинической картины, снижению риска развития рецидивов, токсико-аллергических проявлений, увеличению продолжительности ремиссии.
Возможно применение пробиотической терапии в ситуациях вынужденного консервативного ведения больных ХТ, имеющих противопоказания к операции, категорически отказывающихся от операции, а также в случаях, когда оперативное вмешательство невозможно (особые условия пребывания военнослужащих, экспедиции и т.д.).
Авторы заявляют об отсутствии конфликта интересов.
A.Yu. Ovchinnikov, PhD, Prof., S.S. Yegiyan, PhD, L.V. Akopyan, PhD
Russian University of Medicine
Contact person: Andrey Yu. Ovchinnikov, lorent1@mail.ru
The article presents the clinical experience of using the probiotic Bactoblis containing Streptococcus salivarius strain K12 (SsK12) in patients with chronic tonsillar pathology. The respiratory probiotic SsK12 is characterized by the ability to colonize the mucous membrane and lymphoid formations of the pharynx, inhibiting the growth of respiratory pathogens resistant to antibacterial therapy. Based on the study a conclusion was made about the preventive and therapeutic effect of SsK12 amid a 3-month course of probiotic therapy in patients with frequent exacerbations of chronic tonsillitis. SsК12 is characterized by a high safety profile, good tolerability, absence of side effects, toxic, locally irritating effects with prolonged use and confirmed antimicrobial activity against pathogenic and conditionally pathogenic flora and a low risk of microbial polyresistance.
The use of SsK12 in the inter-recurrence period in patients with chronic tonsillitis contributed to the reduction of pathogenic microbial contamination of the palatine tonsils, correction of dysbiotic conditions, improvement of the clinical course of the disease; it was accompanied by the achievement of long-term remission in 32.5% of cases, which allowed to reduce the number of planned surgical interventions and avoid associated complications.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.