Взаимосвязь генетических вариантов генов TYK2 (rs2304255) и DDX58 (rs34085293) с особенностями течения псориаза и ответом на лечение ингибитором интерлейкина 17A
- Аннотация
- Статья
- Ссылки
- English
Цель исследования – проанализировать наличие полиморфизма генов TYK2 (rs2304255) и DDX58 (rs34085293) у больных псориазом и оценить взаимосвязь данных однонуклеотидных полиморфизмов с терапевтической эффективностью ингибитора ИЛ-17А нетакимаба.
Материал и методы. В исследование включены 70 пациентов (45 мужчин и 25 женщин; медиана возраста – 45 лет) со среднетяжелыми и тяжелыми формами псориаза обыкновенного (n = 60) и пустулезным псориазом (n = 10), которым проводили лечение ингибитором ИЛ-17A нетакимабом с определением клинических индексов на 0, 6, 24, 48, 72-й неделях терапии. Методом полимеразной цепной реакции определяли аллельные варианты генов TYK2 (rs2304255) и DDX58 (rs34085293). Проводили статистическую обработку данных для определения влияния выявленных генотипов на особенности течения псориаза и эффективность нетакимаба.
Результаты. Общая частота встречаемости аллеля TYK2 (rs2304255 C > T) составила 18,33%, 15% пациентов с псориазом обыкновенным были гетерозиготны по DDX58 (rs34085293 T > G). Частота встречаемости аллеля DDX58 (rs34085293 G/G) составила 1%. По основным показателям тяжести и активности псориаза (Psoriasis Areaand Severity Index, PASI, и Physician Global Assessment, PGA) значимого влияния на тяжесть течения псориаза наличие или отсутствие полиморфизма в изучаемых генах не выявлено.
Обнаружено статистически значимое различие в частоте встречаемости полиморфизма TYK2 (rs2304255) у пациентов мужского пола (р = 0,03); наличие полиморфизма DDX58 (rs34085293) статистически значимых отклонений в мужской выборке не продемонстрировало (p > 0,05). У гетерозиготных лиц по аллелям TYK2 (rs2304255 C > T) провоцирующим фактором в развитии псориаза являлась гиперраздражимость ткани вследствие травмы, у группы с полиморфизмом аллели DDX58 (rs34085293 T > G) показателем повышенного риска может считаться инфекционный процесс. При оценке динамики PASI и PGA в группах пациентов с полиморфизмом TYK2 (rs2304255) получены различия в группах с гомозиготой (С/С ) и гетерозиготой (C > T), демонстрирующие высокую эффективность терапии нетакимабом (PASI 100) и удержание эффекта не менее PASI 90 до 72-й недели терапии у пациентов с гетерозиготным генотипом TYK2 (rs2304255 C > T) (p < 0,001). Сравнение эффективности нетакимаба по индексу PASI в группах с гомозиготным генотипом DDX58 (rs34085293 T/T) и гетерозиготным генотипом DDX58 (rs34085293 T > G) продемонстрировало значимые различия на 6, 24, 48-й неделях; в группе гетерозиготных пациентов эффект от терапии нетакимабом был выше(p < 0,05).
Заключение. Полученные данные фармакогенетического исследования, обусловливающие эффективность терапии псориаза, позволят усовершенствовать предиктивную диагностику для определения прогнозируемого эффекта терапии псориаза, что в перспективе ляжет в основу точной интерпретации индивидуального профиля пациента и его генетических предикторов для определения персонифицированного подхода в лечении.
Цель исследования – проанализировать наличие полиморфизма генов TYK2 (rs2304255) и DDX58 (rs34085293) у больных псориазом и оценить взаимосвязь данных однонуклеотидных полиморфизмов с терапевтической эффективностью ингибитора ИЛ-17А нетакимаба.
Материал и методы. В исследование включены 70 пациентов (45 мужчин и 25 женщин; медиана возраста – 45 лет) со среднетяжелыми и тяжелыми формами псориаза обыкновенного (n = 60) и пустулезным псориазом (n = 10), которым проводили лечение ингибитором ИЛ-17A нетакимабом с определением клинических индексов на 0, 6, 24, 48, 72-й неделях терапии. Методом полимеразной цепной реакции определяли аллельные варианты генов TYK2 (rs2304255) и DDX58 (rs34085293). Проводили статистическую обработку данных для определения влияния выявленных генотипов на особенности течения псориаза и эффективность нетакимаба.
Результаты. Общая частота встречаемости аллеля TYK2 (rs2304255 C > T) составила 18,33%, 15% пациентов с псориазом обыкновенным были гетерозиготны по DDX58 (rs34085293 T > G). Частота встречаемости аллеля DDX58 (rs34085293 G/G) составила 1%. По основным показателям тяжести и активности псориаза (Psoriasis Areaand Severity Index, PASI, и Physician Global Assessment, PGA) значимого влияния на тяжесть течения псориаза наличие или отсутствие полиморфизма в изучаемых генах не выявлено.
Обнаружено статистически значимое различие в частоте встречаемости полиморфизма TYK2 (rs2304255) у пациентов мужского пола (р = 0,03); наличие полиморфизма DDX58 (rs34085293) статистически значимых отклонений в мужской выборке не продемонстрировало (p > 0,05). У гетерозиготных лиц по аллелям TYK2 (rs2304255 C > T) провоцирующим фактором в развитии псориаза являлась гиперраздражимость ткани вследствие травмы, у группы с полиморфизмом аллели DDX58 (rs34085293 T > G) показателем повышенного риска может считаться инфекционный процесс. При оценке динамики PASI и PGA в группах пациентов с полиморфизмом TYK2 (rs2304255) получены различия в группах с гомозиготой (С/С ) и гетерозиготой (C > T), демонстрирующие высокую эффективность терапии нетакимабом (PASI 100) и удержание эффекта не менее PASI 90 до 72-й недели терапии у пациентов с гетерозиготным генотипом TYK2 (rs2304255 C > T) (p < 0,001). Сравнение эффективности нетакимаба по индексу PASI в группах с гомозиготным генотипом DDX58 (rs34085293 T/T) и гетерозиготным генотипом DDX58 (rs34085293 T > G) продемонстрировало значимые различия на 6, 24, 48-й неделях; в группе гетерозиготных пациентов эффект от терапии нетакимабом был выше(p < 0,05).
Заключение. Полученные данные фармакогенетического исследования, обусловливающие эффективность терапии псориаза, позволят усовершенствовать предиктивную диагностику для определения прогнозируемого эффекта терапии псориаза, что в перспективе ляжет в основу точной интерпретации индивидуального профиля пациента и его генетических предикторов для определения персонифицированного подхода в лечении.






Введение
Генетическая основа развития псориаза давно признана, и благодаря полногеномным ассоциативным исследованиям и определению связей было выявлено более 60 генных областей, предрасполагающих к псориазу. Основные генетические детерминанты псориаза состоят в локусе чувствительности к псориазу PSORS1, отображенном на хромосоме 6p21. Этот регион охватывает области MHC класса I и содержит девять генов, включая HLA-C, HLA-B, TNFA, LTA и MICB, а также небелковые кодирующие гены [1–7]. Однонуклеотидные полиморфизмы(SNP) риска псориаза были выявлены в дополнительных локусах PSORS1, в генах, участвующих в ответах Th17/Th1, врожденном иммунитете и воспалительных путях, а также в функциях кожного барьера и презентации антигена. В развитие псориаза вовлечены гены: ответственные за врожденный иммунитет (IFIH1, TRAF3IP2, CARD14, c-REL, DDX58); презентацию антигена (HLA-Cw6); развитие, созревание Т-клеток (RUNX1, RUNX3, STAT3); синтез ключевых цитокинов (IL12Bp40, IL23Ap19, IL23R, JAK2, TYK2) и иммунные регуляторы (TNIP1, TNFAIP3, IL36RN, SOCS1, ZC3H12C, NFKBIA) [8–10]. Изучение генома человека необходимо с целью выявления различных генетических вариантов (однонуклеотидных полиморфизмов, вариаций числа копий генов, малых вставок или делеций), которые предрасполагают к развитию заболевания, связаны с ответом на выбранный метод лечения и развитием нежелательных лекарственных реакций [11].
В последнее десятилетие несколько фармакогенетических исследований позволили идентифицировать полиморфизмы, потенциально предсказывающие клиническую реакцию пациентов на терапию ингибитором фактора некроза опухоли альфа адалимумабом и ингибитором ИЛ-12/ИЛ-23 устекинумабом [12–16]. Фармакогенетические исследования блокаторов ИЛ-17 редки и неоднозначны. Секукинумаб показал хорошую эффективность независимо от аллеля HLA-Cw6 (C*06:02) гена HLA-C (Human Leukocyte Antigen C) в исследовании фазы IIIb SUPREME [17, 18], в то время как в реальной практике он был показан как более эффективный в HLA-Cw6 (C*06:02)-положительном, чем у пациентов с отрицательным результатом [19]. В исследованиях определили два SNP в генах TYK2 (rs2304255) и DDX58 (rs34085293) в подгруппе пациентов с максимальной эффективностью (суперответом), достигающих и поддерживающих PASI 100 до 88-й и 100-й недель терапии секукинумабом.
Продукты генов TYK2 и DDX58 изначально были описаны как медиаторы противовирусных и врожденных иммунных реакций. В то время как фермент, кодируемый геном TYK2, является тирозинкиназой, принадлежащей к белковому семейству янус-киназ, которая ассоциируется с цитокиновыми рецепторами типа I и типа II, включая рецепторы ИФН, DDX58 является белком, участвующим в распознавании вирусной двухцепочечной РНК и производстве ИФН. Хотя обе молекулы обладают противовирусной активностью, недавние данные показывают участие продуктов экспрессии генов TYK2 и DDX58 в оси ИЛ-23/ИЛ-17 путем индукции ИЛ-23 и регулирования ИЛ-23-опосредованных путей [20, 21]. В то время как однонуклеотидный полиморфизм DDX58 (rs34085293 T > G) отображается в интергенной области гена DDX58 и влияние его присутствия непредсказуемо, то точечная мутация TYK2 (rs2304255 C > T) позиционируется в экзоне 8 TYK2 и определяет миссенс-замещения в белке. Данные об ассоциации полиморфных маркеров DDX58 (rs34085293 T > G) и TYK2 (rs2304255 C > T) с клиническим эффектом секукинумаба в популяции суперответчиков, а также доказательства участия генов TYK2 и DDX58 в оси ИЛ-23/ИЛ-17 убедительно свидетельствуют о важности этих патогенетических путей в ответе на лечение ингибиторами ИЛ-17А.
Цель исследования – провести анализ наличия полиморфизма генов TYK2 (rs2304255) и DDX58 (rs34085293) у больных псориазом и оценить взаимосвязь данных однонуклеотидных полиморфизмов с терапевтической эффективностью ингибитора ИЛ-17А нетакимаба.
Материал и методы
В исследование включали пациентов, имеющих среднетяжелые и тяжелые формы псориаза обыкновенного или пустулезный псориаз, которым показана биологическая терапия. Лечение проводили блокатором ИЛ-17 нетакимабом по стандартной схеме согласно инструкции препарата: 120 мг в виде двух подкожных введений по 60 мг на 0, 1, 2-й неделях, далее каждые четыре недели. Пациенты подписывали добровольное информированное согласие на обследование и проведение лечебных мероприятий.
Критерии исключения: наличие сопутствующих заболеваний кожного покрова, затрудняющих оценку тяжести и выраженности основного заболевания; клинически значимые отклонения в лабораторных или инструментальных исследованиях, проводимых на этапе скрининга; состояния, препятствующие выполнению пациентом процедур, связанных с исследованием.
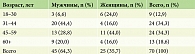
Выборка состояла из 70 пациентов: 60 из них больные псориазом обыкновенным, 10 страдали пустулезным псориазом; гендерный состав – 45 (64,3%) мужчин и 25 (35,7%) женщин (табл. 1).
Медиана возраста пациентов общей выборки составила 45 [31; 59] лет. Возраст начала заболевания псориазом в общей выборке варьировал от 10 до 40 лет, медиана и межквартильный размах составили 28,7 [20,0; 35,0] года. Длительность заболевания в общей выборке составила 7 [3; 11] лет с разбросом от 2 до 30 лет.
Клинические исследования включали в себя сбор анамнеза, содержащий информацию о дебюте, продолжительности, течении и предшествующем лечении псориаза, наличии отягощенного наследственного анамнеза по псориазу, сопутствующих и коморбидных заболеваний. У каждого участника получены ответы на вопросы об основных жалобах, пациенты проходили осмотр у соответствующих специалистов, также им проводили комплексное клинико-лабораторное и инструментальное обследование.
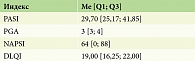
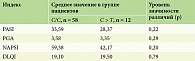
Всем пациентам проводили описание локального статуса кожного патологического процесса, определение индекса площади и тяжести псориатических поражений PASI (Psoriasis Areaand Severity Index), индекс тяжести псориатической ониходистрофии NAPSI (Nаil Psoriasis Severity Index), дополнительно основные клинические признаки оценивали с помощью шкалы PGA (Physician Global Assessment) – общая оценка состояния пациента врачом. Для оценки степени негативного воздействия псориаза на разные аспекты жизни пациента проводили анкетирование для определения дерматологического индекса качества жизни (Dermatology Life Quality Index, DLQI) (табл. 2).
Степень тяжести псориатического поражения кожи на основании комбинированного оценочного индекса вовлеченной площади и характеристики поражения (PASI) в общей выборке варьировала от 16,1 до 61,4 балла, медиана и интерквартильный размах составили 29,7 [25,17; 41,85]. Общая оценка тяжести псориаза врачом, отражающая личное мнение врача о тяжести заболевания в конкретный момент времени (PGA), в данной выборке составила 3 [3; 4] балла с вариацией от трех до шести баллов. Срединное значение индекса качества жизни (DLQI) в исследуемой когорте пациентов составило 19 [16,25; 22,00] баллов. Медиана индекса тяжести псориатической ониходистрофии (NAPSI) – 19 [16,25; 22] баллов.
Генетические исследования проводили путем выделения образцов ДНК из цельной крови исследуемых методом полимеразной цепной реакции в режиме реального времени на амплификаторе QuantStudio 5 Real-TimePCR, с последующим изучением распределения аллелей и генотипов полиморфизма гена DDX58 (rs34085293) и TYK2 (rs2304255) у пациентов с псориазом. Результаты полимеразной цепной реакции оценивали в соответствии с инструкцией к набору для детекции полиморфизма DDX58 (rs34085293) и TYK2 (rs2304255) «ДНК-Синтез», Россия.
Статистическую обработку данных проводили с использованием языка программирования для статистической обработки данных R (версия 4.4.1) в среде разработки RStudio (ver. 2024.12.0 build 467) с помощью набора программ MicrosoftOfficeExcel 2016 для работы с электронными таблицами и STATISTICA for Windows (версия 6.0, StatsoftInc., лицензионный номер AXXR009E747530FAN25). Для описания категориальных переменных использовали указание абсолютных и относительных значений (n, %). Проверку на нормальность распределения осуществляли с применением теста Шапиро – Уилка, в результате чего получили отличное от нормального распределение количественных величин. В связи с этим для описания количественных величин были использованы медиана (Me) и интерквартильный размах (Q1–Q3). Сравнительный анализ количественных величин проводили с применением непараметрического теста Манна –Уитни.
Результаты
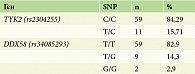
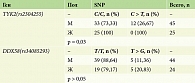
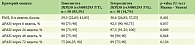
Выявлена частота экспрессии однонуклеотидных полиморфизмов в аллелях DDX58 (rs34085293) и TYK2 (rs2304255) у пациентов с псориазом. 59 (84,29%) пациентов являлись гомозиготными по гену TYK2 (rs2304255 C/С), 11 (15,71%) пациентов – гетерозиготными TYK2 (rs2304255 C > T), такое же количество – 59 (82,9%) человек являлись гомозиготными по гену DDX58 (rs34085293 T/T), 9 (14,3%) пациентов – гетерозиготными DDX58 (rs34085293 T > G), а у 2 (2,9%) пациентов аллель риска присутствовал в гомозиготном состоянии DDX58 (rs34085293 G/G). Распределение генотипов в исследуемой группе TYK2 (rs2304255 C/C) и DDX58 (rs34085293 T/T) соответственно представлено в табл. 3.
Распределение генотипов по изучаемым аллельным вариантам соответствовало ожидаемым и согласовывалось с распределением по закону Харди – Вайнберга (p > 0,05). Отсутствие полиморфизмов в генах TYK2 (rs2304255 C/C) или DDX58 (rs34085293 T/T) считали аллелем дикого типа.
Далее был проведен апостериорный анализ данных наличия связи экспрессии однонуклеотидных полиморфизмов в геноме человека аллели DDX58 (rs34085293 T > G) и TYK2 (rs2304255 C > T) с тяжестью течения псориаза и индивидуальным профилем пациентов.
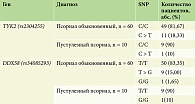
Частота ассоциации полиморфных маркеров изучаемых генов у пациентов с обыкновенным и пустулезным псориазом представлена в табл. 4.
Распределение полиморфизма гена TYK2 (rs2304255 C > T) среди пациентов: 11 (18,33%) с псориазом обыкновенным, и 1 (10%) с псориазом пустулезным. Пациентов с аллелью риска в гомозиготном состоянии по ТYК2 (rs2304255 Т/Т) не было выявлено. Общая частота встречаемости аллеля TYK2 (rs2304255 C > T) составила 18,33%. Распределение аллелей и генотипов соответствовало закону Харди – Вайнберга (χ2 = 1,7; p = 0,78). Статистически значимых ассоциаций не наблюдалось, уровень значимости – p > 0,05. Девять (15%) пациентов были гетерозиготны по DDX58 (rs34085293 T > G) с псориазом обыкновенным, гетерозиготных по DDX58 (rs34085293 T > G) больных пустулезным псориазом не выявлено. Один (1,65%) пациент был гомозиготен по DDX58 (rs34085293 G/G) c псориазом обыкновенным и 1 (10%) – с пустулезным. В целом частота ассоциации аллеля DDX58 (rs34085293 T > G) составила 15,00%, а DDX58 (rs34085293 G/G) – 2,85%. Частота генотипов для обоих полиморфизмов DDX58 (rs34085293 T > G) (χ2 = 1,06; p = 0,91) и DDX58 (rs34085293 G/G) (χ2 = 0,8; p = 0,96) соответствовала уравнению Харди – Вайнберга. Среди пациентов с псориазом обыкновенным больший процент имеет полиморфизм аллели DDX58 (rs34085293 T > G), чем в группе пациентов с пустулезным псориазом (p = 0,09).
Для оценки влияния наличия/отсутствия полиморфизма TYK2 (rs2304255 C > T) и полиморфизма аллели DDX58 (rs34085293 T > G) на степень активности псориаза применяли непараметрический критерий сравнения средних значений Манна – Уитни, основные результаты которого представлены в табл. 5 и 6.
Значимых различий в группах пациентов с наличием полиморфного маркера C > T и отсутствием полиморфизма С/С не выявлено.
По основным показателям тяжести и активности псориаза (PASI, PGA) значимых различий не выявлено, определены различия по индексам NAPSI и DLQI.
Оценена гендерная принадлежность пациентов с псориазом и исследуемыми однонуклеотидными полиморфизмами, распределение ассоциации представлено в табл. 7.
Среди мужской выборки пациентов с псориазом наличие полиморфизма TYK2 (rs2304255 C > T) встречается статистически значимо чаще, чем в женской (р = 0,03); наличие полиморфизма DDX58 (rs34085293 Т/G) статистически значимых отклонений не продемонстрировало (p > 0,05).
Проанализировано значение однонуклеотидных полиморфизмов в генах TYK2 (rs2304255) и DDX58 (rs34085293) исследуемых пациентов в ассоциации с триггерными факторами дебюта псориаза (табл. 8).
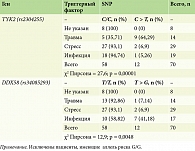
При изучении ассоциации триггерных факторов, имеющих значение в дебюте псориаза у пациентов с наличием изучаемых полиморфзмов, выявлено, что в группе гетерозигот по полиморфизму TYK2 (rs2304255 C > T) наибольший процент составляет травматическое повреждение кожи – 64,29%, а у пациентов с гетерозиготной аллелью риска в гене DDX58 (rs34085293 T > G) больший процент имеет перенесенная инфекция – 41,18%. Различия в группах носили статистически значимый характер: χ2 Пирсона = 27,6; р = 0,00001 в группе пациентов с полиморфизмом в TYK2 (rs2304255 C > T) и χ2 Пирсона = 12,9; р = 0,0048 в группе пациентов с полиморфизмом DDX58 (rs34085293 T > G).Таким образом, можно предположить, что у гетерозиготных лиц по аллелям TYK2 (rs2304255 C > T) провоцирующим фактором в развитии хронического дерматоза выступил фокус гиперраздражимости ткани, а у пациентов группы с полиморфизмом аллели DDX58 (rs34085293 T > G) показателем повышенного риска может считаться инфекционный процесс.
Терапевтическая эффективность ингибитора ИЛ-17А нетакимаба
При изучении влияния однонуклеотидных полиморфизмов (SNP) TYK2 (rs2304255) и DDX58 (rs34085293) на эффективность терапии нетакимабом у пациентов с псориазом оценивали клинические индексы и их динамику через 6, 24, 48, 72 недели терапии. На первом этапе при оценке общей эффективности нетакимаба во всей группе исследуемых определены медианы индексов в контрольных точках исследования: 0, 24, 48, 72-я недели лечения. При оценке PASI до лечения (0-я неделя) определили среднее значение PASI в баллах, далее оценивали клиническую эффективность лечения с помощью определения снижения значения индекса PASI в динамике и рассчитывали по следующей формуле: [(PASIдо лечения – PASIпосле лечения) / PASIдо лечения] × 100% = ΔPASI. Нетакимаб продемонстрировал высокую эффективность терапии псориаза в исследуемой группе, что отражают показатели оценочных индексов (табл. 9).
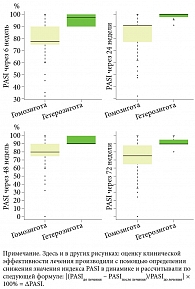
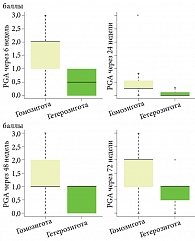
Оценка динамики индекса ΔPASI у пациентов с полиморфизмом TYK2 (rs2304255 C > T) показала статистически значимые различия в группах с гомозиготным вариантом генотипа С/С и гетерозиготным Т/С (тест Манна – Уитни, p < 0,001). Количество пациентов, достигших ΔPASI 90 во всех контрольных точках исследования с гетерозиготой гена TYK2 (rs2304255 C > T), значительно превышает количество больных с гомозиготой в этой аллели (табл. 10, рис. 1). Стоит отметить, что до начала лечения группы с различными аллелями гена имели относительно равнозначные показатели PASI (p = 0,334), что демонстрирует однородность групп по тяжести псориаза (табл. 10).
Полученные данные подтверждает и динамика индекса PGA в группах пациентов с однонуклеотидным полиморфизмом гена TYK2 (rs2304255), оценку которого проводили во всех контрольных точках на этапах терапии нетакимабом. Более значимые отличия между группами по данному индексу зафиксированы на 6-й и 24-й неделях терапии (p < 0,001), далее отличия менее значительны, но остаются достоверными (табл. 11, рис. 2).
При изучении влияния однонуклеотидных полиморфизмов (SNP) гена DDX58 (rs34085293) на эффективность терапии нетакимабом проведен анализ полученных данных с разделением пациентов на группы в зависимости от наличия или отсутствия полиморфизма: сравнивали ответ на терапию пациентов с гомозиготным аллелем дикого типа Т/Т и объединенные мутантные аллели: гетерозиготный T/G и гомозиготный G/G; а также сопоставляли ответ на терапию между аллелями T/T и T/G, исключив пациентов, имеющих тип G/G.
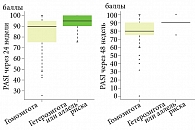
Оценка изменений индекса PASI в процессе лечения показала статистически достоверные различия через 24 и 48 недель лечения между пациентами с аллелем дикого типа Т/Т и пациентами с аллелем риска T/G + G/G: значение ΔPASI было выше (p = 0,033) в группе с полиморфизмами T/G + G/G. При этом показатели PASI до лечения и через 6 недель не различались в исследуемых группах, результат оценки по PASI на 72-й неделе также не показал различий (табл. 12, рис. 3).
Показатели индекса PGA в сравниваемых группах не имели значимых различий во всех контрольных точках исследования.
Сравнение эффективности нетакимаба во второй группе пациентов с однонуклеотидными полиморфизмами гена DDX58 (rs34085293), где сопоставили данные пациентов с гомозиготным генотипом DDX58 (rs34085293 T/Т) и гетерозиготным DDX58 (rs34085293 T/G) (пациенты с SNP G/G исключены), по индексу PASI показало, что группы имели статистически значимые различия на 6, 24 и 48-й неделях терапии: в группе гетерозиготных пациентов PASI был статистически значимо выше (p < 0,05); на 72-й неделе терапии пациенты всех групп не имели различий в ответе на лечение (p = 0,126), также статистически значимых различий в баллах PGA выявлено не было (табл. 13, рис. 4).
Заключение
Данные об ассоциации полиморфных однонуклеотидов генов TYK2 (rs2304255) и DDX58 (rs34085293) c максимальным клиническим эффектом – достижением и длительным удерживанием PASI 100 при блокаде ИЛ-17А, а также доказательства участия этих генов в патогенетической оси развития псориаза ИЛ-23/ИЛ-17 убедительно свидетельствуют о важности изучения влияния однонуклеотидных полиморфизмов этих генов на эффективность терапии.
В нашем исследовании анализировали генотип пациентов с псориазом с фокусом на возможные однонуклеотидные полиморфизмы в генах TYK2 (rs2304255) и DDX58 (rs34085293) и взаимосвязь изучаемых аллелей генов с эффективностью терапии ингибитором ИЛ-17A нетакимабом.
По основным показателям тяжести и активности псориаза (PASI, PGA) значимого влияния на тяжесть течения псориаза наличие или отсутствие полиморфизма в изучаемых генах не выявлено.
Обнаружено статистически значимое различие в частоте встречаемости полиморфизма у ТYК2 (rs2304255 С > Т) пациентов мужского пола и женского (р = 0,03). Среди мужской выборки статистически значимых отклонений в наличии полиморфизма DDX58 (rs34085293 T/G) не выявлено (p > 0,05).
Анализ возможного влияния однонуклеотидных полиморфизмов на развитие псориаза в дебюте показал, что у гетерозиготных лиц по аллелям ТYК2 (rs2304255 С > Т) провоцирующим фактором в развитии хронического дерматоза часто является гиперраздражимость ткани вследствие травмы, а у пациентов с полиморфизмом аллели DDX58 (rs34085293 T/G) показателем повышенного риска может считаться инфекционный процесс.
Все пациенты в данном исследовании проходили лечение нетакимабом по стандартной схеме, согласно инструкции препарата, с положительной динамикой оценочных индексов и выраженным клиническим эффектом.
При разделении пациентов на группы по генотипу с оценкой динамики PASI в группах с полиморфизмом ТYК2 (rs2304255 С > Т) получены статистически значимые различия у пациентов с гомозиготой С/С и гетерозиготой Т/С, демонстрирующие высокую эффективность терапии нетакимабом (PASI 100) и удержание эффекта PASI 90 до 72-й недели терапии у гетерозиготных пациентов с генотипом ТYК2 (rs2304255 С > Т) (p < 0,001). Полученные данные подтверждает и динамика индекса PGA в группах пациентов с однонуклеотидным полиморфизмом гена ТYК2 (rs2304255 С > Т).
Изучение влияния однонуклеотидных полиморфизмов гена DDX58 (rs34085293) на результаты лечения нетакимабом также показало их значимость в формировании индивидуального ответа на терапию. Сравнение эффективности нетакимаба по индексу PASI в группах пациентов с гомозиготным генотипом DDX58 (rs34085293 T/T) и гетерозиготным генотипом DDX58 (rs34085293 T/G) показало, что группы имели статистически значимые различия на 6, 24 и 48-й неделях – у гетерозиготных пациентов эффект от терапии нетакимабом был выше (p < 0,05).
Полученные данные фармакогенетического исследования, обусловливающие эффективность терапии псориаза, позволят усовершенствовать предиктивную диагностику для определения прогнозируемого эффекта терапии псориаза, что в дальнейшем расширит возможности точной интерпретации индивидуального профиля пациента и его генетических предикторов для определения персонифицированного подхода в лечении.
Исследование и публикацияне имеют финансовой поддержки.
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
I.G. Egoshina, E.A. Shatokhina, PhD, Prof., L.S. Kruglova, PhD, Prof., O.E. Yanets, PhD
Kuzbass Clinical Skin and Venereological Dispensary, Kemerovo
Kemerovo State Medical University, Kemerovo
Central State Medical Academy of Department of Presidential Affairs, Moscow
Medical Scientific and Educational Institute of Lomonosov Moscow State University, Moscow
Contact person: Evgeniya Shatokhina, e-mail: sh.77@mail.ru
The data on the association of single nucleotide polymorphisms of TYK2 (rs2304255) and DDX58 (rs34085293) genes and the maximal clinical effect – achievement and long-term retention of PASI100 with interleukin (IL) 17A blockade, involvement of these genes in the pathogenetic axis of IL-23/IL-17 psoriasis development – strongly indicate the importance of studying the impact of single nucleotide polymorphisms of these genes at therapy effectiveness.
Purpose. Tо analyze the presence of TYK2 (rs2304255) and DDX58 (rs34085293) gene polymorphisms in patients with psoriasis and to evaluate the relationship of these single-nucleotide polymorphisms and therapeutic efficacy of IL-17A inhibitor netakimab.
Material and methods. 70 patients (45 males and 25 females, median age 45 years) with moderate to severe forms of psoriasis vulgaris (n = 60) and pustular psoriasis (n = 10) were enrolled in the study. They were treated with IL-17A inhibitor netakimab. Clinical parameters were registered at weeks 0, 6, 24, 48 and 72 of the treatment. Polymerase chain reaction was used to determine allelic variants of TYK2 (rs2304255) and DDX58 (rs34085293) genes. Data statistical processing was done to find out the effectiveness of the studied genotypes at the psoriasis course and netakimab effectiveness.
Results and discussion. The overall incidence of TYK2 (rs2304255 C > T) allele was 18.33%; 15% of patients with psoriasis vulgaris were heterozygous for DDX58 (rs34085293 T > G). DDX58 (rs34085293 G/G) allele incidence was 1%. By the basic indicators of psoriasis severity and activity (Psoriasis Area and Severity Index, PASI and Physician Global Assessment, PGA), polymorphism presence or absence in the studied genes did not significantly influence the type of psoriasis severity. A statistically significant difference was found in TYK2 (rs2304255 C > T) polymorphism incidence in male patients (p = 0.03); the presence of DDX58 (rs34085293 T > G) polymorphism did not produce any statistically significant deviations in the male population (p > 0.05). In heterozygous individuals with TYK2 (rs2304255 C > T) alleles, tissue hyperexpression due to injury was a provoking factor in the psoriasis development; in individuals with DDX58 (rs34085293 T > G) polymorphism, an infectious process is thought to be an indicator of the increased risk. When assessing PASI and PGA dynamics in patients with TYK2 (rs2304255C > T) polymorphism, differences were registered in groups with homozygote (C/C) and heterozygote (C > T), which demonstrates a high efficacy of netakimab therapy (PASI 100) and retention of the effect of at least PASI 90 until therapy week 72 in patients with heterozygous genotype TYK2 (rs2304255 C > T) (p < 0.001). While comparing netakimab effectiveness by PASI index in groups with homozygous genotype DDX58 (rs34085293 T/T) and heterozygous genotype DDX58 (rs34085293 T > G), a significant difference was found at weeks 6, 24, and 48; in heterozygous patients, the effect of netakimab therapy was higher (p < 0.05).
Conclusion. The obtained pharmacogenomic research data – demonstrating the effectiveness of psoriasis therapy – will improve predictive diagnostics so as to assess the expected effectiveness of psoriasis therapy. In future, it could be used for the accurate interpretation of the individual patient’s profile and its genetic predictors so as to develop a personalized management plan.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.