Жизнь после COVID-19: первое масштабное исследование в нейрореабилитации! XVII Ежегодная междисциплинарная конференция с международным участием «Вейновские чтения». Сателлитный симпозиум компании «Такеда Фармасьютикалс»
- Аннотация
- Статья
- Ссылки




Первый опыт восстановления пациентов с неврологическими последствиями COVID-19
Виталий Владимирович КОВАЛЬЧУК, д.м.н., профессор, заслуженный врач РФ, руководитель Центра медицинской реабилитации ГКБ № 38 им. Н.А. Семашко, председатель общества реабилитологов Санкт-Петербурга, отметив наличие спектра разнообразных неврологических осложнений со стороны центральной и периферической нервной системы, ассоциированных с COVID-19, акцентировал внимание коллег на связи аносмии с многочисленными психоэмоциональными симптомами и когнитивными нарушениями.
Изначально считалось, что причина аносмии в случае вирусной инфекции – застойные явления в слизистой оболочке полости носа и, как следствие, обструкция носовых ходов, потеря чувствительности. Однако при выполнении магнитно-резонансной томографии обонятельных областей зачастую регистрируется нормальная интенсивность сигнала, не обнаруживаются признаки застоя в носовых раковинах. Иными словами, отсутствуют патологические изменения слизистой оболочки полости носа, которые могли быть вызваны вирусом SARS-CоV-2. Следовательно, нарушения обоняния обусловлены нейротропным вирусным поражением собственно обонятельной системы.
Кроме того, вирус SARS-CоV-2 способен проникать в ткани головного мозга через обонятельную луковицу и стремительно распространяться через ее связи первого и второго порядка в инфралимбическую и грушевидную кору, базальные ганглии и дорзальный шов среднего мозга, вызывая определенные нарушения. Так, поражение грушевидной коры приводит к нарушению пищевого поведения и психоэмоциональным расстройствам, поражение инфралимбической коры – к активации стресс-реализующих систем. Поражение вентрального паллидума связано с асоциальным поведением и тревогой, а поражение вентролатерального преоптического ядра – с развитием диссомнии, когнитивных расстройств.
На фоне коронавирусной инфекции развиваются и прогрессируют острая некротическая энцефалопатия, менингит и энцефалит, хроническая ишемия головного мозга (ХИГМ), инсульт, лейкоэнцефалопатия, синдром Гийена – Барре, синдром Миллера – Фишера (острая демиелинизирующая воспалительная полинейропатия).
Особую бдительность клиницистам следует проявлять в отношении симптомов острого нарушения мозгового кровообращения у пациентов с коронавирусной инфекцией. Установлено, что у пациентов с инсультом в сочетании с COVID-19 наблюдаются более тяжелая неврологическая симптоматика и высокая частота летальных исходов по сравнению с больными, перенесшими инсульт, без COVID-19
(63 против 9% соответственно).
Чтобы пациентам с сосудистыми заболеваниями головного мозга (СЗГМ) и коронавирусной инфекцией подобрать адекватную патогенетическую терапию, необходимо понимать возможные причины инсульта на фоне коронавирусной инфекции. Это могут быть вызванные инфекционным процессом нарушения реологических свойств крови и коагулопатии, цитокиновый шторм, гипоксия, макро- и микроангиопатии, являющиеся ведущей патоморфологической причиной развития инсульта на фоне COVID-19.
Действие SARS-CoV-2 реализуется через рецепторы ангиотензинпревращающего фермента 2 (АПФ2) как в органах (сердце, легкие, почки, кишечник), так и в эндотелиальных клетках сосудов, что приводит к эндотелииту, эндотелиальному тромбовоспалительному синдрому. Зарубежные ученые назвали его микрососудистым COVID-19 легочно-сосудистым обструктивным тромбовоспалительным синдромом (MicroCLOTs)1. Сказанное означает, что тромбообразование возможно не только в сосудах легких, но и в сосудах других органов, в том числе головного мозга.
Тактика ведения пациентов с инсультом и ХИГМ на фоне COVID-19 предусматривает прежде всего назначение специфической терапии (противовирусной, антимикробной, муколитической, жаропонижающей, нейроцитопротективной и др.). Безусловно, выбор препаратов для патогенетической терапии должен быть адекватным и дифференцированным.
Обычно ведение пациентов в острейшей стадии инсульта предполагает использование тромболитической терапии. Вместе с тем на фоне коронавирусной инфекции не исключено снижение эффективности и пользы от применения внутривенного тромболизиса вследствие нарушений коагуляции, обусловленных COVID-19. При коронавирусной инфекции повышается концентрация маркеров гиперкоагуляции и воспаления. С одной стороны, это не является противопоказанием к проведению тромболитической терапии, с другой, согласно результатам исследований, на фоне внутривенного тромболизиса при COVID-19 повышается уровень смертности, инвалидизации и посттромболитических кровоизлияний.
Первичная и вторичная профилактика сосудистых заболеваний при COVID-19 безусловно важна. При этом медикаментозная терапия основывается на принципе «АБС» – антигипертензивные средства, блокаторы тромбообразования и статины.
В целях профилактики и лечения СЗГМ на фоне и после коронавирусной инфекции необходимо обеспечить определенные эффекты на уровне микроциркуляции. Такие эффекты оказывает препарат Актовегин.
Актовегин сочетает в себе свойства нейроэнергокорректора и антиоксиданта2. Эффекты Актовегина распространяются на все уровни нарушения микроциркуляции крови. Препарат уменьшает тонус прекапиллярных артериол и спазмированных сфинктеров, улучшает метаболизм клеток эндотелия, усиливает процессы фильтрации и реабсорбции, уменьшает артериоловенулярное шунтирование и отек интерстициального пространства, повышает количество функционирующих капилляров.
Назначая терапию пациентам с СЗГМ на фоне коронавирусной инфекции, необходимо учитывать наличие такого патогенетического механизма, как окислительный стресс. Его можно рассматривать как дисбаланс между продукцией свободных радикалов и истощением антиоксидантной системы. Коронавирус стимулирует гиперпродукцию активных форм кислорода, которые характеризуются более высокой реакционной активностью по сравнению с молекулярным кислородом.
Кроме того, следует помнить о патогенетическом механизме развития нейрометаболических и ангионеврологических нарушений на фоне коронавирусной инфекции – энергодефиците. Энергодефицит приводит к уменьшению скорости аэробного окисления и соответственно к уменьшению функциональных возможностей нервных клеток и активации фосфофруктокиназы со всеми вытекающими негативными последствиями, вплоть до гибели нервной ткани.
Энергодефицит и окислительный стресс – звенья одной патогенетической цепи, поскольку первичный энергодефицит приводит к неполноценной трансформации метаболитов в циклах анаэробного и аэробного гликолиза. Актовегин – препарат, который способен купировать данные явления.
Эндотелиопротективный, вазоактивный, нейротрофический, энергокорректирующий эффекты Актовегина позволяют рассматривать его в качестве основного препарата для патогенетической терапии сосудисто-дегенеративных заболеваний на фоне COVID-19.
Профессор В.В. Ковальчук поделился с участниками симпозиума собственным опытом применения Актовегина у пациентов с СЗГМ на фоне коронавирусной инфекции. Он представил результаты исследования эффективности Актовегина у больных ХИГМ на фоне COVID-19. В исследование были включены 440 пациентов, разделенные поровну на группу Актовегина и группу контроля. Все участники исследования были стандартизированы по 18 показателям, включая пол, возраст, степень тяжести течения коронавирусной инфекции, стадию хронической ишемии головного мозга, степень поражения легочной ткани, методы физической реабилитации, медикаментозную терапию. Эффективность терапии оценивали по валидизированным субъективным и объективным шкалам.
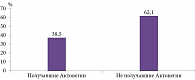
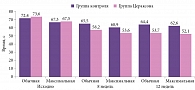
Результаты исследования продемонстрировали высокую эффективность препарата Актовегин в терапии ХИГМ при COVID-19. У пациентов на фоне терапии Актовегином частота встречаемости симптомов ХИГМ была статистически значимо меньше, чем в группе контроля, – 38,5 против 62,1% (рис. 1). Применение Актовегина позволило существенно уменьшить выраженность астении – достаточно распространенного симптома у больных, перенесших коронавирусную инфекцию. Согласно шкале оценки астении MFI-20, к 90-му дню лечения выраженность астении в группе Актовегина снизилась с 68 до 48 баллов по сравнению с 61 баллом в группе контроля (рис. 2).
Одним из частых симптомов, существенно снижающих качество жизни пациентов с ХИГМ и COVID-19, считается нарушение сна. Согласно шкале оценки сна Шпигеля, в группе Актовегина отмечалось статистически значимое улучшение состояния сна, что выразилось повышением баллов – с 11 до 22 против 17 баллов в группе контроля.
Терапия Актовегином продемонстрировала преимущество и в улучшении когнитивных функций. Согласно оценке по шкале MoCA, в группе Актовегина к 90-му дню показатели когнитивных функций увеличились с 20 до 24 баллов. В то же время в группе контроля аналогичные показатели увеличились лишь на один балл – с 21 до 22 (рис. 3).
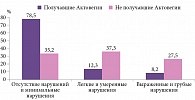
Профессор В.В. Ковальчук акцентировал внимание коллег на методах реабилитации с точки зрения инсульта и COVID-19. Стандартная реабилитации с точки зрения инсульта основывается на принципах ранней реабилитации и вертикализации пациента. Она также включает в себя физическую реабилитацию, постуральную коррекцию, купирование синдрома неглекта, лечебную физкультуру, эрготерапию и психотерапевтическую реабилитацию. Однако реабилитация пациентов с инсультом в условиях COVID-19 имеет свои особенности. Важным направлением реабилитации с точки зрения COVID-19 и инсульта считается предотвращение аспирации и аспирационной пневмонии, особенно у интубированных пациентов и пациентов с трахеостомой.
Чрезвычайно важна дыхательная гимнастика, позволяющая снижать риск респираторных заболеваний, предупреждать развитие осложнений пневмонии, увеличивать жизненную емкость легких, восстанавливать и повышать эффективность дыхания, укреплять дыхательные и аксиальные мышцы, повышать общий тонус и сопротивляемость организма.
Какие методы дыхательной гимнастики у пациентов с инсультом и COVID-19 необходимо исключить? Прежде всего не следует прибегать к таким упражнениям, как надувание шариков, резиновых мячей, игрушек, выдувание воздуха в воду через трубочку. Подобные упражнения могут привести к существенному повышению внутрилегочного давления с повреждением легочной ткани, увеличением риска кровоизлияний и тромбообразования, усугублением фиброза и распространением инфекционного процесса.
Исключаются и некоторые методики йоги, например дыхание уджайи («дыхание победы») на выдохе, которое может привести к повышению внутрилегочного давления. Кроме того, нельзя использовать такие техники йоги, как бхастрика и капалабхати, способные вызвать резкие перепады давления в грудной клетке и усугубить патологические изменения легочной ткани. Таким образом, упражнения с резким форсированным выдохом должны быть исключены из программы реабилитации до нормализации картины на компьютерной томограмме.
Нередко у пациентов наблюдается поверхностное и частое дыхание, что ведет к значительному увеличению отношения «мертвого» функционального пространства к жизненной емкости легких и ухудшению эффективной альвеолярной вентиляции. Для дыхательной реабилитации таких пациентов можно применять технику полного дыхания, которая включает в себя три фазы дыхания: нижнюю – диафрагмальную, срединную – реберную и верхнюю – ключичную.
Весьма эффективна простая в исполнении техника йоги уддияна-бандха («лев, который побеждает слона»). Неподготовленные пациенты могут выполнять ее в положении стоя.
При нарушении дренажной функции легких назначается постуральный дренаж, который необходимо проводить под контролем показателей частоты сердечных сокращений, артериального давления (АД) и сатурации. Для усиления эвакуации секрета из легочных бронхиол и альвеол в бронхи более высокого порядка используется глубокое медленное дыхание в виде активных движений диафрагмой во время вдоха. При этом необходимо избегать приостановки дыхания на длительное время.
Противопоказаниями к проведению физической реабилитации пациентов с инсультом и коронавирусной пневмонией являются высокая температура тела (38 °С и выше), сатурация менее 90%, частота дыхательных движений 25 в минуту, систолическое АД более 180 мм рт. ст. или менее 90 мм рт. ст., выраженные нарушения сердечного ритма, высокий риск тромбоэмболических осложнений и кровотечений, 4 балла по шкале Борга.
Медикаментозная терапия считается составной частью комплексной реабилитации пациентов как с СЗГМ, так и с коронавирусной инфекцией, особенно с их сочетанием. Это связано с тем, что эндотелиальная дисфункция является одной из важнейших патофизиологических причин СЗГМ, поскольку эндотелий утрачивает барьерные свойства, способность регуляции сосудистого тонуса и его толщины, управления процессами коагуляции и фибринолиза, иммунное и противовоспалительное действие.
Крайне важна протективная терапия эндотелия, прежде всего адекватный выбор эндотелиопротекторов. Эндотелиопротективный препарат должен увеличивать скорость капиллярного кровотока, уменьшать перикапиллярную зону, снижать миогенный тонус прекапиллярных артериол и прекапиллярных сфинктеров, степень артериоловенулярного шунтирующего кровотока с преимущественной циркуляцией крови в капиллярном русле. Перечисленным требованиям отвечает препарат Актовегин3.
Кроме того, не следует забывать о ведущей причине эндотелиальной дисфункции – снижении уровня оксида азота (NO) в стенках кровеносных сосудов. Необходима стимуляция функции эндотелиальной синтазы оксида азота. Препарат Актовегин, который улучшает метаболизм клеток эндотелия, позволяет справиться и с этой проблемой.
В исследовании оценивали влияние Актовегина на реологические свойства крови у больных хронической ишемией мозга4. Показано, что Актовегин положительно влияет на реологические свойства эритроцитов, облегчая их проникновение в наиболее труднодоступные участки микроциркуляционного русла.
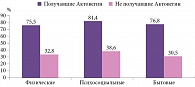
Основная цель терапии и реабилитации – повышение уровня и улучшение качества жизни больных. В ранее озвученном собственном исследовании оценивали влияние Актовегина на качество жизни пациентов с ХИГМ на фоне коронавирусной инфекции. Полученные результаты продемонстрировали преимущество Актовегина перед плацебо: в группе Актовегина отсутствие нарушений или минимальные нарушения качества жизни регистрировались в 78,8% случаев, в группе пациентов, не получавших препарат, – лишь в 35,2% случаев (рис. 4). Актовегин статистически значимо улучшал все составляющие качества жизни: физические характеристики (75,5 против 32,8%), психосоциальные (81,4 против 38,6%), бытовые (76,8 против 30,5%) (рис. 5).
По мнению профессора В.В. Ковальчука, Актовегин, как любой нейроцитопротектор, необходимо назначать в насыщающих, поддерживающих и оптимальных дозах. Оптимальная схема такова: в первые 10–14 дней Актовегин используют в виде раствора для инъекций в дозе 400–800 мг внутривенно капельно, затем переходят на терапию Актовегином в таблетированной форме по 400 мг (две таблетки) три раза в день до 20 недель.
COVID-19 и инсульт: особенности клинических проявлений и возможности реабилитации
Свое выступление Лариса Леонидовна КОРСУНСКАЯ, д.м.н., профессор, главный невролог Министерства здравоохранения Республики Крым, заведующая кафедрой неврологии и нейрохирургии Медицинской академии им. С.М. Георгиевского Крымского федерального университета им. В.И. Вернадского, начала с систематического обзора, подготовленного специалистами Кембриджского университета5. Обзор проводился с целью выявления в трех медицинских базах данных (Scopus, PubMed, MedRxiv) публикаций, посвященных острым цереброваскулярным заболеваниям при COVID-19 (декабрь 2019 – сентябрь 2020 г.) и последующему анализу частоты, факторов риска, клинико-радиологических проявлений и исхода инсульта, связанного с коронавирусной инфекцией. Всего в обзор было включено 145 статей. В 24 когортных исследованиях сообщалось о частоте острых сердечно-сосудистых заболеваний (ССЗ) у пациентов с CОVID-19 в диапазоне от 0,4 до 8,1%. Общая объединенная частота инсультов составила 1,4%.
Для сравнения клинических характеристик использовались четыре исследования с участием 11 683 больных COVID-19 и 113 пациентов с COVID-19 и инсультом. Риск инсульта при CОVID-19 был выше у пациентов старшего возраста. При этом наиболее высокой вероятностью развития ССЗ характеризовались пациенты с гипертонией, сахарным диабетом и ишемической болезнью сердца. Метаанализ показал, что инсульт у больных CОVID-19 обусловлен более тяжелым течением инфекционного заболевания, причем тяжелая форма CОVID-19 имела место в 61% случаев. В обеих группах зафиксирован высокий уровень D-димера без существенных различий в средних значениях.
Анализ причины госпитализации продемонстрировал наличие неврологических симптомов, связанных с инсультом, в 37,7% случаев. Рентгенологические признаки пневмонии выявлены у 87% пациентов, тромбоэмболия – у 14,8%. Лабораторные исследования показали повышенные медианные уровни D-димера и фибриногена, антифосфолипидные антитела обнаружены в 17,2% случаев.
У подавляющего большинства пациентов (87,4%) развился ишемический инсульт и только у 11,5% – геморрагический. Средний балл по шкале тяжести инсульта (NIHSS) – 15. Картина инсульта с окклюзией крупных сосудов описана у 80% пациентов. Одновременное вовлечение разных сосудистых территорий было частым – 42,5% случаев.
Основываясь на данных 829 пациентов, можно сказать, что наиболее частый механизм инсульта – криптогенный (44,7%), за ним следуют кардиоэмболия (22%) и атеросклероз крупных сосудов (10,6%). Инсульт мелких сосудов зарегистрирован лишь в 3,3% случаев.
В 44 исследованиях представлены данные о смертности и результатах выписки пациентов с инсультом и COVID-19. Так, 31,5% больных умерли в стационаре, 19,1% выписаны домой и 25,7% – в реабилитационные центры.
Для сравнения характеристик инсульта у пациентов с COVID-19 и без него проанализированы результаты 11 исследований. Метаанализ показал, что пациенты с CОVID-19 и инсультом моложе пациентов с инсультом без коронавирусной инфекции и реже страдают гипертонией или имеют инсульт в анамнезе. У пациентов с CОVID-19 чаще регистрируется ишемический инсульт из-за окклюзии крупных сосудов. Тяжесть инсульта у них выше: медианная разница по шкале NIHSS – 5 баллов. Несмотря на лечение острого инсульта, внутривенный тромболизис и эндоваскулярную тромбэктомию, у больных COVID-19 и инсультом более высокая внутрибольничная летальность.
Таким образом, метаанализ дает основание утверждать, что пациенты с COVID-19 и инсультом по сравнению с пациентами с инсультом без коронавирусной инфекции моложе, инсульт у них более тяжелый, причем чаще обусловлен окклюзией крупных артерий и вовлечением нескольких бассейнов.
Механизмы цереброваскулярных проявлений у лиц с CОVID-19, вероятно, многофакторны. Они могут быть связаны с обычными механизмами инсульта, а CОVID-19 действует как спусковой крючок. В то же время они могут быть напрямую вызваны инфекцией SARS-CoV-2 через определенные патоморфологические механизмы, приводящие как к ишемическому, так и геморрагическому инсульту.
В 2020 г. в журнале «Молекулярная нейробиология» был опубликован анализ основных молекулярных механизмов, объединяющих CОVID-19 и инсульт. Речь идет о нарушении функции ренин-ангиотензиновой системы (РАС) и повышенной экспрессии хемокинов и цитокинов при CОVID-19.
Установлено, что S-белок шипов вируса отвечает за прикрепление к клетке-хозяину. Вследствие высокого сродства S-белка с АПФ2 рецепторы АПФ2 становятся мишенью для SARS-CoV-2, который связывается с рецепторами АПФ2 в эпителиальных и гладкомышечных клетках дыхательного тракта, сосудов, почек, пищевода, кишечника, мочевого пузыря, центральной нервной системы. Вирус проникает в клетку и размножается, повреждая при этом ткани сосудистой стенки и приводя к дестабилизации бляшек6.
Активация гиперкоагуляции с повышенным содержанием D-димера и фибриногена свойственна многим пациентам с тяжелой инфекцией CОVID-19. Эта коагулопатия, называемая sepsis induced coagulopathy, связана с вызванной инфекцией системной воспалительной реакцией и может способствовать повышенному риску тромбоза и инсульта. Гиперкоагуляция может привести к ишемическому инсульту, способствовать развитию венозной тромбоэмболии и парадоксальной эмболии. Это объясняет развитие инсульта в результате окклюзии крупных сосудов у молодых людей без факторов риска сосудистых заболеваний.
Прямая вирусная инвазия эндотелиальных клеток приводит к воспалению, которое рассматривается в качестве одного из субстратов для тромботических осложнений при CОVID-19. Кроме того, связывание SARS-CoV-2 с рецептором АПФ2 вызывает истощение его доступности. В случае, когда ангиотензин II (АTII) больше не уравновешивается АТ1–7, усиливается дисфункция эндотелия в таких органах, как сердце и мозг. Это может привести к симпатической активности, потере ауторегуляции давления и сужению сосудов с последующей ишемией органов.
К повреждению мозга при COVID-19 также причастна непрерывная и неконтролируемая активация иммунной системы, вызванная вирусной инфекцией, с последующим чрезмерным высвобождением цитокинов (цитокиновый шторм). Цитокиновый шторм может способствовать развитию протромботического состояния, активировать экспрессию активного тромбопластина с дальнейшей активацией перехода протромбина в тромбин и развитием гиперкоагуляции. Как следствие – развитие синдрома диссеминированного внутрисосудистого свертывания и множественных микротромбозов. Одновременно у ряда больных нарастает активация плазминогена, повышается риск кровоизлияния. Кроме того, выброс цитокинов повышает проницаемость гематоэнцефалического барьера. В результате вирус, проникая в нейроны и эндотелиальные внутрицеребральные клетки, вызывает их апоптоз. Наконец, цитокиновый шторм ведет к повреждению эндотелия и повышает риск разрыва бляшек и последующего атеротромбоза.
В работе L. Chia-Te и соавт. (2021)7 было сделано заключение, что COVID-19, связанный с высокой воспалительной нагрузкой с высвобождением цитокинов, может вызвать воспаление сосудов, острое повреждение миокарда, миокардит, аритмию, венозную тромбоэмболию, метаболический синдром и болезнь Кавасаки.
Важно, что некоторые пациенты с CОVID-19 предрасположены к цереброваскулярным повреждениям из-за гипоперфузии головного мозга и гипоксемии. Например, у пациентов с внутричерепным стенозом в анамнезе гипоксемия способна привести к инфаркту из-за несоответствия между поставкой и потреблением кислорода.
По оценкам, геморрагический инсульт при CОVID-19 регистрируется реже, чем ишемический. Большинство авторов сходятся во мнении, что некоторые механизмы, опосредующие повышенный риск ишемического инсульта у пациентов с коронавирусной инфекцией, задействованы в стимулировании внутримозгового кровоизлияния. Подавление РАС может привести к повышению АД и риску геморрагического инсульта у пациентов с уже диагностированной гипертензией. В такой ситуации риску особенно подвержены пожилые люди с возрастным дефицитом АПФ2.
Инфекция SARS-CoV-2 может быть обусловлена коагулопатией потребления вследствие истощения фибриногена. В результате повышается риск внутричерепного кровоизлияния. Немаловажно, что у пациентов с тяжелой формой CОVID-19 и неврологическими осложнениями имеют место периваскулярные церебральные микрокровоизлияния. Их расположение в мозолистом теле, подкорке и глубоком белом веществе аналогично анатомическому распределению, наблюдаемому у пациентов с гипоксической дыхательной недостаточностью и сепсисом, что предполагает потенциальную роль церебральной гипоксии в повреждении головного мозга при тяжелой форме CОVID-19.
На основании систематического обзора и метаанализов сделан вывод, что у пациентов с COVID-19 существенно возрастает риск развития инсульта. Не случайно статья американских авторов называется «CОVID-19 является независимым фактором риска для острого ишемического инсульта»8.
Систематический обзор индийских специалистов, включавший 30 актуальных статей о 115 пациентах с острым или подострым инсультом и COVID-19, продемонстрировал высокую частоту окклюзии крупных сосудов – 46,9% пациентов всех возрастных групп, даже в отсутствие фактора риска или сопутствующих заболеваний9. Летальность у пациентов с COVID-19 и инсультом достигла 47,9%. Ученые пришли к выводу, что пожилой возраст, наличие сопутствующих заболеваний и тяжесть респираторных симптомов ассоциируются с чрезвычайно высокой смертностью.
Установлено, что вирус SARS-CoV-2 может проникать в центральную нервную систему гематогенным или нейрональным путем, через мозговой кровоток после системного распространения кровообращения. Кроме того, вирус способен проникать в мозг через центральный или периферический нерв, особенно через ретроградно-аксональный транспорт из обонятельной луковицы. Развитие цереброваскулярных нарушений потенциально связано с прямым воздействием собственно вирусной инфекции.
В исследовании M. Taquet и соавт.10 проанализированы шестимесячные психиатрические исходы у 237 тыс. пациентов, перенесших CОVID-19. Сравнительная оценка с когортами пациентов, перенесших грипп или другие респираторные инфекции, показала, что большинство диагностических категорий, включая инсульт, внутричерепное кровоизлияние, деменцию и психотические расстройства, получило распространение после COVID-19 (соотношение рисков от 1 до 5,28). Тяжесть коронавирусной инфекции оказала существенное влияние на последующие неврологические диагнозы. Причем частота этих диагнозов увеличивалась даже в случаях, когда COVID-19 не требовал госпитализации.
Таким образом, можно констатировать, что:
- CОVID-19 – независимый фактор риска острого ишемического инсульта;
- частота инсультов у пациентов с инфекцией CОVID-19 значительно выше, чем у пациентов без инфекции;
- у пациентов с тяжелой формой CОVID-19 частота ССЗ в три раза выше, чем у пациентов с легким и умеренным заболеванием;
- инфекция CОVID-19 связана с повышенной заболеваемостью ССЗ и смертностью.
Главной целью реабилитации пациентов, перенесших COVID-19, является их возвращение к активной жизни. Ключевым принципом реабилитации больных коронавирусной инфекцией считается персонализированный и комплексный подход к разработке реабилитационной программы.
К наиболее частым симптомам поражения головного мозга как в острой, так и в хронической стадии относятся двигательные нарушения. В острой стадии они выявляются у 70–90% пациентов, спустя год − не менее чем у половины выживших больных.
Испанские авторы отмечают, что гемипарез присутствует у 88% пациентов с инсультом. Через шесть месяцев после инсульта только у 38% пациентов восстанавливается подвижность руки. Полное выздоровление после традиционной реабилитационной терапии отмечается в 12% случаев11.
Для повышения общей эффективности реабилитации двигательных и речевых функций целесообразно в реабилитационную программу включать нейропротективную терапию Цераксоном. Активным веществом препарата является цитиколин – незаменимый предшественник фосфатидилхолина (лецитина), который считается основным компонентом всех клеточных мембран.
Цераксон характеризуется широким спектром действия. Активируя биосинтез фосфолипидов, он способствует восстановлению поврежденных мембран клеток, а также поддерживает нормальные уровни кардиолипина (основного компонента митохондриальных мембран) и сфингомиелина, участвует в синтезе ацетилхолина, оказывает антиоксидантный эффект, нормализует энергообмен в клетках, активирует энергетические процессы в нейронах, нормализует процессы тканевого дыхания и ингибирует глутамат-индуцированный апоптоз.
Нейрорегенераторные эффекты Цераксона подтверждены результатами ряда исследований12, 13. Доказано, что Цераксон:
- усиливает постишемический нейрогенез;
- увеличивает многокомпонентность дендритов, плотность шипиков нейронов;
- усиливает ангиогенез в периинфарктной зоне;
- увеличивает экспрессию рERK1/2 и IRS-1 – ключевых сигнальных белков, играющих важную роль в ангиогенезе и выживаемости эндотелиальных клеток.
Процесс восстановления нервной ткани требует времени. Не случайно рекомендуемый курс приема препарата Цераксон – два месяца и более. Препарат выпускается в виде раствора для внутривенного и внутримышечного введения в дозах 500 мг/4 мл и 1000 мг/4 мл, в виде раствора для приема внутрь 100 мг/мл во флаконе и раствора для приема внутрь 100 мг/мл в саше, что делает его удобным в применении.
По словам докладчика, в стационаре пациентам проводят терапию Цераксоном в виде раствора для внутривенного или внутримышечного введения, после выписки назначают препарат per os, чтобы потенцировать процессы восстановления.
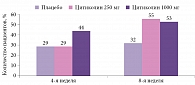
Эффективность цитиколина в коррекции постинсультного гемипареза оценивали в двойном слепом плацебоконтролируемом исследовании14. 165 пациентов были рандомизированы на три группы: группу цитиколина 250 мг/сут, группу цитиколина 1000 мг/сут и группу плацебо. Лечение проводилось в течение восьми недель. Цитиколин показал эффективность в обеих дозах, но более быстрый и выраженный эффект в улучшении двигательных функций конечностей отмечался в группе цитиколина 1000 мг/сут. Исследователи сделали вывод, что цитиколин эффективен в восстановлении двигательных функций при гемипарезе в качестве дополнения к стандартным реабилитационным мероприятиям. Рекомендованная суточная доза – 1000 мг. Период терапии – 4–8 недель (рис. 6).
В японском исследовании эффективности Цераксона (цитиколина) 1000 мг/сут в коррекции постинсультного гемипареза участвовали 258 пациентов с перенесенным ишемическим инсультом, проходившие реабилитацию15. Отмечалась хорошая эффективность Цераксона 1000 мг/сут в восстановлении двигательных функций при наличии гемипареза.
На фоне терапии Цераксоном восстановление в руках протекает более выраженно, чем в ногах. Это может быть связано с анатомическими особенностями представительства рук и ног в моторной коре.
В открытом контролируемом исследовании Е.В. Костенко и соавт. участвовали 110 пациентов в раннем восстановительном периоде с постинcультными двигательными нарушениями нижних конечностей16. Пациентов разделили на две группы – основную (n = 72) и контрольную (n = 38). В обеих группах проводились реабилитационная программа и вторичная профилактика инсульта. Помимо этого пациенты основной группы получали Цераксон 1000 мг/сут в течение десяти дней, далее – Цераксон 2000 мг/сут (саше) в течение шести недель.
На фоне применения Цераксона уменьшалась степень пареза в конечностях, о чем свидетельствовало статистически значимое увеличение мышечной силы в нижней конечности уже через восемь недель комплексной терапии у пациентов основной группы. Кроме того, к восьмой неделе в основной группе отмечалось улучшение по индексу ходьбы на 47% от исходного (в контрольной группе – 39%) (рис. 7).
У пациентов, принимавших Цераксон, уменьшалась выраженность затруднений при ходьбе с использованием вспомогательных средств. К восьмой неделе лечения в группе Цераксона время прохождения дистанции с привычной и максимальной скоростью ходьбы достоверно сократилось на 26%, в группе контроля – лишь на 10%. Через 12 недель, уже после отмены Цераксона, разница между группами стала более заметной.
В заключение профессор Л.Л. Корсунская перечислила основные преимущества препарата Цераксон:
- наличие одной из самых солидных доказательных баз среди нейропротекторов;
- высокая эффективность при остром ишемическом инсульте, черепно-мозговой травме;
- хороший профиль безопасности;
- удобство применения;
- возможность длительного приема.
Заключение
Подводя итог, профессор Н.А. Шамалов отметил большую значимость затронутых вопросов. Сегодня уже не вызывает сомнения тот факт, что COVID-19 повышает риск развития и прогрессирования сосудистых заболеваний головного мозга. Медикаментозная терапия считается составной частью комплексного лечения и реабилитации пациентов с сосудистыми заболеваниями головного мозга на фоне и после коронавирусной инфекции. Представленные экспертами результаты исследований показывают, что применение современных нейроцитопротекторов Актовегина и Цераксона в комплексе лечебных и реабилитационных программ – важное условие улучшения функционирования и повышения качества жизни пациентов.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.