Значение гексапептида в комплексной терапии женщин с бесплодием на фоне хронического эндометрита
- Аннотация
- Статья
- Ссылки
- English
Цель исследования – оценить клиническую эффективность гексапептида (препарата Имунофан®, Россия) в комплексной терапии пациенток с хроническим эндометритом.
Материал и методы. Обследовано и пролечено 62 пациентки с хроническим эндометритом на фоне бактериально-вирусных инфекций.
Микробиоценоз исследовали с помощью метода полимеразной цепной реакции (ПЦР) в режиме реального времени с использованием теста Фемофлор-16. С помощью ПЦР также выявляли наличие вируса простого герпеса 2-го типа и вируса папилломы человека. Исследование интерферонового локального иммунного статуса (сывороточный интерферон (ИФН), спонтанный ИФН-α, индуцированный ИФН-α, спонтанный ИФН-γ, индуцированный ИФН-γ/ИФН-α, ИФН-g) проводили в цельной литий-гепариновой крови методом иммуноферментного анализа (ИФА) с использованием тест-систем гамма-Интерферон-ИФА-БЕСТ (А-8752) и альфа-Интерферон-ИФА-БЕСТ (А-8758) (АО «Вектор-Бест», Россия) до лечения и через 15 + 3 дня после лечения. Кроме того, проводили иммуногистохимическое исследование экспрессии синдекана 1 (CD138), CD4, CD8 – из парафиновых блоков, взятых из биопсийного материала эндометрия (пайпель-биопсии). Инструментальное исследование включало ультразвуковое исследование органов малого таза с анализом состояния эндометрия до лечения, через 15, 30 и 60 дней после лечения.
Пациентки были разделены на две группы. Первая, основная группа (n = 31) получала антибактериальный препарат миноциклина (Минолексин®) в дозе 100 мг два раза в день в течение десяти дней и препарат гексапептида (Имунофан®) в дозе 1,0 мл (45 мкг/мл) внутримышечно ежедневно в течение десяти дней. Вторая группа – группа контроля (n = 31) – получала антибактериальный препарат миноциклина (Минолексин®) в дозе 100 мг два раза в день в течение десяти дней.
Результаты. Включение в терапию хронических бактериально-вирусных эндометритов иммуномодулирующего препарата гексапептида (Имунофана) для внутримышечного введения по 1,0 мл ежедневно № 10 увеличивало экспрессию ИФН, что способствовало повышению эффективности лечения хронического эндометрита на 29,0% и снижению частоты его рецидивов на 22,5%.
Выводы. У пациенток с хроническими бактериально-вирусными эндометритами в комплексную антибактериальную терапию целесообразно включать иммуномодулирующий препарат гексапептида (Имунофан®), который вводится внутримышечно по 1,0 мл (45 мкг/мл) ежедневно в течение десяти дней.
Цель исследования – оценить клиническую эффективность гексапептида (препарата Имунофан®, Россия) в комплексной терапии пациенток с хроническим эндометритом.
Материал и методы. Обследовано и пролечено 62 пациентки с хроническим эндометритом на фоне бактериально-вирусных инфекций.
Микробиоценоз исследовали с помощью метода полимеразной цепной реакции (ПЦР) в режиме реального времени с использованием теста Фемофлор-16. С помощью ПЦР также выявляли наличие вируса простого герпеса 2-го типа и вируса папилломы человека. Исследование интерферонового локального иммунного статуса (сывороточный интерферон (ИФН), спонтанный ИФН-α, индуцированный ИФН-α, спонтанный ИФН-γ, индуцированный ИФН-γ/ИФН-α, ИФН-g) проводили в цельной литий-гепариновой крови методом иммуноферментного анализа (ИФА) с использованием тест-систем гамма-Интерферон-ИФА-БЕСТ (А-8752) и альфа-Интерферон-ИФА-БЕСТ (А-8758) (АО «Вектор-Бест», Россия) до лечения и через 15 + 3 дня после лечения. Кроме того, проводили иммуногистохимическое исследование экспрессии синдекана 1 (CD138), CD4, CD8 – из парафиновых блоков, взятых из биопсийного материала эндометрия (пайпель-биопсии). Инструментальное исследование включало ультразвуковое исследование органов малого таза с анализом состояния эндометрия до лечения, через 15, 30 и 60 дней после лечения.
Пациентки были разделены на две группы. Первая, основная группа (n = 31) получала антибактериальный препарат миноциклина (Минолексин®) в дозе 100 мг два раза в день в течение десяти дней и препарат гексапептида (Имунофан®) в дозе 1,0 мл (45 мкг/мл) внутримышечно ежедневно в течение десяти дней. Вторая группа – группа контроля (n = 31) – получала антибактериальный препарат миноциклина (Минолексин®) в дозе 100 мг два раза в день в течение десяти дней.
Результаты. Включение в терапию хронических бактериально-вирусных эндометритов иммуномодулирующего препарата гексапептида (Имунофана) для внутримышечного введения по 1,0 мл ежедневно № 10 увеличивало экспрессию ИФН, что способствовало повышению эффективности лечения хронического эндометрита на 29,0% и снижению частоты его рецидивов на 22,5%.
Выводы. У пациенток с хроническими бактериально-вирусными эндометритами в комплексную антибактериальную терапию целесообразно включать иммуномодулирующий препарат гексапептида (Имунофан®), который вводится внутримышечно по 1,0 мл (45 мкг/мл) ежедневно в течение десяти дней.
Введение
Хронический эндометрит (ХЭ) является результатом изменения иммунной системы эндометрия вследствие бактериальной инфекции [1, 2]. Согласно данным разных авторов, частота рецидивов ХЭ колеблется от 49 до 57%, а при сочетании с другими гинекологическими заболеваниями может достигать 80% [3].
Хронический эндометрит занимает лидирующее место среди эндометриальных дисфункций и наблюдается у абсолютного большинства пациенток гинекологического профиля.
При восходящем пути инфицирования нарушается рецептивность к наиболее репродуктивно значимым гормонам в эндометрии и, как следствие, фертильность [4, 5]. При самопроизвольном выкидыше частота встречаемости ХЭ достигает 90,0%, при неразвивающейся беременности – 91,7%, при бесплодии – 50,0–65,0%, при несостоятельных попытках экстракорпорального оплодотворения – 57,0–83,3% [6, 7].
У женщин молодого репродуктивного возраста длительность течения ХЭ с этиологически подтвержденным бактериально-вирусным компонентом вызывает проблемы с репродукцией, что придает не только медико-социальную, но и демографическую значимость заболеванию [8].
В условиях интегрального эффекта бактериально-вирусных ассоциаций возникает проблема с эффективностью лечения ХЭ, которая варьируется от 33 до 75%. Недостаточная эффективность терапии обусловлена развитием резистентности микроорганизмов, прежде всего на фоне злоупотребления антибиотиками, что ассоциируется с селекцией резидентной флоры, чрезвычайной сложностью проникновения антибиотиков к возбудителю через сформированные последним биопленки, способствующие субклинической колонизации полости матки [9, 10].
Патогенетически эндометриальные дисфункции, возникающие на фоне ХЭ, сопровождаются снижением уровня гликогена в железистых клетках, нарушением эндометриальной экспрессии α- и β-интегринов, ангиопоэтина в строме [11]. В эндометрии повышаются продукция простагландина E2, металлопротеиназ 2, 3 и 9, хемокинов, количество и активность естественных киллеров, нарушаются регуляция генов секреторной трансформации, соотношение рецепторов эстрадиола и прогестерона, формируется резистентность к рецептору прогестерона на фоне активации экспрессии провоспалительных генов, IGJ, IGLL1, CXCL13, CD27, CXCL9, ICOS и KLRC1, что сопровождается цитокиновым штормом, опасным для иммунокомпетентных клеток, и диктует необходимость коррекции [12]. В то же время иммунный ответ на бактериально-вирусную агрессию может оказаться неадекватно низким и требовать поддержки в виде иммуномодуляции [13].
Участие в формировании эндометриального биотопа вирусных инфекций наряду с бактериальными инфекциями на фоне иммунных дисфункций предопределило изменение подходов к стандартной антибактериальной терапии. Таковое предполагает включение в комплексную терапию иммуномодулирующих препаратов для коррекции иммунного гомеостаза и, как следствие, повышения эффективности лечения ХЭ [14].
Целью настоящего исследования стала оценка клинической эффективности иммуномодулирующего препарата гексапептида (Имунофан®, Россия) в комплексной терапии пациенток с ХЭ.
Выбор препарата для проведения исследования был основан на уникальности инновационного отечественного иммуномодулирующего гексапептида (аргинил-α-аспартил-лизил-валил-тирозил-аргинин) с доказанной клинической эффективностью при различных патологиях, но недостаточно изученной эффективностью при ХЭ. Гексапептид (препарат Имунофан®) обладает иммунорегулирующим, детоксикационным и гепатопротекторным воздействием. Он вызывает инактивацию свободнорадикальных и перекисных соединений. Фармакологические свойства пептидного иммуноксидредуктанта основаны на коррекции иммунной и окислительно-антиокислительной систем и ингибировании множественной лекарственной устойчивости, опосредованной белками трансмембранного транспортного насоса клетки [15].
Материал и методы
Многоцентровое наблюдательное проспективное клиническое исследование в параллельных группах проведено на базе кафедры акушерства и гинекологии Института хирургии Российского национального исследовательского медицинского университета им. Н.И. Пирогова, в московской клинике репродуктивных технологий «План Б», а также на базе амбулаторно-поликлинического отделения Екатеринбургского клинического перинатального центра.
Обследовано и пролечено 62 пациентки репродуктивного возраста (18–35 лет) с ХЭ.
Обследование перед назначением терапии включало сбор анамнеза, данных о течении заболевания, общеклиническое исследование, микроскопическое исследование мазков из влагалища и цервикального канала, определение наличия вируса простого герпеса 2-го типа (ВПГ-2) и вируса папилломы человека (ВПЧ) с помощью полимеразной цепной реакции (ПЦР) в режиме реального времени, посев микрофлоры с эндометрия, определение наличия ВПЧ, хламидийной и микоплазменной инфекций с помощью ПЦР, патоморфологическое исследование биоптатов из эндометрия. Кроме того, был оценен интерфероновый статус до лечения и через 15 + 3 дня после лечения. Изучение интерферонового локального иммунного статуса (уровень сывороточного интерферона (ИФН), спонтанного ИФН-α, индуцированного ИФН-α, спонтанного ИФН-γ, индуцированного ИФН-γ/ИФН-α, ИФН-g) проводилось в цельной литий-гепариновой крови пациенток методом иммуноферментного анализа (ИФА) с использованием тест-систем гамма-Интерферон-ИФА-БЕСТ (А-8752) и альфа-Интерферон-ИФА-БЕСТ (А-8758) (АО «Вектор-Бест», Россия). Иммуногистохимическое исследование экспрессии синдекана 1 (CD138), CD4, CD8 – из парафиновых блоков, взятых из биопсийного материала эндометрия (пайпель-биопсии), взятого во второй фазе менструального цикла (на 17–20-й дни), также проводилось до лечения и через 15 + 3 дня по его окончании. Инструментальное исследование предполагало проведение ультразвукового исследования (УЗИ) органов малого таза с анализом состояния эндометрия до лечения, а также через 15, 30 и 60 дней после лечения. Лабораторные исследования осуществлялись централизованно в лаборатории СИТИЛАБ и в лаборатории кафедры молекулярной фармакологии и радиобиологии им. академика П.В. Сергеева Российского национального исследовательского медицинского университета им. Н.И. Пирогова.
Пациентки были включены в исследование в соответствии с критериями включения и исключения. Распределение по группам для назначения терапии проводилось методом случайной выборки.
Критерии включения в первую, основную группу:
- патоморфологически верифицированный ХЭ;
- УЗИ-признаки ХЭ;
- длительность ХЭ от одного до трех месяцев;
- отсутствие терапии до отбора в исследование;
- возраст от 18 до 35 лет;
- рост и вес без ограничений;
- раса, национальность, профессия и регион без ограничений;
- подписанное информированное согласие на участие в исследовании.
Критерии исключения:
- возраст менее 18 лет и более 35 лет;
- период беременности;
- период лактации;
- наличие тяжелой экстрагенитальной и гинекологической патологии;
- отказ от подписания информированного согласия.
В первую (основную) группу вошла 31 пациентка. С первого дня после установления диагноза «хронический эндометрит» пациенткам была назначена стандартная антибактериальная терапия препаратом миноциклина (Минолексин®) в дозе 100 мг два раза в день утром и вечером независимо от приема пищи в течение десяти дней и иммуномодулирующий препарат гексапептида (Имунофан®) в дозе 1,0 мл (45 мкг/мл), который вводился внутримышечно в течение десяти дней.
Во вторую (контрольную) группу также вошла 31 пациентка с диагнозом «хронический эндометрит», получавшая стандартную антибактериальную терапию препаратом миноциклина (Минолексин®) в дозе 100 мг два раза в день утром и вечером независимо от приема пищи в течение десяти дней, что, согласно клиническим рекомендациям, является стандартной терапией [16].
Для оценки эффективности лечения на 30-й день от его начала проведены лабораторные (исследование цитокинового профиля) и инструментальные (УЗИ органов малого таза с анализом состояния эндометрия) исследования.
Статистическую обработку данных проводили с помощью программного пакета SPSS Statistics v. 20.0. Для описания количественных данных, имевших нормальное распределение, применяли N, M ± m, P ± mр, где N – число наблюдений, М – среднее арифметическое, m – стандартная ошибка среднего арифметического (ошибка репрезентативности), Р – относительный показатель (%), mр – ошибка репрезентативности относительного показателя, ДИ – доверительный интервал. Достоверность различий проверялась с помощью критерия χ2 Пирсона с поправкой Йейтса (для количественных признаков, непараметрических данных). Критический уровень значимости при проверке статистических гипотез в данном исследовании принимался как p < 0,05. Учитывались корреляционные отношения признаков, соответствующие только средней (0,7 ≥ r ≥ 0,5) и высокой (r ≥ 0,7) степеням связи при p ≤ 0,05–0,00.
Результаты и их обсуждение
Пациентки обеих групп были сопоставимы по возрасту и паритету. Средний возраст всех обследованных женщин составил 32,0 ± 3,9 года. Группы не различались и по характеру жалоб, акушерскому анамнезу, экстрагенитальной и гинекологической патологии.
Среди жалоб чаще отмечались тянущие боли внизу живота – у 18 пациенток первой группы (58,6 ± 6,7% (95% ДИ 51,4–75,3)) и у 19 пациенток второй группы (61,2 ± 6,9% (95% ДИ 42,4–72,3)), при этом разница оказалась статистически недостоверной (р = 0,734 при χ2 = 1,436). Нарушения менструального цикла имели место у 8 (25,8 ± 2,7%) и 7 (22,5 ± 2,1%) женщин первой и второй групп соответственно. Патологические выделения наблюдались у 15 (48,4 ± 3,8%) и 16 (51,6 ± 4,9%) пациенток соответственно. Межгрупповые различия показателей были незначимыми (р = 0,913). Следует отметить, что клинические проявления нарушения вагинального и цервикального микробиоценоза при осмотре в зеркалах были представлены патологическими выделениями из цервикального канала и гиперемией цервикального и вагинального эпителия и обнаружены у большинства обследованных – 26 (83,8 ± 7,9%) и 25 (80,6 ± 7,7%) в первой и второй группах соответственно (р = 0,892), что свидетельствовало о вовлечении цервикального канала и влагалища в воспалительный процесс и согласуется с результатами ряда исследований [17].
Анализ результатов молекулярно-биологического исследования цервико-вагинальной жидкости у обследованных пациенток показал наличие дисбиотических нарушений. Так, у 19 (61,3 ± 5,8%) и 20 (64,5 ± 6,2%) женщин в первой и второй группах имел место смешанный аэробно-анаэробный дисбиоз. При этом Gardnerella vaginalis чаще выявлялась в ассоциации с Clostridium и с такими представителями аэробных бактерий, как Enterobacteriасeae spp., Escherichia coli, Staphylococcus spp., Streptococcus spp., Firmicutes и Bacteroidetes.
Молекулярно-биологическое исследование микробиоценоза эндометрия также продемонстрировало доминирование смешанной аэробно-анаэробной флоры, при этом корреляционные связи между микробиотой эндометрия и влагалища обнаружены в отношении аэробной флоры (r = +0,65 при р = 0,003). Гонококковая инфекция не выявлена. Хламидийная инфекция обнаружена у 23 (74,2 ± 6,8%) и 24 (77,4 ± 7,2%) пациенток первой и второй групп соответственно (р = 0,913).
В анамнезе ВПЧ-инфекции имели место у 52 (83,8 ± 7,2%) обследованных женщин, по 26 пациенток в каждой группе. Следует отметить, что ВПЧ обнаружен в эндометрии у всех участниц исследования, что согласуется с данными Т.П. Зефировой и соавт. (2024 г.) и свидетельствует о папилломавирусной контаминации эндометрия у пациенток с ВПЧ-ассоциированными заболеваниями [18]. У 13 (41,9 ± 4,2%) и 12 (38,7 ± 3,5%) больных первой и второй групп соответственно в эндометрии выявлен ВПГ-2, что демонстрировало интегральный эффект вирусных инфекций в эндометрии. На фоне усиления периваскулярных склеротических изменений, фиброза стромы при вирусных инфекциях, согласно результатам ряда исследований, коррекция иммунного гомеостаза становится важнейшей для превенции последствий [19].
Выявленная конкордантность между микробиотой полости матки и цервико-вагинальным микробиоценозом по большинству микробных агентов составила от 62 до 75%, что согласуется с результатами отечественных исследований [19].
Изучение иммунологического статуса пациенток позволило выявить изменение в сторону иммуносупрессии, которое определялось низким уровнем CD4+ T-клеток и повышенным уровнем цитотоксических лимфоцитов CD8+ со сниженным соотношением CD4+/CD8+. Таковое обнаружено у 28 (90,3 ± 8,7%) и 28 (90,3 ± 8,7%) пациенток первой и второй групп соответственно (р = 0,923). Маркер ХЭ, признанный золотым стандартом диагностики заболевания, обнаружен у 100% пациенток.
При анализе показателей интерферонового иммунного статуса (ИФН-α, ИНФ-γ) установлено значительное его снижение [20], что подтверждало наличие иммунодефицита на локальном уровне.
При проведении УЗИ у большинства женщин выявлен синдром тонкого эндометрия. Таковой имел место у 22 (70,9 ± 7,2%) и 21 (67,7 ± 6,4%) пациентки в первой и второй группах соответственно (р = 0,821 при χ2 = 2,135). При этом у всех обследованных эндометрий был неоднородной эхогенности и с неровным контуром.
После проведенной терапии по результатам лабораторного и инструментального обследований наблюдалась значительная положительная динамика клинических признаков ХЭ. Кроме того, снизилась частота предъявляемых жалоб.
Так, на контрольном визите через 15 + 3 дня жалобы и побочные явления терапии отсутствовали у абсолютного большинства участниц исследования – у 30 (96,7 ± 8,4% (95% ДИ 61,4–98,3)) и 20 (64,5 ± 5,9% (95% ДИ 52,3–84,2)) в первой и второй группах соответственно, однако со значительными межгрупповыми различиями (р = 0,003 при χ2 = 10,281). У 11 (35,4 ± 8,4%) пациенток второй группы, у которых жалобы сохранялись, отмечено значительное снижение интенсивности тянущей боли внизу живота, которая, однако, периодически появлялась при физической нагрузке, что могло свидетельствовать о недостаточности антибактериальной терапии при ХЭ, обусловленном вирусно-бактериальными ассоциациями.
При молекулярно-биологическом исследовании цервико-вагинального содержимого обнаружено значительное снижение условно патогенной микрофлоры в обеих группах с незначительными межгупповыми различиями (р = 0,734). Однако при оценке вирусного статуса зафиксированы достоверные различия в наличии/отсутствии папилломавирусной и герпесвирусной инфекций. Так, в первой группе признаков ВПЧ-инфекции не выявлено. Однако во второй группе вновь были обнаружены ВПЧ и ВПГ-2 у 16 (51,6 ± 5,2%) и 12 (38,7 ± 3,7%) пациенток соответственно. Полученные результаты подтвердили эффективность иммуномодуляции при лечении смешанных бактериально-вирусных эндометритов.
Через 15 + 3 дня качественная детекция CD138 установлена лишь у 3 (6,45 ± 1,2%) пациенток первой группы. Во второй группе данный маркер выявлен у 12 (38,7 ± 3,1%) женщин (р = 0,001 при χ2 = 12,352).
Уровень цитотоксических Т-лимфоцитов (CD8) значимо изменился в обеих группах. В первой группе он снизился в 1,8 раза, во второй группе – в 1,4 раза (р = 0,03 при χ2 = 11,284). Следует отметить изменения и в уровне CD4 – маркера Т-лимфоцитов-хелперов. В первой группе он увеличился в 2,4 раза, во второй группе – в 1,5 раза, что оказалось статистически значимо (р = 0,004 при χ2 = 10,412). Таким образом, соотношение CD4+/CD8+ изменилось в сторону повышения, но в большей степени в первой группе, что свидетельствовало о значимом нормализующем влиянии гексапептида на локальный иммунный статус эндометрия.
При изучении интерферонового статуса у пациенток с ХЭ выявлено значительное снижение ИФН-продуцирующей способности лейкоцитов крови в сочетании с отсутствием циркулирующего в крови сывороточного ИФН, что отражало дефектность системы ИФН на фоне хронических вирусных заболеваний и могло рассматриваться как показание для назначения ИФН-стимулирующей терапии.
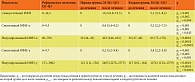
Определение интерферонового статуса до и после лечения Имунофаном было обосновано потенциальной возможностью препарата влиять на интегральную секрецию ИФН, учитывая повышение резистентности организма преимущественно к вирусам на фоне влияния гексапептида на иммунокомпетентные клетки врожденного иммунитета. При анализе показателей интерферонового иммунного статуса после лечения выявлено значительное его изменение, однако в первой группе в большей степени, чем во второй (таблица) [20].
При анализе изменений интерферонового статуса на фоне иммуномодуляции Имунофаном отмечено увеличение продукции как спонтанного, так и индуцированного ИФН-γ лейкоцитами крови более чем в два раза, что могло свидетельствовать о выраженном влиянии препарата на иммуногенез.
Согласно результатам УЗИ, проведенного после лечения, полноценный эндометрий (без признаков истощения, с ровными контурами) был выявлен у 28 (90,3 ± 8,6%) пациенток первой группы. Аналогичная УЗИ-картина эндометрия наблюдалась только у 19 (61,3 ± 5,9%) пациенток второй группы (р = 0,0001 при χ2 = 12,816). Следовательно, при включении в схему лечения Имунофана эффективность лечения повысилась на 29%.
На контрольном приеме через 60 дней рецидивирование ХЭ зафиксировано у 2 (6,5 ± 0,4%) женщин в первой группе и у 9 (29,0 ± 1,9%) во второй. Таким образом, частота рецидивов при применении иммуномодуляции в комплексной терапии ХЭ уменьшилась на 22,5%.
Выводы
У пациенток с хроническими бактериально-вирусными эндометритами в комплексную антибактериальную терапию целесообразно включать иммуномодулирующий препарат гексапептида (Имунофан®), применяемый по следующей схеме: внутримышечно по 1,0 мл (45 мкг/мл) ежедневно в течение десяти дней.
I.N. Kononova, MD, PhD, E.N. Kareva, MD, PhD, Prof., Yu.E. Dobrokhotova, MD, PhD, Prof., S.N. Lunina, PhD, T.A. Ogurtsova, M.R. Narimanova, PhD, E.V. Krasnoshchok, N.A. Kochina, PhD
N.I. Pirogov Russian National Research Medical University
Interregional Center for Continuing Professional Education
I.M. Sechenov First Moscow State Medical University
Yekaterinburg Clinical Perinatal Сenter
Contact person: Irina N. Kononova, irkonmed@mail.ru
The high incidence of chronic endometritis, accompanied by endometrial and immune dysfunctions with reproductive disorders, with low efficiency of antibacterial therapy, was a prerequisite for optimization of combination therapy.
Purpose of the study – to evaluate the clinical efficacy of the hexapeptide (of the drug Imunofan®, Russia) in combination therapy of patients with chronic endometritis.
Material and methods. 62 patients with chronic endometritis with bacterial and viral infections were examined and treated.
The study of the microbiocenosis was carried out by the PCR-RV method using the Femoflor-16 test, PCR for HSV II, HPV. The study of the local interferon immune status (serum IFN, spontaneous IFN-α, induced IFN-α, spontaneous IFN-γ, induced IFN-γ/IFN-α, IFN-g) was carried out by the ELISA method from whole lithium-heparin blood of patients using the gamma-Interferon-IFA-BEST (A-8752) and alpha-Interferon-IFA-BEST (A-8758) test systems (Vector-Best, Russia) before treatment and 15 + 3 days after treatment. Immunohistochemical study of the expression of syndecan 1 (CD138), CD4, CD8 – from paraffin blocks taken from endometrial biopsy material (pipelle biopsy). The instrumental examination included ultrasound examination of the pelvic organs with endometrial analysis before the examination and 15, 30 and 60 days after treatment.
The patients were divided into two groups. The group 1 (n = 31) received the antibacterial drug minocycline (Minolexin®) in a dose of 100 mg 2 times a day for 10 days and the hexapeptide (drug Imunofan®) in a dose of 1.0 (45 mcg/mL) intramuscularly daily for 10 days. The group 2, the control group (n = 31), received the antibacterial drug minocycline (Minolexin®) in a dose of 100 mg 2 times a day for 10 days.
Results. It was found that the inclusion of the immunomodulatory drug hexapeptide (Imunofan®) in the therapy of chronic bacterial-viral endometritis in the form of subcutaneous administration of 1.0 ml daily No. 10 increased the expression of IFN, which contributed to an increase in the clinical efficacy of chronic endometritis treatment by 29.0% and reduced the recurrence of the disease by 22.5%.
Conclusions. In patients with chronic bacterial-viral endometritis, it is advisable to include the immunomodulatory drug hexapeptide (Imunofan®) in the complex antibacterial therapy in the form of intramuscular injection of 1.0 (45 mcg/mL) daily for 10 days.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.