Таргетная иммуномодулирующая терапия в коррекции различных иммунофенотипов вторичного иммунодефицита у женщин с нетипично протекающими хроническими инфекционно-воспалительными заболеваниями генитального тракта
- Аннотация
- Статья
- Ссылки
- English
Цель – уточнить варианты патологических лабораторных иммунофенотипов вторичного иммунодефицита и оценить клинико-иммунологическую эффективность таргетной иммуномодулирующей терапии в комплексном лечении иммунокомпрометированных женщин с нпХИВЗГТ.
Материал и методы. Исследованы женщины в возрасте 20–40 лет с обострением нпХИВЗГТ: группа исследования (ГИ) до лечения (n = 222), получавшие традиционную терапию (ГИ ТТ, n = 22) и комплексное лечение – традиционная терапия + иммунотерапия фармпрепаратом Имунофан® (ГИ ТТ + ИТ, n = 200). Оценены Т- и В-лимфоциты, естественные киллерные клетки, фагоцитарная и микробицидная функции нейтрофильных гранулоцитов (НГ), уровни сывороточных IgA, IgM, IgG, ИФН-α, ИФН-γ, а также провоспалительных цитокинов.
Результаты. У женщин с нпХИВЗГТ, имеющих клинические критериальные признаки ВИД: основные – затяжное, часто рецидивирующее и вялотекущее течение заболеваний, дополнительные – наличие вирусных инфекционных проявлений (рецидивирующие герпесвирусные инфекции, рекуррентные ОРВИ, ВПЧ-инфекция), имеются изолированные (22%) и комбинированные (88%) ВИД. Выявлено пять лабораторных иммунофенотипов ВИД с доминированием дефектов функционирования НГ. В ГИ ТТ кратковременный позитивный клинический эффект не сопровождается восстановлением иммунной системы (ИС). В ГИ ТТ + ИТ отмечаются более быстрый регресс воспаления, чем в ГИ ТТ, и отсутствие рецидивов нпХИВЗГТ у 92,5% женщин через год наблюдения. Выраженный позитивный иммунологический эффект выявлен при ВИД с иммунофенотипами с повреждением одного или двух звеньев ИС, чаще Т-клеточного звена и функций НГ. При нарушении ИС в трех или четырех звеньях в ГИ ТТ + ИТ произошло неполное восстановление дефектов.
Заключение. Установленные позитивные клинико-иммунологические эффекты Имунофана на пяти лабораторных иммунофенотипах ВИД при нпХИВЗГТ подчеркивают мультивариантность его влияний. Для полного восстановления ИС необходимо дальнейшее проведение таргетной иммуномодулирующей терапии.
Цель – уточнить варианты патологических лабораторных иммунофенотипов вторичного иммунодефицита и оценить клинико-иммунологическую эффективность таргетной иммуномодулирующей терапии в комплексном лечении иммунокомпрометированных женщин с нпХИВЗГТ.
Материал и методы. Исследованы женщины в возрасте 20–40 лет с обострением нпХИВЗГТ: группа исследования (ГИ) до лечения (n = 222), получавшие традиционную терапию (ГИ ТТ, n = 22) и комплексное лечение – традиционная терапия + иммунотерапия фармпрепаратом Имунофан® (ГИ ТТ + ИТ, n = 200). Оценены Т- и В-лимфоциты, естественные киллерные клетки, фагоцитарная и микробицидная функции нейтрофильных гранулоцитов (НГ), уровни сывороточных IgA, IgM, IgG, ИФН-α, ИФН-γ, а также провоспалительных цитокинов.
Результаты. У женщин с нпХИВЗГТ, имеющих клинические критериальные признаки ВИД: основные – затяжное, часто рецидивирующее и вялотекущее течение заболеваний, дополнительные – наличие вирусных инфекционных проявлений (рецидивирующие герпесвирусные инфекции, рекуррентные ОРВИ, ВПЧ-инфекция), имеются изолированные (22%) и комбинированные (88%) ВИД. Выявлено пять лабораторных иммунофенотипов ВИД с доминированием дефектов функционирования НГ. В ГИ ТТ кратковременный позитивный клинический эффект не сопровождается восстановлением иммунной системы (ИС). В ГИ ТТ + ИТ отмечаются более быстрый регресс воспаления, чем в ГИ ТТ, и отсутствие рецидивов нпХИВЗГТ у 92,5% женщин через год наблюдения. Выраженный позитивный иммунологический эффект выявлен при ВИД с иммунофенотипами с повреждением одного или двух звеньев ИС, чаще Т-клеточного звена и функций НГ. При нарушении ИС в трех или четырех звеньях в ГИ ТТ + ИТ произошло неполное восстановление дефектов.
Заключение. Установленные позитивные клинико-иммунологические эффекты Имунофана на пяти лабораторных иммунофенотипах ВИД при нпХИВЗГТ подчеркивают мультивариантность его влияний. Для полного восстановления ИС необходимо дальнейшее проведение таргетной иммуномодулирующей терапии.

Болезни иммунной системы (ИС), приобретенные или вторичные иммунодефициты (ВИД), привлекают все большее внимание врачей и исследователей, поскольку частота их возникновения растет в геометрической прогрессии, особенно после того, как весь мир драматично пережил пандемию COVID-19. Дефектность функционирования различных механизмов противомикробной иммунной защиты обусловливает появление нетипично протекающих, не отвечающих на традиционную терапию инфекционно-воспалительных заболеваний различных органов и систем и негативно влияет на их течение. Кроме того, иногда при весьма схожих клинических проявлениях ВИД, ассоциированных с нетипично протекающими инфекционно-воспалительными заболеваниями, например с атипичной хронической активной герпесвирусной инфекцией (ГВИ), могут наблюдаться различные лабораторные патологические иммунофенотипы [1]. При этом выбор таргетной иммунотропной терапии, направленной на точечное восстановление дефектно функционирующих звеньев иммунной защиты при ВИД, должен быть ориентирован на патологический лабораторный иммунофенотип, выявленный при проведении иммунодиагностики, и, безусловно, учитывать все особенности клинических проявлений.
В настоящее время проблеме лечения и профилактики нетипично протекающих хронических инфекционно-воспалительных заболеваний генитального тракта (нпХИВЗГТ) у женщин уделяется значительное внимание в гинекологической практике. К нпХИВЗГТ относят спектр воспалительных заболеваний верхнего отдела репродуктивного тракта, которые могут быть представлены как одной формой (эндометрит, сальпингит, оофорит), так и различной комбинацией нозологий. Значимость данной проблемы очевидна ввиду того, что ХИВЗГТ ассоциированы с множеством негативных последствий для репродуктивного здоровья женщины: хроническая тазовая боль, спаечная болезнь органов малого таза, нарушение менструальной функции, гиперпластические процессы эндометрия, бесплодие, невынашивание беременности и др. [2–5].
Этиологическая структура ХИВЗГТ, по разным данным, сводится к следующему. Доминирующими патогенами (около в 85–89% случаев) являются Chlamydia trachomatis и Neisseria gonorrhoeae. Согласно последним данным, чаще стали встречаться бактериальные вагинозы, ассоциированные с анаэробными микроорганизмами (Bacteroides spp., Fusobacterium spp., Peptostreptococcus spp., Peptococcus spp., Prevotella spp., Mycoplasma hominis, Actinomyces israelii, Ureaplasma urealyticum, Trichomonas vaginalis, Enterococcus spp., Streptococcus spp., Staphylococcus spp.). Этиология ХИВЗГТ связана с колонизацией генитального тракта в 15% случаев кишечными (Campylobacter spp., Escherichia coli, Bacteroides fragilis) и респираторными (St. pneumoniae, стрептококки группы A и В, S. aureus, Haemophilus influenzae) бактериями [6–9]. Данные литературы относительно роли облигатного патогена Mycoplasma genitalium в этиологии ХИВЗГТ неоднозначны, хотя и отмечено увеличение в девять раз частоты обнаружения данного возбудителя при развитии воспаления в генитальном тракте [4]. В ряде многоцентровых исследований показано, что особенностью современной этиологической структуры ХИВЗГТ являются ассоциации микробных агентов на фоне дисбиотических нарушений влагалища [6, 10–12]. Высокая степень контаминации влагалища облигатной микрофлорой (аэробной и анаэробной), низкоиммуногенные свойства доминирующих условно-патогенных микроорганизмов, ускользающих из-под надзора иммунной системы, приводят к реализации их патогенности.
В то же время высокая частота неадекватного, зачастую бесконтрольного и многократного использования антибактериальных препаратов, помимо развития антибиотикорезистентности, способствует увеличению роли условно-патогенных микроорганизмов в патогенезе ХИВЗГТ, которые приобретают патогенные свойства при определенных условиях, в частности при снижении иммунорезистентности [13]. Вторичный (приобретенный) иммунодефицит – неотъемлемая часть патогенетических взаимоотношений при развитии и прогрессировании ХИВЗГТ, характеризующихся сложным и вариабельным комплексом иммунных реакций.
Вторичный иммунодефицит у женщин с нпХИВЗГТ характеризуется недостаточной эффективностью гуморального и клеточного иммунитета, снижением активности клеток фагоцитарной системы, цитокиновым дисбалансом. У женщин клинической особенностью течения нпХИВЗГТ, протекающих с ВИД, является то, что имеющийся симптомокомплекс не укладывается в типичную клиническую картину, что свидетельствует о нетипично протекающем воспалительном процессе в генитальном тракте, дисфункции ИС и, как следствие, о нарушении элиминации и длительной персистенции этиопатогенов [14].
У иммунокомпрометированных женщин стандартная терапия нпХИВЗГТ, проводимая в рамках клинических рекомендаций, оказывает временный положительный эффект и не предупреждает развитие последующих обострений. Для успешного, эффективного лечения иммунокомпрометированных женщин с нпХИВЗГТ необходимо выявление нарушений функционирования ИС с использованием иммунодиагностических тестов и на этой основе создание новых подходов к проведению иммуномодулирующей терапии в зависимости от вариантов выявленных дисфункций [15].
По нашему мнению, таргетное воздействие на ИС у иммунокомпрометированных женщин с нпХИВЗГТ, проводимое в составе комплексной терапии, позволит добиться позитивного иммунологического эффекта, что будет способствовать более быстрому купированию воспалительного процесса в генитальном тракте, более длительной клинической ремиссии заболевания и профилактике отдаленных неблагоприятных последствий.
Для проведения таргетной иммуномодулирующей терапии имеет значение выбор иммуномодулирующего препарата. В работах многих исследователей показано, что гексапептид (ГП) (Arginyl-alpha-Aspartyl-Lysyl-Valyl-Tyrosyl-Arginine) – синтетический аналог активного центра гормона тимуса тимопоэтина обладает плейотропным иммуномодулирующим воздействием. Фармпрепарат, основной действующей субстанцией которого является ГП, – Имунофан® способствует восстановлению Т-клеточного звена ИС, эффекторных функций нейтрофильных гранулоцитов (НГ) и регуляции цитокинового профиля у пациентов с различными инфекционно-воспалительными заболеваниями. Гексапептид повышает эффективность других лекарственных препаратов, тем самым снижая резистентность к противовоспалительной терапии [16, 17].
Цель исследования
Цель – уточнить варианты патологических лабораторных иммунофенотипов вторичного иммунодефицита и оценить клинико-иммунологическую эффективность таргетной иммуномодулирующей терапии в комплексном лечении иммунокомпрометированных женщин с нетипично протекающими хроническими инфекционно-воспалительными заболеваниями генитального тракта.
Материал и методы
Под нашим наблюдением находились 222 женщины репродуктивного возраста (от 20 до 40 лет) в период обострения нпХИВЗГТ, поступившие в отделение дневного стационара клиники ФГБОУ ВО КубГМУ Минздрава России.
Оценка клинического статуса включала сбор жалоб, анамнеза заболевания и жизни женщин, иммунологического анамнеза, оценку клинического течения нпХИВЗГТ с учетом объективного осмотра.
Группу исследования (ГИ) составили 222 женщины с нпХИВЗГТ в период обострения, имеющие клинические критерии иммунокомпрометированности [14] до лечения (ГИ до лечения).
Для оценки клинико-иммунологической эффективности проводимого комплексного лечения были сформированы группы в соответствии с терапевтической тактикой.
Группу исследования ГИ ТТ составили 22 иммунокомпрометированные женщины с нпХИВЗГТ в период обострения после лечения с использованием только традиционной терапии (ТТ).
Традиционная терапия включала антибактериальные препараты из группы цефалоспоринов третьего поколения (Цефтриаксон) в дозе 250 мг/сут внутримышечно курсом 14 дней, макролиды (Кларитромицин) в дозе 500 мг два раза в сутки, метронидазол в дозе 500 мг/сут в течение пяти дней, противогрибковые препараты (флуконазол) в дозе 150 мг на 1-й, 6-й и 9-й дни лечения, витамины группы В – тиамин в дозе 50 мг и пиридоксин в дозе 10 мг с чередованием через день внутримышечно в течение 14 дней, местная антисептическая терапия предполагала применение суппозиториев (хлоргексидин) в течение 14 дней.
Группу исследования ГИ ТТ + ИТ составили 200 иммунокомпрометированных женщин с нпХИВЗГТ в период обострения после комплексной терапии, включавшей традиционную терапию и иммунотерапию (ИТ) фармпрепаратом, основной действующей субстанцией которого является гексапептид. Схема приема – 45 мкг/мл (1 мл) внутримышечно один раз в сутки в течение десяти дней, курсовая доза – 450 мкг.
В группу сравнения (ГС) вошли 20 условно здоровых женщин репродуктивного возраста.
Тестирование иммунокомпрометированных женщин с нпХИВЗГТ проводилось до лечения (ГИ до лечения) и через два-три дня после лечения (ГИ ТТ и ГИ ТТ + ИТ).
Проведено комплексное исследование ИС. Методом проточной цитофлуориметрии с помощью цитофлуориметра FC 500 (компания Beckman Coulter, США) с соответствующими моноклональными антителами (Beckman Coulter International S.A., Франция) проведено иммунофенотипирование Т- и В-лимфоцитов (CD3+CD19-, CD3+CD4+, CD3+CD8+, CD3-CD19+), естественных киллерных клеток (ЕКК) (CD3-CD16+CD56+) в периферической крови (ПК), рассчитан иммунорегуляторный индекс (ИРИ) (CD3+CD4+/CD3+CD8+). Тестирование фагоцитарной и микробицидной функций НГ осуществлялось с определением количества активно фагоцитирующих S. aureus НГ (%ФАН) с оценкой захвата бактерий (фагоцитарное число (ФЧ), фагоцитарный индекс (ФИ)) и переваривающей активности (процент переваривания (%П), индекс переваривания (ИП)). NADPH-оксидазную активность НГ определяли по показателям NBT-теста спонтанного (сп.) и стимулированного (ст.) (S. aureus), при этом учитывались процент формазан-позитивных клеток (%ФПК) и средний цитохимический индекс (СЦИ). По соотношению %ФПКст./%ФПКсп. рассчитывался коэффициент мобилизации (КМ). Методом иммуноферментного анализа определяли уровень сывороточных иммуноглобулинов (Ig) (IgA, IgM и IgG) и интерферонов (ИФН) (ИФН-α и ИФН-γ), цитокинов (интерлейкинов (ИЛ), таких как ИЛ-1β, ИЛ-6, ИЛ-8, ИЛ-18, ИЛ-4, ИЛ-10, и фактора некроза опухоли α (ФНО-α)) (тест-системы ООО «Вектор-Бест», Россия).
Проводились молекулярно-биологические исследования отделяемого слизистых оболочек женских половых органов методом полимеразной цепной реакции (ПЦР): влагалищный мазок на инфекции, передаваемые половым путем (Chl. trachomatis, N. gonorrhoeae, M. genitalium), и Фемофлор 16, позволяющий качественно и количественно определить биоценоз влагалища, в частности нормальной и условно-патогенной микрофлоры.
Статистическую обработку данных осуществляли в компьютерных программах Microsoft Excel 2016 и StatPlus 2010. Использовали критерий Стьюдента для оценки клинических параметров (M ± m) и непараметрические статистические критерии Вилкоксона и Манна – Уитни для оценки иммунологических параметров (Me (Q1; Q3)). Статистически значимые различия определяли при p < 0,05.
Результаты и их обсуждение
Исследуемые женщины характеризовались длительным (более пяти лет) анамнезом нпХИВЗГТ, частыми обострениями (три и более раз в год) или вялотекущим затяжным течением обострений, отсутствием стойкого клинического эффекта при использовании традиционной системной и местной противовоспалительной терапии (таблица).
При сборе жалоб и объективном осмотре в период обострения у женщин с нпХИВЗГТ (ГИ до лечения) наблюдались чаще умеренные (63,0%), реже обильные (20,3%) выделения, болезненность внизу живота и диспареуния (45,0%), нерегулярный менструальный цикл (18,0%), отсутствие повышения температуры (100,0%). Следует отметить, что в 16,6% случаев обострение нпХИВЗГТ было обнаружено при проведении профилактического осмотра, что свидетельствует о вялотекущем, малосимптомном течении заболевания.
При изучении данных анамнеза у женщин ГИ до лечения были выявлены дополнительные критериальные признаки иммунокомпрометированности [18]: наличие в анамнезе микст-ГВИ (инфекции, вызванной вирусом простого герпеса (ВПГ) I и II типов, генитальной и орофациальной локализации с частотой обострений до пяти-шести раз в год) – 14,4% случаев, инфекции, вызванной вирусом папилломы человека (ВПЧ), кондилом аногенитальной области – 18,0%, рекуррентных острых респираторных вирусных инфекций (ОРВИ) с частотой шесть – восемь и более раз в год – 12,0% (см. таблицу).
При стандартных общеклинических лабораторных методах исследования было показано отсутствие повышения уровня маркеров воспаления в общем анализе крови и С-реактивного белка. С помощью молекулярно-биологического метода исследования, в частности ПЦР, отделяемого из влагалища были выявлены следующие основные условно-патогенные микроорганизмы: Gardnerella vaginalis (18,0%), Ureaplasma spp. (16,2%), Eubacterium spp. (12,6%), M. hominis (11,7%), Peptostreptococcus (10,8%), E. coli (9,9%), Klebsiella pneumoniae (9,0%) и различные ассоциации инфекционных агентов (от двух до четырех агентов в комбинации).
При изучении особенностей функционирования ИС в период обострения нпХИВЗГТ у 22,0% женщин ГИ до лечения обнаружены изолированные ВИД, у 78,0% – комбинированные ВИД.
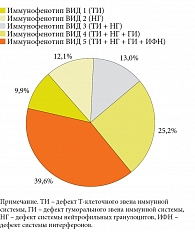
Полученные результаты исследований позволили выделить следующие патологические лабораторные иммунофенотипы ВИД, присутствующие у женщин в период обострения нпХИВЗГТ (рис. 1):
- иммунофенотип ВИД 1 – изолированный дефект Т-клеточного звена ИС в виде снижения количества Т-лимфоцитов CD3+CD19- за счет Т-хелперов CD3+CD4+ – встречался в 9,9% случаев;
- иммунофенотип ВИД 2 – дефекты функционирования системы НГ в виде отсутствия адекватного количественного ответа, то есть прироста количества НГ в ответ на обострение хронического воспалительного процесса, и снижения их эффекторных функций – наблюдался у 12,1% женщин;
- иммунофенотип ВИД 3 – комбинированный дефект Т-клеточного звена ИС в сочетании с дефектом функционирования системы НГ – встречался в 13,0% случаев;
- иммунофенотип ВИД 4 – комбинированный дефект Т-клеточного звена ИС в сочетании с дефектом функционирования НГ и дефектом гуморального звена в виде дефицита сывороточных IgG и IgА в ответ на обострение хронического воспалительного процесса – выявлен в 25,2% случаев;
- иммунофенотип ВИД 5 – комбинированный дефект Т-клеточного и гуморального звеньев ИС в сочетании с дефектом функционирования НГ и дефицитом сывороточных ИФН (ИФН-α и ИФН-α/ИФН-γ) – встречался в 39,6% случаев.
Сопоставительный анализ показал, что комбинированные трех-четырехкомпонентные (иммунофенотипы ВИД 3–5) дефекты ИС имели место у женщин с более длительным (более восьми лет) анамнезом заболевания. У 35% женщин с обострением нпХИВЗГТ, имеющих дополнительные критерии иммунокомпрометированности, в частности наличие вирусных инфекционных проявлений (ГВИ, рекуррентные ОРВИ, ВПЧ-инфекция), лабораторно определялся иммунофенотип ВИД 5 с комбинированным ВИД и дефектами в четырех звеньях ИС.
В результате комплексного исследования ИС у женщин ГИ до лечения выявлен дисбаланс про- и противовоспалительных цитокинов, таких как ИЛ-1β, ФНО-α, ИЛ-6, ИЛ-8, ИЛ-18, ИЛ-4 и ИЛ-10. Однако сопряженности изменений в системе цитокинов с различными иммунофенотипами ВИД у женщин в период обострения нпХИВЗГТ не установлено.
Особенно важно отметить, что среди нарушений ИС преобладали дефекты функционирования НГ – 90,1% пациенток.
Учитывая установленный нами изолированный и комбинированный ВИД, клинически проявляющийся вялотекущим, малосимптомным и затяжным течением обострений ХИВЗГТ, и уточненные лабораторные иммунофенотипы ВИД, была разработана программа иммуномодулирующей терапии фармпрепаратом, основной действующей субстанцией которого является ГП. Ранее нами были показаны позитивные плейотропные эффекты ГП на ИС при различных инфекционно-воспалительных заболеваниях у взрослых и детей, в том числе у иммунокомпрометированных женщин в период обострения нпХИВЗГТ [18]. В настоящем исследовании в зависимости от выявленных лабораторных иммунофенотипов ВИД нарушений функционирования ИС у женщин с нпХИВЗГТ были оценены клинический и иммунологический эффекты традиционной терапии по сравнению с комплексной терапией, включавшей таргетную иммуномодулирующую терапию ГП.
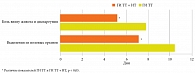
При оценке клинической эффективности у иммунокомпрометированных женщин с обострением нпХИВЗГТ на фоне проведения только традиционной терапии (ГИ ТТ) отмечалось прекращение выделений из наружных половых органов через 10,4 ± 1,8 дня, боли внизу живота и диспареунии через 7,8 ± 1,3 дня (рис. 2). При оценке отдаленных результатов в ГИ ТТ установлено, что обострение нпХИВЗГТ в течение одного года было зарегистрировано у 59,0% пациенток, в частности через три месяца после лечения – у 13,6%, через шесть месяцев – у 36,4%, через год – у 9,0%.
В группе иммунокомпрометированных женщин, получавших традиционную терапию и иммунотерапию ГП (ГИ ТТ + ИТ) в остром периоде нпХИВЗГТ, наблюдалось прекращение выделений из наружных половых органов через 7,1 ± 1,1 дня, боли внизу живота и диспареунии через 5,2 ± 1,0 дня (см. рис. 2). Таким образом, в ГИ ТТ + ИТ в отличие от ГИ ТТ на два-три дня раньше купировались клинические проявления обострения нпХИВЗГТ (p < 0,05). В катамнезе через один год наблюдения у 92,5% пациенток обострения нпХИВЗГТ отсутствовали, у оставшихся 7,5% имели место единичные рецидивы, при этом через три месяца – у 1,0%, через шесть месяцев – у 3,5%, через год – у 3,0%, что свидетельствует о значительном увеличении межрецидивного периода у значительного большинства иммунокомпрометированных женщин, получавших таргетную иммуномодулирующую терапию ГП.
Кроме того, у иммунокомпрометированных женщин после проведения программы лечения с включением препарата Имунофан® (ГИ ТТ + ИТ) сократилась в 2,5–3,0 раза частота развития рекуррентных ОРВИ, а также обострений инфекции, вызванной ВПГ I и II типов, различной локализации. Немаловажно и то, что в 100% случаев как во время лечения препаратом Имунофан®, так и в более поздние сроки после лечения побочных эффектов иммунотерапии не зарегистрировано.
По нашему мнению, у иммунокомпрометированных женщин с нпХИВЗГТ достижение более значимых позитивных клинических эффектов происходит на фоне улучшения/восстановления функционирования ИС.
После проведения традиционной терапии у 13,6% иммунокомпрометированных женщин с нпХИВЗГТ с иммунофенотипом ВИД 1 дефект Т-клеточного иммунитета восстановился до уровня условно здоровых женщин.
У иммунокомпрометированных женщин с нпХИВЗГТ, имевших лабораторный иммунофенотип ВИД 2, восстановление эффекторных функций НГ после лечения наблюдалось в 11,1% случаев.
У пациенток с нпХИВЗГТ с лабораторным иммунофенотипом ВИД 3 было показано восстановление дефекта Т-клеточного звена ИС в 13,7% случаев, функционирования системы НГ – в 10,3%.
У иммунокомпрометированных женщин с нпХИВЗГТ с лабораторным иммунофенотипом ВИД 4 восстановление Т-клеточного звена иммунной системы имело место в 8,9% случаев, функционирования НГ – в 5,3%, уровня IgG – в 28,5% случаев.
У иммунокомпрометированных женщин с нпХИВЗГТ с лабораторным иммунофенотипом ВИД 5 восстановление дефектного Т-клеточного звена наблюдалось в 5,6% случаев, однако изменений со стороны гуморального звена и функционирования НГ не зафиксировано. Установлено также восстановление уровня ИФН-α/ИФН-γ в 28,0% случаев, ИФН-γ в 14,0%.
В ГИ ТТ элиминация патогенов при нпХИВЗГТ в результате использования системной и локальной антибактериальной терапии привела к улучшению иммунологических показателей в небольшом проценте случаев, что не способствовало достижению «истинной клинико-иммунологической ремиссии» заболевания и не предотвращало рецидивов нпХИВЗГТ при наблюдении в течение одного года.
В отличие от ГИ ТТ у женщин с нпХИВЗГТ, получавших комплексное лечение с включением иммунотерапии препаратом Имунофан®, позитивные клинические эффекты как при обострении нпХИВЗГТ, так и в катамнезе в течение одного года были тесно ассоциированы с полным восстановлением или значительным улучшением работы врожденных и адаптивных механизмов противомикробного иммунитета.
Так, в ГИ ТТ + ИТ после лечения установлены изменения в разных звеньях ИС в зависимости от иммунофенотипа ВИД:
- при лабораторном иммунофенотипе ВИД 1 – регресс дефектов Т-клеточного звена в 88,0% случаев;
- лабораторном иммунофенотипе ВИД 2 – восстановление эффекторных функций НГ в 62,0% случаев;
- лабораторном иммунофенотипе ВИД 3 – восстановление Т-клеточного звена в 72,0% случаев, функционирования НГ в 68,0% случаев;
- лабораторном иммунофенотипе ВИД 4 – восстановление Т-клеточного звена в 40,0% случаев, функционирования НГ в 32,0% случаев, уровня сывороточного IgG в 42,8% случаев;
- лабораторном иммунофенотипе ВИД 5 – восстановление Т-клеточного звена и функционирования НГ в 48,0% случаев, гуморального звена, в частности уровня IgА, в 28,5% случаев, а уровня IgG в 42,8% случаев, уровней сывороточных ИФН-α/ИФН-γ в 42,8% случаев, уровня ИФН-γ в 57,0% случаев.
Использование таргетной иммуномодулирующей терапии ГП способствовало улучшению или восстановлению отдельных нарушенных звеньев ИС у иммунокомпрометированных женщин в период обострения нпХИВЗГТ с иммунофенотипами ВИД 1–3, тогда как у женщин с нпХИВЗГТ с иммунофенотипами ВИД 4 и 5, в структуре которых были трех- и четырехкомпонентные нарушения функционирования ИС, отмечалось улучшение прежде всего Т-клеточного звена ИС и функционирования НГ (иммунофенотипы ВИД 4 и 5), а также системы ИФН (иммунофенотип ВИД 5).
Заключение
У женщин с нпХИВЗГТ, имеющих клинические критериальные признаки иммунодефицита: основные признаки – затяжное, часто рецидивирующее и вялотекущее течение заболевания, дополнительные признаки – наличие вирусных инфекционных проявлений (рецидивирующие ГВИ, рекуррентные ОРВИ, ВПЧ-инфекция), в 22% случаев обнаружены изолированные ВИД, в 88% случаев – преобладающие комбинированные ВИД. Комплексный подход к оценке функционирования ИС у иммунокомпрометированных женщин с нпХИВЗГТ позволил выявить пять лабораторных иммунофенотипов ВИД. Важно отметить, что среди всех лабораторных иммунофенотипов ВИД в период обострения нпХИВЗГТ доминирующими нарушениями были дефекты функционирования НГ.
Использование разработанной таргетной иммуномодулирующей терапии в комплексном лечении иммунокомпрометированных женщин с нпХИВЗГТ имеет весомые преимущества по сравнению с использованием только традиционной терапии, не способствующей устранению дисфункции ИС, вследствие чего наблюдается более медленный регресс воспалительного процесса в генитальном тракте и обострения ХИВЗГТ возникают в более короткие сроки у 59,0% иммунокомпрометированных женщин.
Позитивная клиническая эффективность таргетной иммуномодулирующей терапии с использованием препарата Имунофан® в комплексном лечении иммунокомпрометированных женщин с нпХИВЗГТ подтверждается сокращением на два-три дня продолжительности всего клинического симптомокомплекса в период обострения заболевания, а также отсутствием рецидивов нпХИВЗГТ у 92,5% женщин в течение одного года наблюдения, то есть впервые достигнутой у данной группы больных длительной ремиссии. Эффективность Имунофана в комплексном лечении иммунокомпрометированных пациенток с нпХИВЗГТ напрямую зависела от выявленных лабораторных иммунофенотипов ВИД. Наиболее выраженный позитивный иммунологический эффект отмечен при ВИД с иммунофенотипами с повреждением одного или двух звеньев ИС, чаще с дефектами Т-клеточного звена и дефицитом эффекторных функций НГ. При выявлении у иммунокомпрометированных женщин с нпХИВЗГТ более глубоких повреждений ИС с вовлечением трех или четырех звеньев ИС на фоне проведения таргетной иммуномодулирующей терапии не произошло полноценного восстановления всех выявленных дефектов функционирования ИС, но при этом достигнута хорошая клиническая эффективность в 100% случаев. Эти клинико-иммунологические особенности эффективности традиционной терапии с включением иммуномодулирующей терапии обосновывают необходимость проведения в дальнейшем повторных курсов таргетной иммунотерапии препаратом Имунофан®, а возможно, и комбинированной иммунотерапии для достижения «истинной клинико-иммунологической ремиссии».
Установленные нами в настоящем исследовании выраженные в той или иной степени позитивные иммунологические эффекты препарата Имунофан® в отношении всех пяти лабораторных иммунофенотипов ВИД подчеркивают мультивариантность влияний этого синтетического тимического ГП, являющегося аналогом активного центра гормона тимуса тимопоэтина. В первую очередь обращает на себя внимание выявленная нами ярко выраженная его эффективность в отношении дефектов Т-клеточного звена ИС и системы НГ. Мы полагаем, что для поддержания нормального функционирования ИС женщинам с нпХИВЗГТ, у которых была достигнута хорошая клиническая эффективность, но не произошло полноценного восстановления лабораторных иммунофенотипов ВИД (иммунофенотипы ВИД 3–5), необходимо проведение в дальнейшем (через три – шесть месяцев) повторного курса таргетной моно- или комбинированной иммуномодулирующей терапии.
I.V. Nesterova, MD, PhD, Prof., S.V. Kovaleva, MD, PhD, S.N. Pikturno, G.A. Chudilova, DBS, L.V. Lomtatidze, PhD, V.N. Chapurina, PhD, D.L. Vanyan, А.М. Chulkova, PhD
Kuban State Medical University
Patrice Lumumba Peoples' Friendship University of Russia
Contact person: Irina V. Nesterova, inesterova1@yandex.ru
An increase in the number of secondary immunodeficiencies (SID) causes an increase in atypically occurring pelvic inflammatory diseases (aoPID) in women, this necessitates the inclusion of targeted immunomodulatory therapy in complex treatment.
Aim – to clarify the variants of pathological laboratory immunophenotypes of secondary immunodeficiency and to evaluate the clinical and immunological effectiveness of targeted immunomodulatory therapy in the complex treatment of immunocompromised women with aoPID.
Material and methods. The study examined women aged 20–40 years with an exacerbation of aoPID: the study group (SG) before treatment (n = 222) who received traditional therapy (SG TT, n = 22) and complex treatment – traditional therapy + immunotherapy with the pharmaceutical drug Imunofan (SG TT + IT, n = 200). The following parameters were evaluated: T- and B-lymphocytes, natural killer cells, phagocytic and microbicidal functions of neutrophil granulocytes (NG), serum levels of IgA, IgM, IgG, IFN-α, IFN-γ, and proinflammatory cytokines.
Results. In women with aoPID who have clinical criterial signs of SID, the main ones are a prolonged, often recurring and sluggish course of the disease, additional ones are the presence of signs of viral infection (recurrent herpesvirus infections, recurrent acute respiratory viral infections, HPV infection), there are isolated (22%) and combined (88%) SID. 5 laboratory immunophenotypes of the SID were identified with the predominance of defects in the functioning of NG. In SG TT, a short-term positive clinical effect is not accompanied by restoration of the immune system (IS). In SG TT + IT, there is a faster regression of inflammation than in SG TT, and there is no recurrence of aoPID in 92.5% of women after a year of follow-up. A pronounced positive immunological effect was noted in patients with immunophenotypes with damage to one or two arms of the IS, more often the T-cell arm and NG functions. In case of IS defects in three or four arms in SG TT + IT, incomplete repair of defects occurred.
Conclusion. The established positive clinical and immunological effects of Imunophan on 5 laboratory immunophenotypes of SID in aoPID emphasize the multivariance of its effects. Further targeted immunomodulatory therapy is necessary to fully restore IS.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.