количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Современные клинические рекомендации: гормональные препараты для женщин в пери- и постменопаузе
Доклад «Менопаузальная гормональная терапия в клинических портретах. Работаем по новым клиническим рекомендациям» представила М.И. Ярмолинская, д.м.н., профессор РАН, руководитель отдела гинекологии и эндокринологии ФГБНУ «НИИ АГиР им. Д.О. Отта», профессор кафедры акушерства и гинекологии ФГБОУ ВО СЗГМУ им. И.И. Мечникова, руководитель Центра диагностики и инновационных методов лечения эндометриоза, заместитель главного акушера-гинеколога Комитета здравоохранения Санкт-Петербурга, президент Общества акушеров гинекологов Санкт-Петербурга и СЗО. Она рассказала о российских клинических рекомендациях «Менопауза и климактерическое состояние у женщины», разработанных Российским обществом акушеров-гинекологов и утвержденных в 2021 г. Рекомендации основаны на международных руководствах. Они имеют классическую структуру: терминология, этиология, распространенность, диагностика, лечение и методы профилактики. Положения в документе имеют высокий уровень доказательности, крайне редко встречаются категории С3 или 4, основанные на мнении экспертов. Особое внимание в рекомендациях обращается на персонификацию и индивидуальные особенности пациенток и подбор менопаузальной гормональной терапии (МГТ).
Возрастной дефицит половых гормонов, в частности, снижение уровня эстрогенов, является фактором ухудшения качества жизни. Докладчик отметила, что, в соответствии с российскими клиническими рекомендациями, рекомендуется назначение МГТ женщинам в пери и постменопаузе для лечения вазомоторных симптомов умеренной и тяжелой степени, существенно снижающих качество жизни, симптомов генитоуринарного менопаузального синдрома (ГУМС), сексуальной дисфункции.
При приеме для выявления у пациентки вазомоторных, психоэмоциональных, урогенитальных и сексуальных, скелетно-мышечных симптомов используется шкала Грина. «Чтобы врач был защищен с юридической точки зрения, он обязательно должен обращать внимание на корректность оформления медицинской документации. Рекомендуется всем пациенткам на этапе постановки диагноза использовать терминологию и систему критериев STRAW +10 (Рабочей группы по изучению этапов старения репродуктивной системы) для определения стадии репродуктивного старения. Терминология и система критериев STRAW +10 применимы у большинства женщин, поскольку процесс старения репродуктивной системы универсален», – сообщила эксперт. Классификация стадии репродуктивного старения по STRAW +10 неприменима у пациенток с синдромом поликистозных яичников (СПЯ), преждевременной недостаточностью яичников (ПНЯ), после гистерэктомии, аблации эндометрия или использующих в настоящее время комбинированные оральные или внутриматочные контрацептивы. У этих групп пациенток необходимо обращать внимание на возникновение вазомоторных и психоэмоциональных симптомов как ранних признаков приближающейся менопаузы.
Согласно российским клиническим рекомендациям, цель МГТ у женщин в пери и постменопаузе – частично восполнить дефицит половых гормонов, используя минимально оптимальные дозы гормональных препаратов, способные улучшить общее состояние больных, купировать климактерические симптомы и обеспечить профилактику поздних обменных нарушений.
Индивидуальный подход к каждой пациентке является приоритетным при выборе тактики лечения климактерических расстройств. Врач при выборе терапии должен соблюдать ряд принципов. Первый – безопасность составляющих компонентов используемого препарата. Второй – персонификация МГТ с учетом факторов риска сердечно-сосудистых заболеваний (ССЗ), рака молочной железы (РМЖ) и постменопаузального остеопороза, наличия коморбидных состояний у женщины. Важно подбирать минимальную эффективную дозировку, определять оптимальную лекарственную форму препаратов МГТ, использовать режим терапии с учетом возраста, стадии репродуктивного старения (STRAW +10) и потребностей пациентки.

Перед назначением МГТ необходимо обследовать молочные железы: провести визуальный осмотр, пальпацию, рентгеновскую маммографию в двух проекциях, УЗИ молочных желез. Также специалист подчеркнула, что при приеме МГТ маммография с оценкой по шкале BIRADЅ должна проводиться ежегодно начиная с возраста 40 лет.
Важно учитывать свойства прогестагена в составе МГТ. Так, микронизированный прогестерон в наименьшей степени ассоциирован с повышением риска РМЖ в сравнении с другими гестагенами. Также он обладает более благоприятным профилем без опасности в отношении риска венозной тромбоэмболии (BTЭ). Для оценки риска и определения необходимости профилактики ВТЭ следует использовать шкалу PADUA. О высоком риске и необходимости профилактики BTЭ свидетельствует сумма баллов от 4 и более. В этом случае требуется консультация смежных специалистов, а назначение МГТ нецелесообразно.
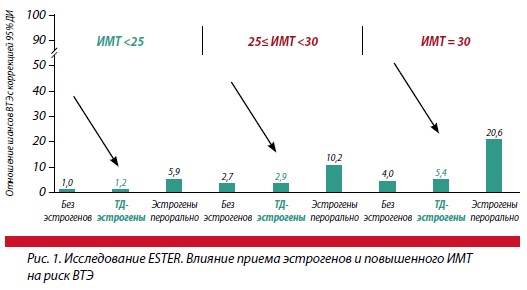
В исследовании ESTHER сравнивалось применение трансдермальных и пероральных форм эстрогенов. Было доказано, что пероральное применение эстрогена и повышенный ИМТ увеличивают риск ВТЭ (рис. 1). А трансдермальный эстроген не создает дополнительного риска развития идиопатической ВТЭ у женщин с повышенным ИМТ. В новых клинических рекомендациях указано, что перед назначением терапии всем пациенткам необходимо измерить окружность талии, поскольку это ключевой показатель абдоминального/висцерального ожирения. Висцеральное ожирение четко коррелирует с инсулинорезистентностью, гипертензией, дислипидемией и сердечно-сосудистыми рисками, оказывает негативное воздействие на здоровье суставов и обменные процессы в хряще и способствует прогрессированию остеоартроза.
Когортное исследование Я. Виноградовой 2019 г. показало, что использование трансдермальных эстрогенов как в монотерапии, так и в комбинации с прогестином не сопровождается увеличением риска ВТЭ. М.И. Ярмолинская обратила внимание на то, что рекомендуется отдавать предпочтение трансдермальному пути введения препаратов эстрогенов у женщин с климактерическими симптомами и наличием коморбидных состояний. К ним относятся: болезни печени, поджелудочной железы, нарушение всасываемости в желудочнокишечном тракте, расстройства коагуляции, повышенный риск венозного тромбоза, гипертриглицеридемия до приема и на фоне приема пероральных препаратов, артериальная гипертензия (>170/100 мм рт. ст.), гиперинсулинемия, повышенный риск образования / наличие камней в желчных путях, мигрень, ожирение, курение.
Профессор Ярмолинская привела клинический случай пациентки с признаками висцерального ожирения, нарушениями менструального цикла по типу олигоменореи (задержки до 1,5–2,5 мес.). Мать больной перенесла холецистэктомию, что относит пациентку к группе риска. По результатам обследований ей была назначена циклическая МГТ трансдермальными эстрогенами, поставлен диагноз: перименопауза, период менопаузального перехода.
Далее докладчик рассказала о проспективном когортном исследовании B. Liu и соавт., посвященном рискам развития заболеваний желчного пузыря у женщин в постменопаузе в контексте сравнения трансдермальной и пероральной гормональной заместительной терапии. Было подтверждено, что трансдермальное применение эстрогенов коррелирует с достоверно меньшим риском развития заболеваний желчного пузыря по сравнению с пероральным приемом. Кроме того, выбор трансдермальных препаратов вместо пероральных позволяет предотвратить одну холецистэктомию на каждые 140 женщин в постменопаузе. А в проспективном рандомизированном двойном слепом исследовании рисков желчнокаменной болезни (ЖКБ) на фоне приема трансдермальных и пероральных форм эстрогенов было доказано, что прием пероральных эстрогенов приводит к более выраженному изменению «печеночных маркеров» – липидов и ГСПГ (глобулина, связывающего половые гормоны).
Рекомендуется отдавать предпочтение трансдермальному пути введения препаратов эстрогенов у женщин с климактерическими симптомами и наличием коморбидных состояний
М.И. Ярмолинская рассказала о препарате Эстрожель® – геле во флаконе с помпойдозатором: «Он удобен и позволяет точно дозировать средство с учетом потребностей пациентки. Минимальная доза – 1 нажатие на помпудозатор (0,75 мг эстрадиола); стандартная доза – 2 нажатия на помпудозатор (1,5 мг эстрадиола); максимальная доза – 3–4 нажатия на помпудозатор (2,25–3 мг эстрадиола). Гель наносят тонким слоем на кожу живота, поясничной области. Можно наносить на любую область тела, содержащую жировую ткань, абсолютное исключение – молочные железы, вульва и влагалище. Площадь нанесения должна быть не менее площади 2 ладоней. Гель полностью всасывается в течение 2–3 минут».
В российских клинических рекомендациях отмечается, что трансдермальные формы эстрогенов вследствие отсутствия первичной стадии печеночного метаболизма, в отличие от пер оральных форм эстрогенов, имеют более благоприятный профиль безопасности. Они не повышают риск ВТЭ и ЖКБ. Использование трансдермальных форм эстрогена ассоциировано с меньшим риском больших сердечно-сосудистых событий (инфаркта, инсульта) и ВТЭ, чем использование эквивалентных доз пероральных форм эстрогенов.
В Швеции было проведено общенациональное исследование с участием женщин 50–80 лет в постменопаузе с подтвержденным диагнозом COVID19. Было показано, что дополнительный прием эстрогенов у женщин в постменопаузе связан со снижением риска смерти от коронавирусной инфекции, даже с учетом дополнительных факторов (сопутствующих заболеваний, возраста). Доказано, что 17βэстрадиол может снижать процент инфицирования эпителиальных клеток легких SARSCoV2, обладает противовирусным действием – он увеличивает деградацию клеточных или внеклеточных материалов вируса за счет повышения аутофагии.
Подводя итог, специалист подчеркнула, что при назначении МГТ важно использовать персонализированный подход. «Более 1,9 миллиарда взрослых (39%) во всем мире имеют избыточный вес, из них 650 миллионов страдают ожирением (13%). Проблема особенно актуальна для женщин в постменопаузе: половина имеет избыточный вес, из них 25% – ожирение. Также известно, что у женщин с ожирением вазомоторные симптомы могут встречаться в 1,27 раза чаще. Пероральная МГТ, в отличие от трансдермальной, повышает риск ВТЭ. Применение MГТ требует периодической коррекции дозировок в зависимости от стадии репродуктивного старения, возраста, эффективности и переносимости лечения. Это позволяет эффективно купировать симптомы климактерического синдрома, уменьшить или отсрочить развитие отдаленных последствий дефицита эстрогенов», – подчеркнула профессор Ярмолинская. Также специалист уделила внимание в своем сообщении прогестагену. Она назвала его «физиологическим» регулятором сна. Несмотря на то, что прогестерон не является снотворным средством, он способствует нормализации сна. Пероральный прием микронизированного прогестерона (Утрожестан®) имеет средневыраженный седативный эффект, улучшающий сон и не оказывающий влияние на когнитивные функции в дневное время, что, возможно, связано с воздействием на ГАМКрецепторы. Когда необходимо применение прогестагенов, микронизированный прогестерон представляется наиболее безопасным.
Также спикер отметила, что, в соответствии с российскими клиническими рекомендациями, после назначения МГТ пациенткам оценка эффективности и переносимости терапии должна проводиться через 1–2 мес. после начала лечения, далее каждые 6 мес. в течение первого года терапии, затем 1 раз в год на фоне приема МГТ. Решение о продолжении МГТ принимается совместно пациенткой (хорошо информированной) и ее врачом, с учетом конкретных целей лечения и объективной оценки текущих индивидуальных преимуществ и рисков терапии. Нет никаких причин накладывать жесткие ограничения на продолжительность МГТ. Данные наиболее важных рандомизированных клинических исследований (РКИ) свидетельствуют о безопасности терапии, по крайней мере, в течение 5 лет у здоровых женщин, начавших ее до возраста 60 лет. «Рекомендуется индивидуальный подбор режима и пути введения препаратов МГТ пациенткам с учетом выраженности симптомов, персонального и семейного анамнеза, стадии репродуктивного старения (по STRAW+10), результатов соответствующих исследований, наличия коморбидных состояний, предпочтений и ожиданий женщины для обеспечения высокой эффективности, безопасности терапии и приверженности лечению», – заключила профессор Ярмолинская.
С докладом «Значимость этиопатогенетической терапии доброкачественной дисплазии молочных желез» выступила А.Э. Протасова, д.м.н., профессор кафедры онкологии СПбГУ, профессор кафедры онкологии ФСЗМУ им. И.И. Мечникова, профессор кафедры акушерства и гинекологии ФГБУ «СЗФМИЦ им. В.А. Алмазова». В первую очередь она напомнила о содержании приказа Мин здрава № 1130н «Об утверждении порядка оказания медицинской помощи по профилю «акушерство и гинекология»» от 20 октября 2020 г.

(вступил в силу 1 января 2021 г., действует до 1 января 2027 г.). Согласно приказу, в рамках первичной медикосанитарной помощи осуществляются практические медицинские приемы женщин, направленные на раннее выявление гинекологических заболеваний, патологии молочных желез. В рамках профилактического медицинского осмотра или первого этапа дипансеризации проводится скрининг на выявление злокачественных новообразований молочных желез (маммография обеих молочных желез в двух проекциях с двойным прочтением рентгенограмм). При исключении злокачественных новообразований женщины с доброкачественными заболеваниями молочных желез находятся под диспансерным наблюдением врача акушера-гинеколога, который оказывает медицинскую помощь по диагностике доброкачественной патологии молочных желез и лечению доброкачественных диффузных изменений с учетом сопутствующей гинекологической патологии.
Профессор Протасова дала определение доброкачественной дисплазии молочной железы (ДДМЖ): «Это группа заболеваний, которая характеризуется широким спектром пролиферативных и регрессивных изменений тканей молочной железы с нарушением соотношений эпителиального и соединительнотканного компонентов. Синонимами могут быть: мастопатия, фибрознокистозная болезнь, дисгормональная гиперплазия молочных желез, фиброаденоматоз».
В основе патогенеза ДДМЖ лежит нарушение баланса между прогестероном и эстрогенами. Эстрогены вызывают пролиферацию протокового альвеолярного эпителия и стромы, что в том числе приводит к обтурации протоков и формированию кист. Прогестерон, напротив, противодействует этим процессам, обеспечивает дифференцировку эпителия и прекращение митотической активности. В патогенезе ДДМЖ имеют значение такие факторы, как овариальная недостаточность (ановуляция, недостаточность лютеиновой фазы цикла, относительное преобладание эстрадиола и недостаток прогестерона), изменение рецепции к половым стероидным гормонам, активность пролиферации и апоптоза эпителия, изменение васкуляризации ткани молочной железы. В качестве лечения, согласно действующим российским Клиническим рекомендациям «Доброкачественная дисплазия молочных желез» 2020 г., рекомендовано использование препаратов на основе микронизированного прогестерона. Локальное использование микронизированного прогестерона в виде накожного 1% геля (Прожестожель®) для лечения ДДМЖ (диффузной фибрознокистозной мастопатии) является патогенетически обоснованным. Клинические исследования трансдермального пути введения микронизированного прогестерона показали уменьшение напряжения и болезненности молочных желез уже на 2е сутки применения у 85% женщин; регрессию кист, уменьшение маммографической плотности, положительную динамику по шкале BIRADS по данным УЗИ и маммографии.
Специалист подчеркнула, что «дефицит прогестерона создает условия для неконтролируемой пролиферации в ткани молочной железы и развития ДДМЖ и РМЖ. Локальный дефицит прогестерона, который обусловливает абсолютную или относительную гиперэстрогению, приводит к патологической пролиферации эпителия альвеол, протоков; усилению активности фибробластов; пролиферации соединительной ткани молочной железы».
Ожирение и сахарный диабет (СД) также могут увеличивать риск развития РМЖ. Для РМЖ наиболее объективным показателем риска является центральное ожирение, независимо от менопаузального статуса. Популяционная атрибутивная доля РМЖ, этиологически связанного с высоким ИМТ, составляет 9%. Действие инсулина на клетки молочной железы опосредовано через факторы роста, которые стимулируют пролиферацию и дифференцировку эпителиальных клеток молочных желез и тормозят апоптоз. Инсулин ингибирует выработку ГСПГ, что приводит к увеличению биодоступности эстрадиола. По данным S.C. Larsson и C.S. Mantzoros, у женщин с СД риск развития РМЖ выше на 20%.
А.Э. Протасова привела статистические данные. Доказано, что нарушение соотношения между прогестероном и эстрогенами – главная причина дисгормональных заболеваний молочных желез. У 60–92% женщин гиперпластические процессы женских половых органов сочетаются с доброкачественными заболеваниями молочной железы. У 97,8% женщин репродуктивного возраста с нейроэндокринными гинекологическими заболеваниями выявлена патологическая перестройка молочных желез. У женщин с нерегулярным менструальным циклом по типу олигоменореи в 64,5% случаев наблюдаются заболевания молочных желез. У 90% женщин с хроническими воспалительными заболеваниями органов малого таза обнаруживается мастопатия. При СПЯ в 5 раз чаще обнаруживается ДДМЖ. У женщин с циклической масталгией в течение 3 лет и менее риск РМЖ повышен в 2,9 раза, а свыше этого срока – в 5,3 раза. А у женщин 25–29 лет с нарушением менструального цикла риск развития РМЖ в пери и постменопаузе почти в 2 раза выше.
«Важнейшая задача лечения диффузной фибрознокистозной мастопатии – снижение риска развития РМЖ, – подчеркнула специалист. – Для лечения данного заболевания должна назначаться в первую очередь патогенетическая терапия в виде таргетной доставки микронизированного прогестерона путем применения накожного геля на область молочных желез. Накожный путь назначения микронизированного прогестерона создает намного более высокую концентрацию прогестерона в ткани молочной железы, чем системный».
В России зарегистрирован единственный трансдермальный препарат микронизированного прогестерона – Прожестожель® (1% гель). Согласно инструкции по применению лекарственного средства, препарат имеет два показания: мастодиния, диффузная фибрознокистозная мастопатия (синоним: ДДМЖ). По данным Е.В. Меских, Н.И. Рожковой, Прожестожель® облегчает боль в молочной железе на 2е сутки лечения у 85% пациенток с мастопатией с преобладанием железистого компонента. А через 4 мес. терапии препарат продемонстрировал клиническую эффективность у всех пациенток (курс лечения от 3 мес.). Один из важных эффектов препарата, полученных в ходе клинических наблюдений, – снижение маммографической плотности, что способствует повышению надежности лучевой диагностики при курсовом лечении и ассоциировано со снижением риска РМЖ или выявлением его ранних стадий.
В отличие от симптоматических, растительных, гомеопатических препаратов, Прожестожель® эффективен в монотерапии, что также подтверждается исследованиями. В частности, профессор Протасова привела данные 2х многоцентровых исследований – BREAST1 и BREAST2, в которых принимала участие. Всего в исследованиях приняли участие более 200 специалистов и 2 564 пациентки. Результаты этих исследований показали, что при применении Прожестожеля в монотерапии для лечения диффузной фибрознокистозной мастопатии в непрерывном режиме в течение 3–6 циклов:
• уменьшается выраженность боли в молочных железах;
• более чем в 2 раза уменьшается количество и размер образований различной эхогенности по данным УЗИ и маммографии;
• достоверно положительная динамика по шкале BIRADS;
• уменьшается число участков уплотненной структуры, что является следствием антипролиферативного действия трансдермального прогестерона.
«В исследованиях BREAST1 и BREAST2 были сделаны следующие выводы: подтвержден достаточный профиль эффективности и безопасности монотерапии диффузной фибрознокистозной мастопатии препаратом Прожестожель в условиях рутинной клинической практики онкологов и гинекологов. Эффективность препарата Прожестожель доказана клиническими и лабораторными данными: снижение количества и размеров образований по УЗИ, уменьшение болевых ощущений в молочных железах, улучшение состояния молочных желез по рентгенмаммографическому исследованию», – сообщила эксперт. Она перечислила преимущества трансдермального микронизированного прогестерона для лечения мастопатии: таргетная доставка гормона в ткани молочной железы позволяет избежать нежелательных побочных явлений; влияние на избыточную клеточную пролиферацию, которая не просто лежит в основе развития ДДМЖ, но и является фактором риска РМЖ; значимое снижение выраженности болевого синдрома у большинства пациенток уже на вторые сутки применения; уменьшение маммографической плотности и кистозных изменений; улучшение качества физического и психического здоровья пациенток.
Также А.Э. Протасова объяснила механизм действия препарата: «Трансдермальный микронизированный прогестерон в концентрации 1% снижает число эстрогеновых рецепторов, подавляет пролиферацию и регулирует дифференцировку (созревание) клеток молочных желез, тормозит циклическую секрецию гонадотропинов, активирует ферменты, обеспечивающие переход эстрадиола в менее активные формы, блокирует рецепторы пролактина в ткани молочной железы, снижает проницаемость капилляров, что уменьшает отек тканей и интенсивность масталгии».
С.В. Юренева, д.м.н., профессор кафедры акушерства и гинекологии ДПО, заместитель директора Института онкогинекологии и маммологии Научного центра акушерства, гинекологии и перинатологии (НМИЦ АГиП) им. В.И. Кулакова, вицепрезидент Ассоциации гинекологов-эндокринологов, представила доклад «Генитоуринарный менопаузальный синдром: о чем молчат женщины. Новый взгляд на старую проблему». Она рассказала о 2 главных патогенетических механизмах ГУМС, ассоциированных с дефицитом эстрогена: атрофических изменениях слизистой влагалища и нарушении микробиоты. Лечение ГУМС направлено на восстановление слизистой влагалища и микробиоты, нормализацию рН. Системная МГТ недостаточно эффективна в отношении симптомов ГУМС. Для удержания эффекта лечение должно быть длительным.
Докладчик подчеркнула, что ГУМС необходимо лечить, поскольку женщина страдает от сухости, болей, жжения, дискомфорта. И очень важно уметь выявлять это состояние, так как если не спросить, женщина будет терпеть и не скажет о проблеме. Наиболее частые клинические проявления ГУМС: сухость влагалища, раздражение вульвы, жжение, влагалищные выделения, диспареуния и дизурия. Специалист подчеркнула, что симптомы ГУМС, от которых страдает 15% женщин в пременопаузе и 40–54% в постменопаузе, спонтанно не облегчаются, а усугубляются по мере старения женщины и снижения уровня эстрогенов, они также возобновляются после прекращения гормональной терапии. У женщин с хирургической менопаузой отмечаются более тяжелые симптомы. Наибольшее беспокойство вызывают симптомы, негативно влияющие на сексуальную функцию. Тяжесть симптомов не всегда коррелирует с данными физикального обследования.

«Эстрогены – основные регуляторы физиологии влагалища и нижних мочевыводящих путей, они воздействуют на органымишени через свои рецепторы: альфа и бета. В тканях влагалища у женщин в пре и постменопаузе присутствуют в большом количестве эстрогеновые рецепторы альфа (ЭРα), что обеспечивает точки приложения эстриола и эстрадиола. А фитоэстрогены (ЭРβ) практически не экспрессируются или очень слабо выражены при постменопаузе. Поэтому влагалищные фитопрепараты, в которые добавлены увлажнители, могут снижать симптомы, но на эпителий не влияют, – подчеркнула эксперт. – Еще одна точка воздействия – бактериальное сообщество с преобладанием лактобацилл. При нарушении микробиоты увеличивается риск развития бактериального вагиноза, инфекций, передаваемых половым путем, инфекций мочеполовой системы, ВИЧ».
Докладчик напомнила, что для женщин с низким ИМТ в постменопаузе при снижении уровня эстрогена характерно прогрессирование атрофии. А у женщин с высоким ИМТ при снижении уровня эстрогенов нарушается структура микробиома влагалища. Общая бактериальная масса снижается в 6–8 раз каждые 5 лет в течение постменопаузы. «Степень тяжести симптомов ГУМС ассоциирована с особенностями микробиоты. Достаточное количество лактобацилл в составе микробиома влагалища очень важно, поскольку на фоне снижения их доли происходит увеличение разнообразия микробиоты за счет облигатных анаэробов, – прокомментировала специалист полученные данные в исследовании в НМИЦ АГиП им. В.И. Кулакова на базе отделения энокринологической гинекологии. – Мы проанализировали данные более 200 женщин, находящихся в постменопаузе от 1 до 20 лет. Было показано, что по мере увеличения длительности постменопаузы и развития вагинальной атрофии изменяется структура микробиоты влагалища. Преобладающим становится IV тип бактериального сообщества, для которого характерно низкое количество либо отсутствие Lactobacillus spp., доминирование Anaerococcus, Peptoniphilus, Prevotella, Streptococcus или Atopobium, Megasphaera. Также было показано, что тяжелые вагинальные симптомы всегда связаны с дисбиозом, но не всегда с наличием вагинальной атрофии».
С.В. Юренева отметила, что локальные эстрогены эффективнее системной МГТ в лечении симптомов ГУМС. Также МГТ имеет «терапевтическое окно»: возраст не старше 60 лет, длительность постменопаузы не более 10 лет. Локальные эстрогены облегчают симптомы вагинальной атрофии, они имеют показания для терапии урогенитальной атрофии. Они быстро и эффективно облегчают симптомы (об этом сообщают 90% женщин), не имеют ограничений по возрасту. В клинических рекомендациях EMAS 2021 г. было доказано, что минимальные дозы эстрогенов безопасны и эффективны для лечения ГУМС.
В американском исследовании REJOICE было показано, что минимальная доза вагинального эстрадиола при сохранении эффективности имеет минимальную системную абсорбцию у здоровых женщин с вагинальной атрофией в постменопаузе. «Поэтому при долговременной терапии мы можем использовать меньшие дозы и делать большие интервалы, это обосновало схему терапии», – сделала вывод профессор С.В. Юренева.
В России зарегистрировано несколько вагинальных препаратов эстрогена, содержащих эстриол, в том числе капсулы Триожиналь®, содержащие эстриол 0,2 мг, лактобациллы не менее 2×107 КОЕ и прогестерон 0,2 мг. Стартовый курс – 2 капсулы ежедневно в течение 20 дней (восстановление слизистой), далее следует длительная поддерживающая терапия 1 капсула
2 р./нед. Этого достаточно, чтобы получить стабильный клинический эффект.
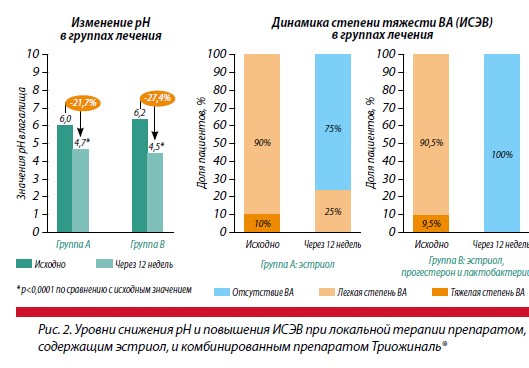
В 2018 г. докладчик инициировала исследование, где сравнивалась терапия пациенток с вагинальной атрофией эстриолом и комбинированным препаратом Триожиналь® (эстриол, прогестерон и лактобактерии). Было показано, что локальная терапия вагинальными капсулами Триожиналь® сопровождалась более быстрым и значимым снижением pH и значимым повышением ИСЭВ. Эффективность локальной монотерапии эстриолом составила 75% (ИСЭВ ≥65%), локальной комбинированной терапии – 100%
(рис. 2). Также на фоне локальной комбинированной терапии препаратом Триожиналь® значимое купирование симптомов сопровождалось увеличением доли лактобацилл (рис. 3). В обеих группах было отмечено достоверное повышение маркеров локального иммунитета.
Вагинальные эстрогены благоприятно влияют на сексуальную функцию. Ранний дефицит эстрогенов, вызванный ранней менопаузой / ПНЯ, связан с более серьезным нарушением сексуальной функции. Результаты метаанализа продемонстрировали преимущество вагинального эстрогена перед лубрикантами в восстановлении сексуальной функции.

При использовании локальных эстрогенов не установлено повышение риска гиперплазии и рака эндометрия, РМЖ, ВТЭ, ССЗ, характерных для системных эстрогенов. Интравагинальные эстрогены не имеют возрастных ограничений в менопаузе. Схема лечения состоит из 2 этапов: терапия насыщения (прием ежедневно в течение 2–4 нед.) и поддерживающая терапия (2 р./нед. в течение 6–24 мес.). Ограничения для перерывов и возобновления терапии отсутствуют. Локальные эстрогены могут добавляться к системной МГТ, если она недостаточно влияет на симптомы ГУМС. Подводя итог, профессор С.В. Юренева выделила ключевые моменты своего доклада: «Урогенитальная атрофия – это прогрессирующее хроническое состояние, которое возобновляется после прекращения лечения локальными эстрогенами (эстриолом, эстрадиолом). Объективные симптомы возвращаются к исходному уровню через 1 месяц, субъективные симптомы – через 3 месяца. Лечение ГУМС должно рассматриваться не как кратковременный курс для облегчения симптомов, а как долговременная терапия. Комбинированный препарат Триожиналь®, содержащий эстриол (0,2 мг), лактобациллы (не менее 2×107 КОЕ) и прогестерон (0,2 мг), восстанавливает эпителий влагалища и микробиоту, купирует вагинальные симптомы, способствует формированию промежуточного слоя эпителия и синтезу гликогена, необходимого для жизнедеятельности лактобацилл».
Больше полезной информации на сайте проекта
«Позаботьтесь о МАММе» mammacare.ru
Новости на тему
СТАТЬИ по теме
31.10.2024
31.10.2024
МЕРОПРИЯТИЯ по теме
НОВОСТИ этой компании
