Диабетическая невропатия – фокус на поражение тонких волокон периферических нервов
- Аннотация
- Статья
- Ссылки


Диабетическая невропатия может длительное время протекать без клинических проявлений или выражаться комбинацией различных симптомов. По меньшей мере в 50% случаев невропатия при сахарном диабете характеризуется диффузным или локальным повреждением периферических соматических нервных волокон. Определение типа диабетического поражения позволяет дать прогноз заболевания и обеспечивает наиболее адекватное ведение пациента. Именно поэтому для клинициста чрезвычайно важно четко систематизировать и классифицировать многообразные поражения нервной системы при сахарном диабете.
Диабетические невропатии классифицируются в зависимости от распространенности невропатических симптомов (диффузные и фокальные формы невропатий), типа ведущих клинических симптомов (сенсомоторные или вегетативные невропатии) и ведущего патогенетического фактора (метаболические или васкулярные невропатии) (табл. 1). Возможны смешанные формы. Диабетические невропатии различаются по клинической картине и патогенезу. Диффузные хронические невропатии, которые развиваются преимущественно в результате метаболических нарушений, встречаются при сахарном диабете значительно чаще, чем фокальные формы. Выделяют два клинических типа диффузных невропатий, которые отличаются по клинической картине и прогнозу заболевания (табл. 2):
- обусловленные повреждением толстых (миелинизированных) волокон;
- обусловленные повреждением тонких (слабо миелинизированных и немиелинизированных) волокон.
Дистальная симметричная сенсомоторная невропатия с поражением толстых волокон обычно развивается спустя несколько лет от начала основного заболевания. Эта форма развивается медленно (хронически), первые симптомы (онемение, парестезии, болевые ощущения) появляются в нижних конечностях, иногда унилатерально. С поражением миелинизированных (толстых) волокон связано нарушение глубокой и вибрационной чувствительности, снижение или выпадение сухожильных рефлексов. При прогрессировании невропатии развивается мышечная слабость, арефлексия, сенситивная атаксия. Важно отметить, что моторные симптомы появляются позже, чем сенсорные, в том числе болевые, ощущения, и остаются умеренно выраженными (мягкий парез) даже на отдаленных стадиях болезни.
Первым симптомом пареза часто бывает слабость в мышцах-разгибателях стопы или большого пальца, что клинически проявляется спотыканием на ровном месте. Кроме того, могут наблюдаться такие необычные симптомы, как тремор (свидетельствует об активности патологического процесса, воздействующего на периферическую нервную систему) и крампи (пароксизмы болезненных сведений мышечных групп). Электрофизиологическое исследование скорости проведения по нервам позволяет подтвердить невропатию и выявить субклиническое поражение миелинизированных волокон.
Наибольшее повреждающее действие сахарный диабет оказывает на тонкие (слабо миелинизированные (С и А дельта) и немиелинизированные) волокна, которые обеспечивают вегетативную иннервацию, температурную и болевую чувствительность. Эти волокна поражаются первыми, на ранних этапах развития сахарного диабета и даже еще до ранних клинических проявлений диабета [1]. Клинически поражение тонких волокон может манифестировать симптомами вегетативной недостаточности в сочетании со жгучей, стреляющей болью, гипералгезией, парестезиями, снижением болевой и температурной чувствительности, ульцерацией стоп и снижением висцеральной болевой чувствительности. Именно со снижением висцеральной болевой чувствительности связаны безболевые инфаркты у больных сахарным диабетом.
Диагностику полиневропатии, ассоциированной с поражением только тонких волокон, затрудняет отсутствие привычных для полиневропатии неврологических знаков. У пациентов сохранны сухожильные рефлексы, имеется достаточная мышечная сила, не страдает глубокая и вибрационная чувствительность, электрофизиологические показатели также остаются в норме. Единственным очаговым неврологическим знаком могут быть зрачковые нарушения (синдром Аргайла Робертсона). Неудивительно, что ранее у этих пациентов ошибочно диагностировали невротические нарушения, истерию или симуляцию. Только с появлением современных специальных методов исследования стало возможным установить истинную природу этого расстройства.
Невропатия тонких волокон может проявляться только соматической (вегетативной) невропатией, или соматические симптомы могут перекрываться симптомами «болевой невропатии». В последнем случае болевая симптоматика может служить маркером для выявления поражения вегетативных волокон. Больные обычно жалуются на болевые дизестезии (покалывание, пощипывание, ползание мурашек, жгучие и/или режущие, стреляющие боли), локализованные первоначально в стопах, но со временем распространяющиеся на голени, кисти. Болевые ощущения в стопах провоцируются приемом теплого душа (температурная аллодиния), ходьбой, обуванием, надеванием носков (механическая аллодиния).
Сверлящие, жгучие боли часто персистируют в ночное время, серьезно нарушая сон. Из-за аллодинии (восприятие нормального афферентного стимула как болевого) обычное прикосновение одеяла к стопам для больного становится мучительным. У большинства пациентов развивается синдром беспокойных ног. Обычно позитивные сенсорные симптомы (спонтанные боли, гипералгезия, гиперпатия, аллодиния) доминируют и могут скрывать негативные симптомы (температурная и болевая гипостезия), что затрудняет диагностику. Непонятные для пациента болевые симптомы часто являются причиной ошибочной диагностики заболеваний суставов в инициальном периоде заболевания.
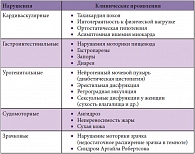
Диабетическая автономная невропатия часто сочетается с другими типами невропатий (чаще всего болевой невропатией), но может развиваться изолированно, предшествуя другим осложнениям сахарного диабета. Диабетическая автономная невропатия манифестирует дисфункцией одной или более органных систем (кардиоваскулярной, гастроинтестинальной, мочеполовой, судомоторной или окулярной). Для диабетической автономной невропатии характерно диффузное повреждение симпатических и парасимпатических волокон. Поскольку вагальный нерв – наиболее протяженная часть вегетативной системы, он повреждается у пациентов с диабетом в первую очередь уже на ранних этапах заболевания. Диабетическая автономная невропатия может поражать любую систему организма (табл. 3).
Наиболее часто (приблизительно у 20% больных) страдает кардиоваскулярная система, последствием чего может быть «денервированное сердце». Основными осложнениями «денервированного сердца» являются: безболевой или малосимптомный инфаркт миокарда, аритмии, ведущие к «внезапной смерти», снижение толерантности к физическим нагрузкам. От 25 до 50% пациентов умирают через 5–10 лет после диагностики кардиальной вегетативной невропатии.
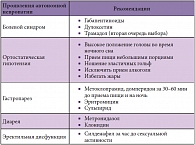
В результате нарушения симпатического и парасимпатического контроля над работой сердца пациенты с автономной невропатией имеют фиксированный пульс, ассоциированный с тахикардией покоя. Более серьезным симптомом является нарушение поддержания артериального давления во время стояния, в результате чего возникает ортостатическая гипотензия и тахикардия во время стояния. Ортостатическая гипотензия определяется как снижение систолического давления более чем на 20 мм рт. ст. и диастолического давления более чем на 10 мм рт. ст. во время стояния или нахождения в вертикальной позиции на поворотном столе, при этом снижение давления сопровождается симптомами церебральной гипоперфузии. Это главный симптом, который является причиной инвалидизации пациентов с вегетативной недостаточностью.
Клиницисты часто оставляют без внимания ортостатические изменения артериального давления. Как правило, пациенты с ортостатической гипотензией жалуются на ощущение пустоты в голове, головокружение, предобморочное состояние, обмороки. Эти симптомы обычно возникают в ответ на быстрый переход из положения лежа/сидя в положение стоя, при физическом усилии или приеме пищи. В то же время некоторые пациенты предъявляют жалобы, которые клиницисту трудно квалифицировать как гипотензивные, – например, общая слабость, ощущение усталости, умственная заторможенность, затуманивание зрения, головная боль, боль в шее, ортостатическое диспноэ, боль в грудной клетке. Такие симптомы, как боль по задней поверхности шеи, стенокардическая боль, ортостатическое диспноэ, обусловлены процессами ишемии за пределами головного мозга (неадекватная перфузия легких, сердечной мышцы, ишемия мышц шеи).
Нарушения сознания могут быть различной степени выраженности – от липотимий до глубоких обмороков. Характерными отличиями синкоп являются гипо- или ангидроз («сухие обмороки»), а также отсутствие вагальной реакции – замедления пульса. Ортостатическая гипотензия усугубляется дегидратацией, физическими усилиями, повышением окружающей температуры, алкоголем, приемом пищи, некоторыми лекарственными препаратами (трициклические антидепрессанты, гипотензивные средства, антагонисты альфа-адренорецепторов и др.).
Поражение гастроинтестинальной системы проявляется многообразными неспецифичными симптомами, по большей мере обусловленными вагальной дисфункцией (гастропарез). Гастропарезы обычно протекают клинически асимптомно, но в дальнейшем их тяжесть нарастает, и гастропарез начинает серьезно беспокоить больных. Гастропарез проявляется ощущением быстрой насыщаемости, анорексией, тошнотой, рвотой, эпигастральным дискомфортом, вздутием живота. Эпизоды тошноты и рвоты могут длиться днями или даже месяцами или протекать циклично. Ассоциированное с диабетической автономной невропатией снижение моторики толстого кишечника клинически проявляется диареей, перемежающейся с запорами.
Причиной диареи является интестинальный стаз, приводящий к чрезмерному росту кишечных бактерий, поэтому для лечения диареи, обусловленной диабетической автономной невропатией, используют прокинетические препараты и тетрациклиновые антибиотики. Наиболее частым симптомом со стороны урогенитальной системы является сфинктерная дисфункция, проявляющаяся сфинктерной недостаточностью или атонией мочевого пузыря, атаками диареи, особенно в ночное время, эректильной дисфункцией.
Периферическая судомоторная невропатия в первую очередь поражает нижние конечности, в результате чего кожа становится сухой, трескается, что способствует проникновению инфекции. Нарушение симпатической регуляции сосудов в результате вазодилатации приводит к артериовенозному шунтированию. Следует обратить внимание, что симптоматическое лечение невропатии тонких волокон, направленное на коррекцию болевого синдрома и отдельных симптомов (табл. 4), оказывая воздействие на некоторые клинические проявления невропатии, не влияет на механизмы развития диабетической невропатии.
Важно диагностировать диабетическую автономную невропатию до развития необратимых изменений. Клинические симптомы обычно возникают спустя несколько лет после начала диабета, но субклинические вегетативные нарушения можно идентифицировать уже в течение первого года после постановки диагноза «сахарный диабет 2 типа» и через два года после выявления сахарного диабета 1 типа [2]. Наиболее простой, неинвазивной, высокочувствительной и воспроизводимой методикой ранней диагностики диабетической автономной невропатии является тестирование кардиоваскулярных рефлексов.
Оно включает оценку частоты сердечных сокращений в покое (патологическое значение более 100 уд/мин), оценку вариабельности сердечного ритма (лежа, при глубоком дыхании и в ортопробе), оценку подъема артериального давления в ответ на проведение пробы Вальсальвы, оценку частоты сердечных сокращений и систолического давления через 2 мин после перехода из горизонтального в вертикальное положение, оценку диастолического давления на изометрическое усилие и расчет нормированного QT-интервала. Патологические результаты двух или более тестов подтверждают диагноз «диабетическая автономная невропатия».
Пациентам с сахарным диабетом 1 типа рекомендуется проводить тестирование через 5 лет после установления диагноза сахарного диабета и затем ежегодно, пациентам с сахарным диабетом 2 типа тестирование должно проводиться сразу после установления диагноза и затем ежегодно. Альтернативными методами диагностики диабетической автономной невропатии могут служить частотные показатели кардиоинтервалографии и 24-часовой мониторинг вариабельности сердечного ритма. Последний метод является более чувствительным, чем стандартные кардиальные тесты, и позволяет верифицировать вегетативные нарушения на очень ранних стадиях болезни.
В повреждении вегетативного волокна участвуют сложные мультифакторные механизмы: метаболические, сосудистые, аутоиммунные и нейрогормональные (приводят к дефициту фактора роста). Повышение уровня глюкозы имеет несколько значимых последствий. Во-первых, активируется полиоловый путь окисления глюкозы, способствующий накоплению сорбитола и истощению запасов миоинозитола, что способствует снижению активности Na+/К+-АТФазы. Во-вторых, отмечается нарушение функции микрокапилляров эндоневрия и их гипоксия вследствие инактивации оксида азота. В-третьих, накапливаются конечные продукты усиленного гликозилирования, которые, связываясь со специфическими рецепторами нейрона, вызывают окислительный стресс.
Еще одно важное звено в патогенезе диабетических невропатий – это активация протеинкиназы С. Последние исследования показали, что активация протеинкиназы С приводит к увеличению количества определенной популяции калиевых каналов, которые имеют очень важное значение в восприятии боли. Нарушение гомеостаза кальция также играет существенную роль в патогенезе диабетической невропатии. Роль окислительного стресса как патогенетического звена диабетической невропатии изучена лучше всего. Окислительный стресс, вызванный гипергликемией, как уже отмечалось ранее, индуцирует запрограммированную смерть клеток, что способствует дегенерации тонких волокон. В то же время развитие автономной невропатии уже на стадии нарушения толерантности к глюкозе свидетельствует, что диабет может повреждать тонкие волокна, по-видимому, за счет замедления роста эпидермальных нервных волокон.
Адекватный контроль гликемии является решающим фактором в профилактике и замедлении прогрессирования диабетической автономной невропатии, но не устраняет ее проявления. К сожалению, интенсивное лечение инсулином может привести к функциональным вегетативным нарушениям, которые сходны с симптомами диабетической автономной невропатии. Именно поэтому следует очень аккуратно снижать уровень гликемии, не допуская эпизодов гипогликемии. Неадекватный гликемический контроль может быть также последствием диабетической автономной невропатии (гастропарезы, которые остаются нераспознанными). Лечение гастроинтестинальных симптомов способствует улучшению гликемического контроля. Сбалансированное питание, отказ от алкоголя и табакокурения могут замедлить прогрессирование диабетической автономной невропатии.
Многообещающими являются доказательства эффективности антиоксидантов в профилактике и лечении диабетической автономной невропатии. Первое место среди антиоксидантов, использующихся для патогенетической терапии диабетической автономной невропатии, сегодня занимает естественный липофильный антиоксидант – тиоктовая кислота. Раннее выявление вегетативных нарушений со стороны кардиальной системы требует незамедлительного назначения патогенетической терапии, что также может замедлить течение диабетической автономной невропатии или даже восстановить нарушенные функции, если лечение начато на ранних этапах заболевания [3].
Прием альфа-липоевой кислоты увеличивает уровень глютатиона, который понижен у пациентов с сахарным диабетом по сравнению с общей популяцией. Напомним, что глютатион – это один из важнейших эндогенных антиоксидантов. Вместе с липоевой кислотой он играет основную роль в окислительно-восстановительных реакциях. Альфа-липоевая кислота также способна поглощать свободные липидные радикалы в периферической нервной ткани, таким образом препятствуя образованию активных форм кислорода. Повышенный уровень глюкозы является причиной накопления конечных продуктов гликозилирования. Аутооксидативное гликозилирование считается одной из основных причин повышения содержания активных форм кислорода и снижения активности антиоксидантных систем. Более того, повышение уровня фруктозы, образующееся за счет активации полиолового пути, приводит к образованию предшественников конечных продуктов повышенного гликозилирования. Уникальность альфа-липоевой кислоты как антиоксиданта заключается в следующих свойствах:
- способность напрямую элиминировать свободные радикалы;
- способность к регенерации эндогенных антиоксидантов, таких как глютатион, витамины Е и С;
- способность редуцировать продукцию свободных радикалов.
В некоторых исследованиях показано, что витамин Е улучшает вегетативный кардиобаланс у пациентов с диабетической автономной невропатией [4], но в то же время может нивелировать эффект статинов, поэтому дополнительное использование витамина Е не всегда оправдано у отдельных категорий пациентов. У альфа-липоевой кислоты есть еще один важный дополнительный эффект: она стимулирует образование фактора роста нервной ткани и способствует регенерации нервных волокон. Данный механизм особенно важен, поскольку поражение тонких волокон в значительной степени обусловлено недостатком фактора роста нервной ткани.
Основополагающие исследования клинической эффективности и безопасности альфа-липоевой кислоты у больных с диабетическими невропатиями (ALADIN I, ALADIN II, SYDNEY I, SYDNEY II, NATAN II, ORPIL и др.) были проведены с использованием оригинального препарата тиоктовой кислоты – Тиоктацид® 600 Т для внутривенных инфузий и Тиоктацид® БВ в форме таблеток быстрого высвобождения (БВ) (производство «Меда фармасьютикалс Швейцария ГМбХ»). Тиоктацид® 600 Т для внутривенных инфузий является трометамоловой солью тиоктовой кислоты, что в сравнении с обычными препаратами – дженериками тиоктовой кислоты на основе этилендиаминовой соли обеспечивает оригинальному препарату выраженные преимущества: гипоаллергенность, безболезненность инфузий и отсутствие опасности развития тромбофлебитов [5].
Проблема обычных таблетированных форм альфа-липоевой (тиоктовой) кислоты заключается в высокой индивидуальной вариабельности абсорбции. При пероральном приеме таблетированной формы альфа-липоевой кислоты внутри- и межиндивидуальные различия по уровню в плазме крови могут быть существенными. Эта вариабельность абсорбции не опасна для здоровья пациентов, однако ведет к тому, что терапевтически эффективный уровень в плазме крови достигается не у всех пациентов.
Из-за «критической» биодоступности ранее таблетированная тиоктовая кислота применялась только после предварительного курса инфузий, поскольку значительное количество пациентов не отвечали на терапию только таблетированной формой. Появление таблетированной тиоктовой кислоты быстрого высвобождения (Тиоктацид® БВ) расширило возможности терапии диабетической полиневропатии. Только специальная пероральная форма тиоктовой кислоты – форма быстрого высвобождения – создает терапевтически эффективный уровень тиоктовой кислоты в плазме крови каждого пациента, что предупреждает повреждение нерва при диабетической невропатии.
В 2004 г. были опубликованы данные метаанализа, базирующегося на четырех рандомизированных плацебоконтролируемых исследованиях (ALADIN I, ALADIN III, SYDNEY, NATHAN II), в которых изучалась эффективность препарата Тиоктацид® 600 Т. Метаанализ охватил свыше 1000 больных и убедительно показал, что уже после 3 недель в/в введения трометамоловой соли тиоктовой кислоты (Тиоктацид® 600 Т) в дозе 600 мг положительный эффект наблюдается более чем у 50% больных [6]. Причем улучшение наблюдалось как в отношении позитивных сенсорных симптомов, так и в отношении негативных симптомов. Это весьма обнадеживающие находки, поскольку наличие негативных симптомов является главным фактором риска развития ульцерации стоп. Более того, позитивный эффект лечения сохраняется на протяжении шести месяцев [7].
В исследовании DEKAN проводилась оценка эффективности 4-месячного курса тиоктовой кислоты в отношении диабетической автономной невропатии [8]. Было показано улучшение показателей вариабельности сердечного ритма в группе активного препарата по сравнению с плацебо. Таким образом, получены доказательства преимущества долговременного курса оральных форм тиоктовой кислоты быстрого высвобождения для лечения диабетической сенсомоторной невропатии (600–1800 мг/сут).
Длительное время доказательная база эффективности альфа-липоевой кислоты соотносилась с инфузионной формой, в результате чего оптимальными считались схемы лечения, включающие инфузии. Проведенное несколько лет назад рандомизированное плацебоконтролируемое исследование SYDNEY II таблетированной тиоктовой кислоты быстрого высвобождения (Тиоктацид® БВ) показало возможности изолированного использования таблетированных форм тиоктовой кислоты быстрого высвобождения [9]. Ежедневная таблетированная доза тиоктовой кислоты быстрого высвобождения 600 мг была признана оптимальной по соотношению безопасности/эффективности, но эффект быстрее развивался при использовании тиоктовой кислоты в дозе 1800 мг/сут.
Авторами был сделан вывод о сопоставимом эффекте 3-недельного курса инфузий трометамоловой соли тиоктовой кислоты и 5-недельного курса таблетированной формы тиоктовой кислоты быстрого высвобождения. Согласно полученным данным, в условиях, когда невозможно проведение внутривенных инфузий, альтернативным назначением следует рассматривать прием таблеток тиоктовой кислоты быстрого высвобождения (препарат Тиоктацид® БВ) внутрь. Таким образом, на сегодняшний день необходимость проведения патогенетической терапии диабетической полиневропатии антиоксидантами не вызывает сомнений и является «золотым стандартом» лечения.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.