количество статей
7242
Загрузка...
Пожалуйста, авторизуйтесь:
Клинические случаи
Фитотерапия в лечении инфекции мочевой системы у детей
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Педиатрия" № 2 (16)
- Аннотация
- Статья
- Ссылки
- English
Инфекция мочевой системы (ИМС) является одной из наиболее распространенных патологий детского возраста. Серьезной проблемой клинической практики является формирование бактериальных биопленок, снижающих эффективность применения антибактериальных препаратов. В статье рассмотрены современные проблемы фитотерапии и ее место в лечении ИМС у детей. Показана эффективность клинического применения препарата Канефрон Н, что подтверждает целесообразность его назначения при терапии ИМС у детей.
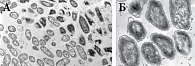
Рисунок. Трансмиссионная электронная микроскопия. Ультратонкий срез биопленки Echerichia сoli 132 при воздействии Канефрона Н (А – ув. × 8000, Б – ув. × 30000)
Под инфекцией мочевыводящих путей понимается острый инфекционный процесс в мочевых путях при отсутствии лабораторных и инструментальных признаков поражения тубулоинтерстициальной ткани почек.
Проблема инфекции мочевой системы (ИМС) стала одной из центральных в педиатрии, нефрологии, урологии, гинекологии и других клинических направлениях. Этому вопросу в последние годы было посвящено множество публикаций, а также российских и зарубежных методических рекомендаций, в частности письмо Минздравсоцразвития России от 26 января 2007 г. № 567-ВС «Об организации медицинской помощи детям с инфекцией мочевыводящих путей».
По показателям заболеваемости у детей ИМС занимает второе место после инфекции респираторной системы. Среднегодовой темп прироста заболеваемости ИМС у детей до 18 лет составляет 6,1% [1]. У детей первого года жизни показатель заболеваемости ИМС за пять лет увеличился на 23% [2]. Поскольку заболеваемость ИМС значительно выше у девочек, не может не вызывать тревогу формирующийся порочный круг: больная девочка – больная девушка – больная женщина – больная беременная – больной ребенок [3].
Уже много лет во врачебном сообществе нет единства практически ни по одному вопросу, относящемуся к ИМС. Подтверждение тому – стандарт Голландского сообщества семейных врачей «Инфекция мочевых путей». В нем сказано: «Недавно проведенные исследования выявили значительные различия в тактике врачей при инфекции мочевых путей. Имеются разные, подчас противоречивые мнения относительно диагностических критериев, техники обследования, средств первого выбора и назначения препаратов при возникновении рецидивов, а также длительности лечения» [4].
При экспертизе историй болезни качество медицинской помощи при острых ИМС в амбулаторно-поликлинических учреждениях Санкт-Петербурга в 92% случаев было признано ненадлежащим. По мнению экспертов, врачебные ошибки негативно повлияли на состояние 33,6% пациентов [5]. При экспертной оценке качества лечения ИМС 780 детей первого года жизни штата Вашингтон (США) (всего за изучаемый период родилось 38 985 детей) только 51% пациентов получил адекватную антибактериальную терапию [6].
Характер течения, прогноз, терапевтический подход к ИМС в ХХ в. существенно изменились [7]. В 1930-е гг. отмечалось частое развитие почечной недостаточности и ренальной гипертензии при микробно-воспалительных заболеваниях органов мочевой системы у детей. Успехи в лечении бактериальных инфекций и заболеваний вирусной этиологии в конце 1960-х гг. способствовали появлению фантастической идеи «близкой и окончательной победы над инфекционными заболеваниями». W. Stewart (Surgeon General), выступая в Конгрессе США в 1969 г., отмечал, что «в ближайшее время можно будет закрыть книгу инфекционных болезней и объявить: война выиграна». Однако надеждам скорой победы над инфекциями не суждено было сбыться. Угрожающими темпами стала нарастать резистентность к антимикробным лекарственным средствам.
Один из важнейших факторов роста резистентности микроорганизмов – необоснованное применение антибиотиков. По данным Всемирной организации здравоохранения (ВОЗ), антимикробные средства назначаются нерационально примерно в 75% случаев. Антибиотики имеются в домашних аптечках более чем у 50% семей, а почти 30% пациентов в случае какой-либо инфекции или повышения температуры назначают их себе сами [8]. В связи с широким распространением устойчивых форм микроорганизмов особое внимание исследователи стали уделять изучению феномена биопленкообразования [9].
Биопленка – прикрепленное к плотной поверхности микробное сообщество, в котором адсорбированные на субстрате и друг к другу клетки заключены в матрицу внеклеточных полимерных субстанций, продуцируемых микроорганизмами в соответствии с уровнем развития популяции и условиями транскрипции генов. Внутри биопленки создаются уникальные условия взаимодействия между микроорганизмами. Близкий контакт позволяет резко усилить обмен генетической информацией: образование резистентных штаммов микроорганизмов происходит намного быстрее, чем у микроорганизмов, находящихся в форме планктона. Биопленка способна «метастазировать» с места локализации инфекционного процесса в лимфу и системный кровоток с последующим развитием отдаленных очагов вторичной инфекции.
Длительное отсутствие на фармацевтическом рынке новых антибактериальных препаратов, развитие лекарственной устойчивости микроорганизмов к антибиотикам и уросептикам заставляют обратить пристальное внимание на природные вещества растительного происхождения, обладающие антимикробным действием.
Лекарственным препаратам растительного происхождения особое внимание уделено в трудах Гиппократа, Галена, Авиценны. Фитотерапия – метод лечения различных заболеваний человека, основанный на использовании лекарственных растений и комплексных препаратов из них [10]. В России фитотерапия до 2000 г. имела статус нетрадиционного метода лечения. Официальный статус традиционной медицинской деятельности фитотерапия получила в 2000 г. Общее количество научных работ, приведенных в базе данных Medline Национальной библиотеки лекарственных средств США (National Library of Medicine of the US) и содержащих слово phytotherapy, в 1997–2007 гг. возросло с 800 до 15 000. В настоящее время фитотерапия заняла достойное место в лечении многих заболеваний [11]. Современный уровень развития фитотерапии можно охарактеризовать, представив концепцию фитониринга (от греч. phyton – растение и англ. engineering – изобретательность). Растительные препараты, полученные в соответствии с концепцией фитониринга, отличаются от традиционных отваров и настоев особенностями изготовления, фармацевтическим качеством и наличием доклинических и клинических данных. Перечислим эти особенности:
- тщательный отбор, анализ и селекция собственного посевного материала без применения генной инженерии, возделывание на плантациях, расположенных в экологически чистых регионах;
- продуманные и рассчитанные условия сбора и обработки урожая, позволяющие сохранить высококачественный растительный материал;
- высокотехнологичное производство с запатентованным методом низкотемпературной вакуумной экстракции, позволяющим сохранить активные вещества растительного сырья;
- контроль качества на всех этапах – от сырья до конечного продукта. Использование масс-спектрометрии позволяет подтвердить, что любая капля или таблетка, произведенная в соответствии с фитонирингом, будет иметь одинаковое содержание биологически активных компонентов и соответственно гарантировать терапевтическое действие;
- безопасность и эффективность фитопрепарата, подтвержденные проведением необходимых экспериментальных доклинических и клинических исследований.
В итоге готовый фитониринговый растительный лекарственный продукт характеризуется стандартным количеством активных веществ, обеспечивает точность дозирования и создает условия для наибольшего лечебного результата.
Среди антибактериальных препаратов для лечения осложненной и неосложненной ИМС у детей, применяемых в Санкт-Петербурге, препаратами выбора являются комбинированный антибактериальный препарат с ингибиторами бета-лактамаз амоксициллин/клавулоновая кислота, амоксициллин, цефалоспорины II поколения (цефаклор, цефуроксим), нитрофураны (фуразидин, нитрофурантоин) и Канефрон Н [12]. Появившийся относительно недавно в нашем арсенале Канефрон Н (производитель – «Бионорика СЕ», Германия) завоевывает все большую популярность при лечении ИМС [13–15]. Препарат можно использовать после курса антибактериальной терапии или в качестве монотерапии. Канефрон Н приготовлен на основе лекарственных растений розмарина, золототысячника, любистока. Препарат оказывает комплексное воздействие – антибактериальное (эфирные масла разрушают мембрану бактериальной клетки), диуретическое (улучшаются почечное кровообращение и клубочковая фильтрация), спазмолитическое, антиоксидантное (противовоспалительное). Препарат удобен для применения, поскольку выпускается в каплях для приема внутрь и драже.
При инфекции нижних отделов мочевой системы можно проводить монотерапию Канефроном Н, если у пациента нет факторов риска (пороки почек и др.). Длительность приема препарата определяется индивидуально для каждого пациента – 2–4–8 недель.
В условиях детской поликлиники было проведено лечение неосложненной ИМС Канефроном Н у 15 детей. Возраст детей составил от 3 месяцев до 7 лет. 10 детей были младше одного года. Соотношение девочек и мальчиков – 6,5:1. Длительность терапии Канефроном Н – 14 дней. К 8-му дню терапии санация мочи отмечалась у 13 пациентов, к 14-му дню – у всех пациентов. За шесть последующих месяцев наблюдения рецидив был зарегистрирован у одного пациента.
В случае осложненной ИМС и применения антибактериальных препаратов можно рекомендовать вспомогательное использование Канефрона Н, а в стадии стихания воспаления продолжать лечение фитопрепаратом в режиме монотерапии. Было пролечено 15 детей (12 девочек) в возрасте от 7 до 17 лет с осложненной ИМС (пороки развития почек + ИМС (n = 8), хронический цистит (n = 4), пузырно-мочеточниковый рефлюкс (n = 3)). Всем пациентам был назначен фуразидин в течение 7 дней, затем Канефрон Н на протяжении 4 недель. После месячного перерыва Канефрон Н назначали пациентам еще на один месяц. К 7-му дню санация мочи отмечалась у 14 пациентов, а к 10-му дню – у всех. В течение последующих шести месяцев рецидив наблюдался только у одного ребенка с хроническим циститом.
При частых рецидивах рецидивирующих инфекций (более двух в течение шести месяцев) возможно назначение профилактической терапии [2]. С этой целью Канефрон Н можно применять самостоятельно в течение 4–6 недель после рецидива ИМС или в сочетании с уросептиками (фуразидином, налидиксовой кислотой) месячными курсами. В отличие от других препаратов, принимаемых один раз в день на ночь, Канефрон Н следует принимать трижды в день.
В период профилактического приема уросептиков частота эпизодов ИМС снижается на 90–95%. Но в течение первых трех месяцев после прекращения данного лечения повторные эпизоды отмечают 50% пациентов [16]. После завершения длительной профилактики рецидива мочевой инфекции уросептиками (пузырно-мочеточниковый рефлюкс, пороки развития мочевой системы с рецидивирующим течением пиелонефрита) назначение Канефрона Н на 10 дней месяца в течение трех месяцев позволяет существенно сократить число рецидивов.
Важно учитывать наличие риска развития ИМС при ОРИ, ОРВИ у детей при наличии:
- системных или иммунных заболеваний;
- аномалий развития мочевыводящих путей;
- мочекаменной болезни;
- нейрогенного мочевого пузыря;
- запоров;
- в семье родственников с ИМС или рефлюкс-нефропатией;
- в анамнезе перенесенной ИМС.
С целью профилактики ИМС при острой респираторной инфекции детям группы риска по ИМС назначаем Канефрон Н на 10–14 дней.
В аспекте рационального использования антибиотиков и сдерживания роста резистентности микроорганизмов к антибиотикам роль фитотерапии как альтернативного подхода значительно возросла. Новые данные об эффектах растительных препаратов привлекают исследователей к углубленному изучению новых сторон действия препаратов, которые способны бороться с инфекцией. Например, возник вопрос о влиянии фитопрепаратов на биопленки на слизистых оболочках мочевых и дыхательных путей. В рамках Глобальной стратегии по сдерживанию резистентности микроорганизмов к антимикробным препаратам, принятой ВОЗ, для оценки роста резистентности был осуществлен пилотный проект – оценка воздействия препарата Канефрон Н на рост бактериальных биопленок на примере грамотрицательных микроорганизмов (Echerichia сoli 132) из коллекции штаммов, выделенных у пациентов с ИМС. Электронно-микроскопическое исследование влияния Канефрона Н проводили на модели биопленок, разработанной при выращивании бактерий на мясо-пептонном агаре [17]. Ультраструктурные изменения в клетках и в архитектонике бактериальных биопленок, подвергнутых воздействию Канефрона Н, исследовали двумя различными методами трансмиссионной электронной микроскопии – методом позитивного окрашивания 0,1%-ным водным раствором уранилацетата и методом ультратонких срезов. Препараты просматривали в трансмиссионном электронном микроскопе JEM 100C (JEOL, Япония) при ускоряющем напряжении 100 кВ [18].
Клетки Е. соli в зоне контакта с Канефроном Н (у границы с диском, пропитанным препаратом) подверглись деструктивным изменениям на уровне клеточной стенки, цитоплазматической мембраны и цитоплазмы.
Возник закономерный вопрос: не способен ли Канефрон Н действовать негативным образом на микроорганизмы-симбионты человека? Чтобы ответить на него, была проведена оценка влияния Канефрона Н на рост и развитие биопленок и морфофизиологические свойства пробиотического штамма лактобактерий Lactobacillus fermentum 97, постоянно присутствующих в кишечнике и во влагалище, где являются симбионтами и составляют значительную часть микрофлоры. В результате проведенного исследования зоны подавления роста тест-культур не образовывались, бактерии L. fermentum 97 остались без визуальных морфологических изменений. Таким образом, данные электронно-микроскопического анализа подтверждают эффективность результатов клинического использования Канефрона Н в лечении ИМС у детей.
Клинический опыт лечения детей, многокомпонентный состав и многогранное терапевтическое воздействие препарата при ИМС, возможности Канефрона Н проникать в биопленки E. сoli и тормозить их рост, отсутствие повреждающего действия на микробиоциноз кишечника, хорошая переносимость, отсутствие побочных эффектов даже при длительном применении подтверждают целесообразность назначения Канефрона Н при терапии ИМС у детей.
1. Лукьянов А.В. Инфекции мочевой системы у детей (этиология, механизмы развития, диспансеризация): автореф. дисс. ... докт. мед. наук. Омск, 2005.
2. Письмо Минздравсоцразвития России от 26 января 2007 г. № 567-ВС «Об организации медицинской помощи детям с инфекцией мочевыводящих путей».
3. Гуркин Ю.А. Современный взгляд на сохранение репродуктивного потенциала российских девочек // Современные проблемы детской и подростковой гинекологии в России. Сб. научных трудов V Всероссийской научно-практической конференции. СПб., 2003.
4. www.medlinks.ru.
5. Замятин С.А. Экспертиза качества медицинской помощи при острых инфекциях мочевой системы // Медицина Петербурга. 2009. № 39 (289).
6. Copp H.L., Shapiro D.J., Hersh A.L. National ambulatory antibiotic prescribing patterns for pediatric urinary tract infection, 1998–2007 // Pediatrics. 2011. Vol. 127. № 6. P. 1027–1033.
7. Игнатова М.С. Эволюция представлений о микробно-воспалительных заболеваниях органов мочевой системы // Нефрология и диализ. 2001. № 3 (2). С. 219–227.
8. Юлиш Е.И. Антибиотики в педиатрии: плюсы и минусы // Новости медицины и фармации. 2010. № 310. С. 9–10.
9. Бондаренко В.М. Роль условно-патогенных бактерий при хронических воспалительных процессах различной локализации. Тверь: Триада, 2011.
10. www.ru.wikipedia.org/wiki.
11. Попп М. Доказательная фитотерапия в ежедневной практике детского врача // Эффективная фармакотерапия. 2013. № 2 (14). С. 48–50.
12. Эрман М.В. Нефрология детского возраста. СПб.: СпецЛит, 2010.
13. Борисов В.П., Гордовская Н.Б., Шилов Е.М. Фитотерапия препаратом Канефрон Н в нефрологической практике: настоящее и перспективы (клиническая лекция) // Клиническая нефрология. 2010. № 6. С. 39–42.
14. Naber K.G. Efficacy and safety of the phytotherapeutic drug Canephron® N in prevention and treatment of urogenital and gestational disease: review of clinical experience in Eastern Europe and Central Asia // Res. Rep. Urol. 2013. Vol. 5. P. 39–46.
15. Эрман М.В. Лечение мочевой инфекции у детей (клиническая лекция) // Клиническая нефрология. 2011. № 4. С. 16–19.
16. Beetz R. May we go on with antibacterial prophylaxis for urinary tract infections? // Pediatr. Nephrol. 2006. Vol. 21. № 1. P. 5–13.
17. Рыбальченко О.В., Бондаренко В.М., Добрица В.П. Атлас ультраструктуры микробиоты кишечника человека. СПб.: ИИЦ ВМА, 2008.
18. Эрман М.В., Рыбальченко О.В., Орлова О.Г. и др. Клинический эффект антимикробной терапии мочевой инфекции у детей // Вестник Санкт-Петербургского университета. 2013. Серия 11. Выпуск 4. С. 60–68.
Phytotherapy in treatment of infections of urinary system in children
M.V. Erman
Saint-Petersburg State University
Contact person: Mikhail Vladimirovich Erman, erman_mv@hotbox.ru
Urinary tract infections (UTI) are one of the most common childhood pathologies. A major problem of clinical practice is the formation of bacterial biofilms which reduce the effect of antibiotics. The lecture discusses the problems of modern herbal medicine and its role in the treatment of place UTI in children. The article proves the efficiency of clinical results with using the phytomedicine Canephron N that confirms feasibility of its use in the treatment of UTI in children.
Новости на тему
11.09.2013
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.