Препараты интерферона получили широкое распространение в отечественном здравоохранении. Не так давно российский фармацевтический рынок пополнился новым оригинальным препаратом Альгерон (цепэгинтерферон альфа-2b). Вопросам эффективности и безопасности этого препарата в подавлении репродукции вируса гепатита С у больных хроническим гепатитом С, а также возможностям препарата Генферон лайт в комплексной терапии острых кишечных инфекций и инфекционного мононуклеоза был посвящен симпозиум «Интерферонотерапия в лечении актуальных вирусных инфекций», организованный компанией BIOCAD (Москва, 25 марта 2014 г.).

Профессор И.П. Баранова

Рис. 1. Динамика клинических проявлений через месяц после завершения лечения (р < 0,05)

Профессор О.О. Знойко
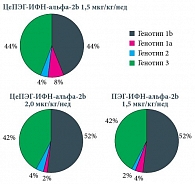
Рис. 2. Распределение генотипов вируса гепатита C
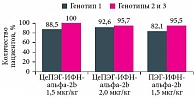
Рис. 3. Частота достижения раннего вирусологического ответа в зависимости от генотипа вируса гепатита C
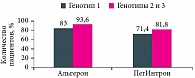
Рис. 4. Достижение непосредственного вирусологического ответа в зависимости от генотипа вируса гепатита C
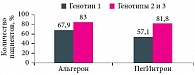
Рис. 5. Достижение устойчивого вирусологического ответа в зависимости от генотипа вируса гепатита C

Д.м.н. Е.Р. Мескина
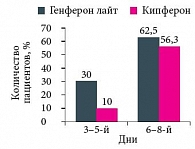
Рис. 6. Частота вирусологической санации
Современные особенности течения и новые возможности терапии инфекционного мононуклеоза
Инфекционный мононуклеоз является полиэтиологичным заболеванием, обусловленным вирусами семейства герпесов с преобладанием вируса Эпштейна – Барр. Как отметила заведующая кафедрой инфекционных болезней Пензенского института усовершенствования врачей Минздрава России, д.м.н., профессор Ирина Петровна БАРАНОВА, инфицированность вирусом Эпштейна – Барр достаточно высока. По данным сероэпидемиологических исследований, почти у 95% населения старше 40 лет выявляются специфические антитела к этому вирусу, около 50% населения переносят данную инфекцию в детском или подростковом возрасте. Вирус Эпштейна – Барр является представителем онкогенных ДНК-содержащих вирусов. Доказано его участие в развитии лимфомы Беркитта, назофарингеальной карциномы, волосатой лейкоплакии.
Распространенность цитомегаловируса, другого часто выявляемого этиологического фактора инфекционного мононуклеоза, также чрезвычайно высока. Например, в разных странах уровень серопозитивных лиц колеблется в пределах 25–95%, а в первые пять лет жизни у детей частота положительных серологических маркеров цитомегаловируса достигает 60%.
По словам докладчика, несмотря на выраженность клинических проявлений, открытыми остаются вопросы своевременной клинической диагностики. «Проведенный нами анализ направительных диагнозов у больных инфекционным мононуклеозом при госпитализации показал, что неправильные диагнозы на амбулаторном этапе не редкость. Инфекционный мононуклеоз был диагностирован только в 38% случаев. В остальных случаях направительными диагнозами стали острый тонзиллит, острые респираторные вирусные инфекции, отек Квинке, токсико-аллергические реакции, лихорадки неясного генеза, гастроэнтериты, лимфаденопатия, скарлатина и даже вирусный гепатит», – отметила профессор И.П. Баранова.
Трудности диагностики и лечения послужили основанием для проведения собственного исследования. Его целью стали определение клинических особенностей инфекционного мононуклеоза в зависимости от этиологии заболевания, возраста и пола пациентов, обоснование алгоритма ранней диагностики, оценка терапевтической эффективности применения препарата Генферон лайт.
Критерий включения в исследование: госпитализированные больные инфекционным мононуклеозом, этиологически подтвержденным данными клинико-лабораторного исследования (270 пациентов с острым инфекционным мононуклеозом, 10 – с обострением хронического инфекционного мононуклеоза).
Критерии исключения: инфекционный мононуклеоз неуточненной этиологии, наличие микст-инфекций и тяжелых соматических заболеваний.
Серологическую диагностику выполняли методом иммуноферментного анализа (ИФА) с определением в крови маркеров вируса Эпштейна – Барр (ВЭБ) и цитомегаловирусной инфекции (ЦМВ), с помощью полимеразной цепной реакции (ПЦР) – ДНК-ВЭБ, ДНК-ЦМВ и иммунологические показатели. Проводились и стандартные лабораторно-инструментальные исследования.
В зависимости от этиологии заболевания пациенты были разделены на три группы: первая группа – больные инфекционным мононуклеозом ВЭБ-этиологии (176 пациентов), вторая – ЦМВ-этиологии (46 пациентов) и третья – микст-инфекции (ВЭБ + ЦМВ) (58 пациентов).
Острое начало заболевания с признаками интоксикации отмечалось у 72,8% больных, увеличение размеров лимфоузлов – у 98,6%, тонзиллит по типу лакунарной ангины – у 90,4%, гепатомегалия – у 81,4%, спленомегалия – у 50,4%, затруднение носового дыхания – у 52,3% больных. Реже наблюдались одутловатость лица, экзантема, афтозный стоматит. Осложнения (острый миокардит, пневмония, отит, спленит) встречались у 5,8% больных.
Установлено, что выраженность клинических проявлений инфекционного мононуклеоза зависит от этиологии заболевания (ВЭБ, ЦМВ или ВЭБ + ЦМВ). Так, инфекционный мононуклеоз, вызванный ВЭБ, достоверно чаще сопровождается развитием тонзиллита (по типу лакунарной ангины), изолированным увеличением шейных лимфоузлов, гипертермией, появлением атипичных мононуклеаров у большинства пациентов, развитием гепатита (26,2%) и характеризуется постепенным началом заболевания в 29,2% случаев.
Инфекционный мононуклеоз, вызванный ЦМВ, начинается остро, реже развивается тонзиллит, чаще возникают спленомегалия и лейкоцитоз по сравнению с ВЭБ-инфекцией, реже в крови появляются атипичные мононуклеары и реже, чем при ВЭБ и ВЭБ + ЦМВ, развивается гепатит.
Инфекционный мононуклеоз микст-этиологии (ВЭБ + ЦМВ) имеет выраженную клиническую картину (тонзиллит, генерализованная полилимфаденопатия, гепатоспленомегалия, количество атипичных мононуклеаров в крови > 20%), чаще характеризуется развитием тяжелых форм заболевания, формированием на пике заболевания гепатита с повышением уровня трансаминаз.
В ходе первого этапа исследования было установлено, что развитие инфекционного мононуклеоза связано с возрастными особенностями. Так, у детей первых четырех лет жизни чаще, чем в других возрастных группах (37,2%), определялся инфекционный мононуклеоз ЦМВ-этиологии с характерными клиническими проявлениями заболевания – выраженным затрудненным носовым дыханием, лейкоцитозом.
У детей в возрасте от четырех до семи лет чаще (р < 0,05) наблюдалась ВЭБ-инфекция (76,2%) с манифестными формами заболевания, характерными клиническими симптомами и гематологическими изменениями (атипичные мононуклеары выявлены у 94,6% пациентов).
В старших возрастных группах достоверно чаще развивалась микст-инфекция, тяжелая степень болезни, чаще встречалось поражение печени. Установлено, что риск хронизации инфекции возникает с четырехлетнего возраста и характерен для подростков и взрослых (р < 0,05).
Спектр типичных клинических симптомов и гематологических изменений при инфекционном мононуклеозе не зависит от пола пациентов. Но у лиц мужского пола чаще наблюдалось заболевание тяжелой степени (р < 0,05) с развитием осложнений, достоверно чаще развивался инфекционный мононуклеоз ЦМВ- и микст-этиологии. Для лиц женского пола характерны проявления гепатита (р < 0,05) и развитие хронического течения заболевания.
Таким образом, полученные данные продемонстрировали, что этиология инфекционного мононуклеоза, возраст пациентов и гендерные различия влияют на клинические особенности заболевания, гематологические и биохимические показатели. Была доказана диагностическая информативность трех опорных клинико-патогенетических синдромов – лимфопролиферативно-тонзиллярного, лимфопролиферативно-паренхиматозного и лимфостатически-эктодермального. С их учетом разработан алгоритм ранней диагностики инфекционного мононуклеоза.
На втором этапе исследования оценивали эффективность рекомбинантного интерферона альфа-2b (Генферон лайт) в терапии инфекционного мононуклеоза.
Профессор И.П. Баранова рассказала об особенностях препарата, подчеркнув, что Генферон лайт отличается оригинальной комбинацией интерферона альфа-2b в уникальных дозах – 125 000 и 250 000 МЕ с таурином, что обеспечивает мощное дополнительное антиоксидантное, противовоспалительное и репаративное действие, и имеет оптимизированную для детей форму свечей. Препарат широко используется в педиатрической, инфекционной, урологической и акушерско-гинекологической практике.
Во второй части исследования приняли участие 84 пациента в возрасте от четырех до семи лет. Они были разделены поровну на две группы. Первую (основную) группу составили 25 мальчиков и 17 девочек, которые получали в составе комплексной терапии Генферон лайт по одному суппозиторию ректально два раза в сутки с 12-часовым интервалом в течение пяти дней. Во вторую группу (сравнения) вошли 24 мальчика и 18 девочек, которые не получали противовирусной терапии. Группы были сопоставимы по возрасту, полу, клиническим проявлениям заболевания и характеру базовой терапии.
Результаты исследования показали хорошую эффективность препарата Генферон лайт в терапии инфекционного мононуклеоза. У пациентов первой группы продолжительность лихорадки и симптомов интоксикации была ниже (4,6 дня), а проявления тонзиллита купировались быстрее (5,2 дня), чем у пациентов второй группы (5,8 и 5,9 дня соответственно). К моменту выписки из стационара у детей, получавших Генферон лайт, определялось достоверно значимое уменьшение размеров лимфатических узлов, селезенки и печени по сравнению с детьми, не получавшими этот препарат.
При оценке отдаленных результатов лечения препаратом Генферон лайт у детей первой группы отмечено уменьшение лимфаденопатии в 92,9% случаев (во второй группе – 80,9%), размер селезенки соответствовал норме у 72,2% пациентов (во второй группе – у 52,4%) (рис. 1).
Нормализация иммунорегуляторного индекса наблюдалась у 62,5% детей из группы Генферона лайт, у 37,5% пациентов из группы сравнения.
Отмечалась также хорошая переносимость препарата Генферон лайт. Осложнений, болезненности и других местных реакций при использовании свечей не было.
Полученные в ходе исследования результаты позволили профессору И.П. Барановой сделать вывод, что включение препарата Генферон лайт в комплексную терапию инфекционного мононуклеоза способствует быстрому уменьшению клинических проявлений, нормализации показателей гемограммы, сокращению средней длительности пребывания больных в стационаре, достижению иммунокорригирующего эффекта. «По нашим данным, Генферон лайт безопасен, не вызывает побочных реакций и в форме ректальных суппозиториев может быть рекомендован для лечения пациентов с инфекционным мононуклеозом», – подчеркнула профессор И.П. Баранова в заключение.
Первый российский оригинальный препарат пегилированного интерферона альфа Альгерон в терапии хронического гепатита С
Согласно общепризнанным стандартам терапией первой линии хронического гепатита C (ХГС) считается назначение пегилированного интерферона (ПЭГ-ИФН) в комбинации с рибавирином. Профессор Московского медико-стоматологического университета им. А.И. Евдокимова, д.м.н. Ольга Олеговна ЗНОЙКО посвятила свой доклад анализу эффективности и безопасности нового оригинального лекарственного средства – цепэгинтерферона альфа-2b, выпускаемого под торговым названием Альгерон.
Клинические исследования Альгерона I фазы позволили изучить его фармакокинетические и фармакодинамические свойства и определить диапазон терапевтических доз. Результаты исследований подтвердили способность препарата поддерживать эффективную концентрацию интерферона и неоптерина на протяжении 168 часов. Профиль безопасности цепэгинтерферона альфа-2b аналогичен таковому других пегилированных интерферонов альфа. Серьезные нежелательные явления при введении Альгерона в дозах, достигающих 3 мкг/кг, отсутствуют. Определены возможные терапевтические дозы препарата – 1,5 и 2,0 мкг/кг/нед, эффективность которых была изучена в последующих исследованиях.
Профессор О.О. Знойко акцентировала внимание участников симпозиума на результатах исследований II и III фазы, в которых участвовали специалисты крупнейших российских исследовательских центров Москвы, Санкт-Петербурга, Смоленска и Казани. Это было многоцентровое рандомизированное открытое исследование эффективности и безопасности применения Альгерона в дозах 1,5 и 2,0 мкг/кг и зарубежного ПЭГ-ИФН-альфа-2b с рибавирином в рамках комбинированной терапии ХГС с последующим определением терапевтической дозы Альгерона.
В исследовании участвовали 150 взрослых пациентов в возрасте 18–70 лет, инфицированные генотипами 1–3 вируса гепатита С (ВГС), ранее не получавших для лечения ХГС препараты ИФН, с компенсированной функцией печени. Распределение пациентов проводили по четырем признакам – возрасту, полу, генотипу ВГС и вирусной нагрузке. По мнению профессора О.О. Знойко, исходный уровень вирусной нагрузки – один из наиболее важных прогностических факторов ответа на противовирусную терапию (ПВТ). При рандомизации пациенты были равномерно распределены по группам с высокой вирусной нагрузкой (1/3 пациентов в каждой группе) и низкой (2/3 пациентов).
Участники исследования были распределены на три группы по 50 пациентов в каждой (две основные и одна сравнения). В первой (основной) группе пациенты получали Альгерон в дозе 1,5 мкг/кг один раз в неделю подкожно в комбинации с ежедневным приемом рибавирина перорально в суточной дозе 800–1400 мг в зависимости от массы тела. Пациенты второй (основной) группы принимали Альгерон в дозе 2,0 мкг/кг один раз в неделю подкожно в комбинации с ежедневным приемом рибавирина перорально в суточной дозе 800–1400 мг в зависимости от массы тела. В третьей группе (сравнения) пациенты получали препарат ПЭГ-ИФН-альфа-2b в дозе 1,5 мкг/кг один раз в неделю подкожно в комбинации с ежедневным приемом рибавирина перорально в суточной дозе 800–1400 мг в зависимости от массы тела.
После 12 недель лечения оценивали эффективность терапии (частоту достижения быстрого вирусологического ответа (БВО) после четырех недель и раннего вирусологического ответа (РВО) после 12 недель) по данным ПЦР сыворотки крови на ВГС РНК. По условиям протокола при отсутствии у пациентов вирусологического ответа через 12 недель ПВТ отменяли и пациенты выбывали из исследования.
«Определение принадлежности ВГС к конкретному субтипу в данном исследовании и частота встречаемости изолятов вируса гепатита С подтверждают известные данные о тотальном преобладании подтипа 1b в популяции российских пациентов, инфицированных генотипом 1 ВГС. Генотипическая структура вируса гепатита С, отличного от генотипа 1, показала доминирование генотипа 3», – уточнила докладчик (рис. 2).
Таким образом, в первой основной группе генотипы 1b и 3 наблюдались у одинакового количества больных (44 и 44% соответственно), во второй основной группе генотип 1b зарегистрирован у 52% пациентов, генотип 3 – у 42%. В третьей группе отмечалась аналогичная тенденция: генотип 1b – у 52% больных, генотип 3 – у 42%.
Как известно, ответ на терапию ИФН и рибавирином у больных ХГС обусловлен генетически и зависит от полиморфизма интерлейкина-28В (ИЛ-28В). Наиболее изучены два варианта полиморфизма – rs12979860 (замена цитозина тимином, С > Т) и rs8099917 (замена тимина гуанином, Т > G). Анализ различных генотипов ИЛ-28В среди всех пациентов показал преобладание носителей аллелей Т/С в регионе rs12979860 (50%) и преобладание благоприятных прогностических вариантов Т/Т и Т/G в регионе rs8099917. По предсказательной эффективности терапии эти варианты полиморфизма были распределены в группах равномерно.
Сравнительный анализ частоты достижения БВО после четырех недель терапии не выявил статистически достоверных различий между группами: в первой группе БВО регистрировали в 64% случаев, во второй – в 56%, в третьей – в 66% случаев.
Анализ частоты РВО через 12 недель терапии в зависимости от генотипа вируса также не выявил статистических различий в группах (рис. 3).
В первой группе РВО отмечен у 100% пациентов с генотипом 2 или 3 и у 88,5% с генотипом 1, во второй – у 95,7% с генотипами 2 и 3 и у 92,6% с генотипом 1. В третьей группе частота РВО у пациентов с генотипами 2 и 3 составила 95,5%, с генотипом 1 – 82,1%.
Исходя из полученных результатов, свидетельствовавших об отсутствии разницы в эффективности терапии в течение 12 недель (достижение БВО, РВО, биохимического ответа), а также более благоприятного профиля безопасности меньшей дозы исследуемого препарата была выбрана оптимальная терапевтическая доза Альгерона 1,5 мкг/кг/нед.
Затем пациенты двух основных групп стали получать оптимальную дозу Альгерона до окончания курса лечения. Непосредственный вирусологический ответ (НВО) на момент окончания лечения и устойчивый вирусологический ответ (УВО) через 24 недели после завершения лечения оценивались у пациентов первой и второй групп совместно (рис. 4 и 5).
НВО регистрировали у 93,6% пациентов с генотипами 2 и 3, принимавших Альгерон, и у 81,8% – в группе сравнения. У инфицированных генотипом 1 из группы Альгерона НВО наблюдали в 83% случаев, а в группе сравнения – в 71,4%.
УВО был достигнут у 83% пациентов, инфицированных генотипами ВГС 2 и 3 и принимавших Альгерон, а в группе сравнения – у 81,8%. Среди пациентов с генотипом 1 УВО отмечался у 67,9 и 57,1% больных соответственно.
Таким образом, сравнительный анализ частоты достижения вирусологических ответов, оцениваемых через четыре, 12 недель, на момент окончания терапии и через 24 недели после ее завершения, продемонстрировал отсутствие достоверно значимых различий между больными ХГС, принимавшими Альгерон, и пациентами, получавшими терапевтическое лечение ПЭГ-ИФН-альфа-2b.
Оценка переносимости проводимой терапии позволила сделать вывод, что профиль безопасности использования Альгерона в целом аналогичен таковому ПЭГ-ИФН-альфа-2b. На основании комплексной оценки показателей эффективности и безопасности была определена оптимальная терапевтическая доза Альгерона – 1,5 мкг/кг/нед.
Профессор О.О. Знойко сделала следующие выводы:
- применение цепэгинтерферона альфа-2b (Альгерона) в комбинации с рибавирином в дозе 800–1400 мг/сут в рамках терапии ХГС у ранее не леченных пациентов характеризуется высокой эффективностью и позволяет достигать УВО у 67,9% больных с генотипом 1 и у 83% пациентов с генотипами 2 и 3;
- статистически значимых различий по данным параметрам с препаратом сравнения ПЭГ-ИФН-альфа-2b не выявлено;
- использование цепэгинтерферона альфа-2b (Альгерона) характеризуется приемлемым профилем безопасности и наличием характерных для интерферонов нежелательных явлений;
- выраженность и частота развития нежелательных явлений в целом сопоставимы с таковыми ПЭГ-ИФН-альфа-2b.
В заключение докладчик представила рекомендуемый режим применения цепэгинтерферона альфа-2b (Альгерона) в терапии ранее не леченных больных ХГС:
- пациентам, инфицированным генотипом ВГС 1, – цепэгинтерферон альфа-2b (Альгерон) 1,5 мкг/кг/нед + рибавирин 800–1400 мг/сут в течение 48 недель;
- пациентам, инфицированным генотипами 2 и 3, – цепэгинтерферон альфа-2b (Альгерон) 1,5 мкг/кг/нед + рибавирин 800–1400 мг/сут в течение 24 недель.
Интерферонотерапия при острых кишечных инфекциях у детей
Изменение этиологической структуры острых кишечных инфекций (ОКИ), связанное прежде всего с ростом удельного веса вирусных инфекций в общей структуре ОКИ, а также с преобладанием в структуре бактериальных инфекций сальмонеллезов и кампилобактериоза при стабильных показателях заболеваемости, ставит перед врачами-инфекционистами все более сложные задачи. По словам исполняющей обязанности заведующей детским инфекционным отделением Московского областного научно-исследовательского клинического института им. М.Ф. Владимирского, д.м.н. Елены Руслановны МЕСКИНОЙ, согласно теории «исчезающей микробиоты» в ближайшее время высока вероятность модификации иммунного ответа на инфекционный процесс.
На современном этапе в странах с развитой экономикой и умеренным климатом, в том числе в России, наблюдается тенденция к снижению удельного веса инфекций, вызванных высоковирулентными возбудителями, и увеличению инфекций, вызванных слабовирулентными возбудителями, резистентными к широкому спектру антибактериальных средств.
«К сожалению, до настоящего времени сохраняется практика использования антибактериальной терапии при водянистой диарее. По нашим данным, в Московской области частота необоснованного назначения антибактериальной терапии детям с водянистой диареей в период сезонного подъема заболеваемости вирусными инфекциями достигает 40%. Между тем частота подтвержденной методом ПЦР вирусной этиологии водянистой диареи у госпитализированных в стационар детей составляет 96% в зимне-весенний сезон и 80% – в летний», – констатировала докладчик.
У детей с неотягощенным преморбидным состоянием при назначении правильного дозированного питания, безлактозной диеты и пробиотиков диарея при ротавирусной инфекции длится в среднем полтора – три дня и в большинстве случаев купируется к пятому дню терапии. Однако в клинической практике все чаще наблюдается увеличение числа детей с ОКИ и отягощенным преморбидным состоянием. В целом за последние 15–20 лет у госпитализированных в стационар детей с ОКИ частота регистрации отягощенного преморбидного состояния возросла на 40% и достигла 100%. Как показывает практика, у таких детей существенно выше выраженность диарейного и болевого синдромов. Даже при небольшой репликации вирусов за счет осмотического компонента диареи могут наблюдаться значительные потери воды и электролитов. Причем пролонгированная диарея (более семи дней) обусловлена или осмотическим фенотипом диареи, или активацией бактериальной флоры.
По данным Е.Р. Мескиной, независимо от преморбидного состояния вирусная диарея вызывает активацию бактериального роста. У детей с отягощенным преморбидным состоянием это усугубляет функциональные нарушения желудочно-кишечного тракта, способствует обострению хронической патологии, углубляет фоновые дисбиотические и иммунные нарушения, провоцирует развитие синдрома избыточного бактериального роста в тонкой кишке и длительное восстановление эпителия. В конечном итоге на 35–46% повышается вероятность развития острых респираторных инфекций в период реконвалесценции.
В соответствии с прогностическим принципом лечения ОКИ, определяющим возможную продолжительность заболевания и его исходы, пациентам с отягощенным преморбидным состоянием в остром периоде ОКИ показана иммунотропная терапия, прежде всего для минимизации неблагоприятных последствий инфекционного процесса, повышения иммунного контроля бактериального роста в кишечнике.
По мнению Е.Р. Мескиной, среди иммунотропных препаратов наиболее эффективен и безопасен препарат рекомбинантного интерферона альфа-2b Генферон лайт. «Препарат обладает доказанным хорошим спектром биологического действия – противовирусным, противомикробным, антипролиферативным, иммуномодулирующим и радиопротекторным. Именно поэтому мы отдаем ему предпочтение», – пояснила она.
У детей уровень сывороточного ИФН и способность к продукции ИФН-альфа и ИФН-гамма ниже, чем у взрослых. Между тем снижение способности клеток к интерферонообразованию считается фактором риска развития тяжелых инфекций. Вот почему препараты интерферона разрешены к применению у детей любого возраста. При их назначении врач должен учитывать, что действие интерферона разнонаправленное, препарат обладает дозозависимым эффектом, однако достаточная иммунотропная активность достигается при небольших терапевтических дозах. Кроме того, ректальное введение экзогенного интерферона способствует более длительной его циркуляции в организме и позволяет избегать классических нежелательных явлений, наблюдаемых при парентеральном введении.
Оптимальным выбором для иммунотропной терапии, по словам докладчика, является препарат Генферон лайт, произведенный по стандартам GMP (Good Manufacturing Practice – надлежащая производственная практика). Препарат содержит 125 000 и 250 000 МЕ интерферона рекомбинантного альфа-2b, а также 0,005 г таурина. Таурин усиливает иммунные реакции, отличается противовоспалительной активностью, осморегулирующим, антиоксидантным действием и повышает устойчивость клеток.
Повышенная эффективность ИФН-альфа-2b в комплексе с таурином пролонгирует действие интерферона, а высокая безопасность препарата Генферон лайт, отсутствие побочных явлений, возможность точного дозирования по возрасту ребенка, удобство суппозиторной формы сделали его одним из наиболее востребованных в педиатрической практике иммунотропных средств.
Показания к назначению препарата Генферон лайт:
- острые респираторные инфекции;
- ОКИ;
- инфекционные заболевания вирусной этиологии;
- инфекционно-воспалительные заболевания урогенитального тракта у детей и беременных.
Е.Р. Мескина озвучила результаты открытого сравнительного рандомизированного проспективного исследования безопасности и эффективности препарата Генферон лайт и препарата сравнения (Кипферон) в суппозиториях при лечении ОКИ предположительно вирусной этиологии у детей.
Исследование проводили на двух базах – в Центральном НИИ эпидемиологии Роспотребнадзора и детской городской клинической больнице Святого Владимира г. Москвы. Целью исследования стала оценка эффективности и безопасности применения препарата Генферон лайт (ЗАО «Биокад», Россия) в составе комплексной терапии ОКИ вирусной этиологии у детей. Конечной точкой безопасности считалась частота нежелательных явлений, конечной точкой эффективности – динамика регресса клинических симптомов ОКИ вирусной этиологии, элиминация возбудителя, а также течение периода реконвалесценции (30 дней после выписки из стационара).
В исследование были включены 100 детей в возрасте от шести месяцев до шести лет, госпитализированных в стационар с кишечной инфекцией предположительно вирусной этиологии в первые два дня болезни (не позднее 48 часов от начала заболевания). Представители детей дали информирование согласие на их участие в исследовании.
Критериями исключения стали применение препаратов интерферона и индукторов интерферона до исследования, тяжелая форма болезни и тяжелые сопутствующие патологии. Из анализа результатов исследования были исключены данные двух пациентов (2%) по причине нарушения правил протокола (назначение других иммуномодуляторов) в одном случае и по причине досрочного выбывания (добровольный отказ родителей от участия в исследовании после третьего дня от начала терапии вследствие улучшения самочувствия ребенка) в другом.
Дети были рандомизированы методом «конвертов» на две сопоставимые по возрасту, фоновой патологии и клиническим проявлениям группы. Основную группу составили 49 пациентов (средний возраст 16 месяцев), получавших в течение пяти дней Генферон лайт в дозе 125 000 МЕ два раза в сутки вместе со стандартной терапией. В группу сравнения вошли 49 пациентов (средний возраст 10 месяцев), принимавших в течение пяти дней Кипферон в дозе 500 000 МЕ два раза в сутки вместе со стандартной терапией (оральная регидратация, безлактозная диета, сорбенты и проч.).
Диагностика вирусной ОКИ методом ПЦР показала преобладание ротавирусной инфекции (53,1%). Кроме того, имели место норовирусная (5,1%) и аденовирусная инфекции (3,1%), микст-вирусные (6,1%) и вирусно-бактериальные микст-инфекции (3,6%), кишечная коли-инфекция (3,5%).
Анализ частоты регистрации лихорадки и потребности в инфузионной терапии не выявил различий в группах. Анализ частоты патологического процесса к шестому дню терапии также продемонстрировал одинаковую хорошую эффективность двух препаратов. В то же время оценка частоты вирусологической санации в течение первых трех – пяти дней терапии показала более высокую эффективность препарата Генферон лайт по сравнению с Кипфероном (30% против 10% соответственно). Хотя позднее (на шестые – восьмые стуки) вирусологическая санация была высокой в обеих группах: в группе Генферона – 62,5%, в группе Кипферона – 56,3% (рис. 6).
В периоде реконвалесценции в течение 30 дней после выписки из стационара в группе, получавшей Генферон лайт, было зарегистрировано два случая острой респираторной инфекции, а в группе, получавшей Кипферон, – один случай острой респираторной инфекции и один случай норовирусной кишечной инфекции. В целом отмечено благоприятное течение периода реконвалесценции.
«Таким образом, подтверждена терапевтическая эффективность Генферона лайт. Она аналогична таковой препарата, содержащего в три раза более высокую дозу интерферона. Кроме того, подтверждена безопасность Генферона лайт, на фоне применения которого отсутствовали аллергические реакции, в том числе у включенных в исследование больных с отягощенным аллергоанамнезом и атопическим дерматитом. Следует отметить, что препарат удобно дозирован. Это особенно важно при использовании у детей первого года жизни», – подчеркнула Е.Р. Мескина. В заключение она представила схему применения Генферона лайт при ОКИ. Препарат назначается по одному суппозиторию (125 000 МЕ) два раза в сутки:
- в остром периоде ОКИ (в стартовой комплексной терапии) – при тяжелых формах ОКИ – 7–10 дней, при среднетяжелых формах вирусной ОКИ – 5 дней, при среднетяжелых формах бактериальной ОКИ – 7 дней;
- при недостаточной эффективности лечения (вторым курсом) – в течение 7–10 дней;
- при вирусных и бактериальных инфекциях – 10 дней.
Для повышения доступности препаратов пегилированного интерферона в терапии ХГС компания BIOCAD разработала оригинальное лекарственное средство Альгерон (цепэгинтерферон альфа-2b). В отличие от других пегилированных ИФН-альфа Альгерон состоит из одного позиционного изомера, к которому присоединен полиэтиленгликоль с молекулярной массой 20 кДа. Представленные в рамках симпозиума результаты исследования свидетельствуют о высокой эффективности и безопасности Альгерона в подавлении репродукции вируса гепатита С и позволяют рекомендовать его ранее не леченным больным ХГС в дозе 1,5 мкг/кг/нед в течение 24–48 недель.
Хорошей доказательной базой обладает еще один препарат компании Генферон лайт, в состав которого входят рекомбинантный интерферон альфа-2b (125 000 и 250 000 МЕ) и таурин (0,005 г). Препарат характеризуется выраженным терапевтическим эффектом при благоприятном профиле безопасности, мощным репаративным и антиоксидантным действием, высоким качеством производства по стандартам GMP. Кроме того, препарат выпускается в удобной для детей форме – свечи, его легко дозировать в зависимости от возраста ребенка. Эти преимущества позволяют назначать Генферон лайт детям раннего возраста в стартовой комплексной терапии острого периода ОКИ и инфекционного мононуклеоза.



