Исследование КАМЕЛИЯ: сравнительная оценка безопасности и эффективности Кратковременного применения Ацеклофенака и МЕЛоксикама у пациентов с вертеброгенными дорсалгИЯми
- Аннотация
- Статья
- Ссылки
- English
Цель исследования: оценка клинической эффективности и безопасности применения двух нестероидных противовоспалительных препаратов, обладающих умеренной селективностью в отношении циклооксигеназы 2: ацеклофенака и мелоксикама – в лечении пациентов с острой вертеброгенной дорсалгией.
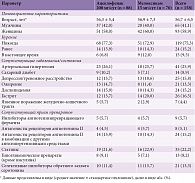
Материал и методы. 158 пациентов с вертеброгенными дорсалгиями (неспецифической болью в нижней части спины) (код M.54 по Международной классификации болезней 10-го пересмотра) рандомизированы на две группы: первая получала ацеклофенак (Аэртал®) 200 мг/сут, вторая – мелоксикам 15 мг/сут. Продолжительность приема определялась индивидуально в зависимости от клинического течения заболевания. Эффективность терапии анализировалась с помощью Цифровой рейтинговой шкалы (Numerical Rating Scale – NRS), опросника Роланда – Морриса (Roland-Morris Disability Questionnaire – RM24), также учитывалась частота хронизации болевого синдрома. Оценка безопасности проводилась путем учета нежелательных явлений.
Результаты. Оба препарата достоверно (р < 0,05) уменьшали выраженность болевого синдрома (по шкале NRS) и увеличивали повседневную активность пациентов (в соответствии с опросником RM24) уже к десятым суткам лечения, при этом достоверных различий в этом отношении между группами не выявлено. Ацелофенак оказывал более быстрый противоболевой эффект (р = 0,043) по сравнению с мелоксикамом и реже приводил к хронизации боли (р = 0,044). Оба препарата обладали сравнимым благоприятным профилем переносимости, за исключением более высокого относительного риска нежелательных явлений со стороны сердечно-сосудистой системы на фоне приема мелоксикама (отношение рисков 3,02, 95%-ный доверительный интервал 1,12–8,16, p = 0,029), главным образом вследствие повышения артериального давления (p = 0,039).
Выводы. Кратковременное (до 30 суток) применение ацеклофенака (препарат Аэртал®) и мелоксикама эффективно и относительно безопасно в лечении пациентов с вертеброгенными дорсалгиями. Между препаратами существуют достоверные различия в отдельных параметрах (более быстрая скорость развития аналгезии у ацеклофенака и более высокая частота хронизации болевого синдрома у мелоксикама) и переносимости (более высокий относительный риск нежелательных явлений со стороны сердечно-сосудистой системы при использовании мелоксикама), что требует уточнения в дальнейших исследованиях.
Цель исследования: оценка клинической эффективности и безопасности применения двух нестероидных противовоспалительных препаратов, обладающих умеренной селективностью в отношении циклооксигеназы 2: ацеклофенака и мелоксикама – в лечении пациентов с острой вертеброгенной дорсалгией.
Материал и методы. 158 пациентов с вертеброгенными дорсалгиями (неспецифической болью в нижней части спины) (код M.54 по Международной классификации болезней 10-го пересмотра) рандомизированы на две группы: первая получала ацеклофенак (Аэртал®) 200 мг/сут, вторая – мелоксикам 15 мг/сут. Продолжительность приема определялась индивидуально в зависимости от клинического течения заболевания. Эффективность терапии анализировалась с помощью Цифровой рейтинговой шкалы (Numerical Rating Scale – NRS), опросника Роланда – Морриса (Roland-Morris Disability Questionnaire – RM24), также учитывалась частота хронизации болевого синдрома. Оценка безопасности проводилась путем учета нежелательных явлений.
Результаты. Оба препарата достоверно (р < 0,05) уменьшали выраженность болевого синдрома (по шкале NRS) и увеличивали повседневную активность пациентов (в соответствии с опросником RM24) уже к десятым суткам лечения, при этом достоверных различий в этом отношении между группами не выявлено. Ацелофенак оказывал более быстрый противоболевой эффект (р = 0,043) по сравнению с мелоксикамом и реже приводил к хронизации боли (р = 0,044). Оба препарата обладали сравнимым благоприятным профилем переносимости, за исключением более высокого относительного риска нежелательных явлений со стороны сердечно-сосудистой системы на фоне приема мелоксикама (отношение рисков 3,02, 95%-ный доверительный интервал 1,12–8,16, p = 0,029), главным образом вследствие повышения артериального давления (p = 0,039).
Выводы. Кратковременное (до 30 суток) применение ацеклофенака (препарат Аэртал®) и мелоксикама эффективно и относительно безопасно в лечении пациентов с вертеброгенными дорсалгиями. Между препаратами существуют достоверные различия в отдельных параметрах (более быстрая скорость развития аналгезии у ацеклофенака и более высокая частота хронизации болевого синдрома у мелоксикама) и переносимости (более высокий относительный риск нежелательных явлений со стороны сердечно-сосудистой системы при использовании мелоксикама), что требует уточнения в дальнейших исследованиях.


Вертеброгенные дорсалгии пояснично-крестцовой локализации – одна из наиболее часто встречающихся медицинских проблем во всем мире. Они имеют колоссальную социальную, психологическую и экономическую значимость [1], поскольку наблюдаются практически во всех возрастных группах и служат наиболее частой причиной нетрудоспособности в различных популяциях [2]. Установлено, что боль в нижней части спины может возникнуть у 15–20% взрослых людей на протяжении года, а вероятность развития хотя бы одного острого эпизода вертеброгенной дорсалгии в течение всей жизни составляет 50–80% [3].
В подавляющем большинстве случаев (81–95%) клинические проявления заболевания тотально регрессируют в достаточно короткие сроки (несколько недель), и лишь у небольшой части пациентов (5–19%) болевой синдром сохраняется дольше 12 недель [4]. Однако ввиду огромного абсолютного числа пациентов с болью в нижней части спины общее количество больных с хроническим течением вертеброгенной дорсалгии достаточно внушительно.
Стратегии лечения пациентов с вертеброгенной дорсалгией значительно варьируются. Например, США намного опережают другие государства по доле оперативных вмешательств и назначению наркотических аналгетиков [5, 6]. В большинстве стран стратегия ведения пациентов с вертеброгенной дорсалгией заключается в следующем:
- дифференциация пациентов в зависимости от типа боли: неспецифическая (костно-мышечная или миофасциальная) боль, радикулопатия и алгический синдром, вероятно вызванный серьезной патологией;
- скрининг пациентов с вероятной серьезной патологией, основанный на поиске так называемых красных флажков;
- обязательный неврологический осмотр с оценкой двигательной и чувствительной сфер, а также использованием специфических тестов (Ласега, Спурлинга);
- исключение психогенного генеза клинических симптомов (так называемые желтые флажки) при отсутствии какого-либо эффекта от инициального лечения;
- применение современных методов нейровизуализации (компьютерной и магнитно-резонансной томографии) только в случаях, когда ожидается, что полученный результат может повлиять на тактику лечения и соответственно исход терапии.
К лекарственным средствам, наиболее часто назначаемым при вертеброгенной дорсалгии, относятся нестероидные противовоспалительные препараты (НПВП). Согласно последнему Кохрейновскому метаанализу результатов исследований, посвященных оценке эффективности НПВП при боли в области нижней части спины, прием НПВП оказался более эффективен, чем плацебо, в отношении уменьшения выраженности болевого синдрома и снижения периода временной нетрудоспособности [7]. При этом не получено достоверного различия в терапевтической эффективности различных типов НПВП. По вопросу безопасности их применения (в том числе долгосрочного) к каким-либо четким выводам авторам работы прийти не удалось. Тем не менее в последнее время накопилось достаточно убедительных данных, которые позволяют сделать несколько выводов.
Во-первых, прием НПВП ассоциирован с широким спектром побочных эффектов [8].
Во-вторых, предпочтительный выбор того или иного препарата из группы НПВП не должен основываться на коэффициенте его селективности к циклооксигеназе (ЦОГ) 2, который рассчитывается in vitro как соотношение ЦОГ-1/ЦОГ-2 значений 50%-ной ингибирующей концентрации (IC50). Полученный таким образом показатель абсолютно не отражает реальную степень ингибирования данных ферментов in vivo при приеме того или иного НПВП. В этой связи целесообразно использовать более наглядный параметр – степень абсолютного избирательного воздействия препарата отдельно на ЦОГ-1 и ЦОГ-2, которая устанавливается in vivo на добровольцах, что позволяет рассчитать достигаемую селективность к ЦОГ-1/ЦОГ-2 для любого НПВП. Важно отметить, что достигаемая селективность напрямую зависит от дозы, поэтому у одного и того же препарата может кардинально отличаться выраженность побочных эффектов [9]. При этом чем выше степень реального ингибирования ЦОГ-1 (а не значение рассчитанного in vitro коэффициента ЦОГ-1/ЦОГ-2 IC50, свидетельствующего о преимущественном действии препарата на ЦОГ-1), тем выше риск гастроинтестинальных осложнений, и соответственно чем выше степень ингибирования ЦОГ-2, тем выше риск сердечно-сосудистых осложнений. Однако при достижении абсолютного ингибирования ЦОГ-1 выше 95% у препарата появляется протективный эффект в отношении кардио- и цереброваскулярных осложнений, что было продемонстрировано при использовании высоких доз напроксена [10]. Диклофенак (75 мг два раза в день), который относится к «старым» традиционным неселективным НПВП и соответственно ассоциируется с высоким риском гастроинтестинальных осложнений, обладает гораздо меньшей степенью селективности к ЦОГ-2 по сравнению, например, с целекоксибом (200 мг два раза в день) или эторикоксибом (90 мг один раз в день) (при расчете in vitro ЦОГ-1/ЦОГ-2 IC50). А в абсолютном значении (достигаемая селективность) диклофенак ингибирует ЦОГ-2 на 93,9% (больше, чем целекоксиб и эторикоксиб), что обусловливает высокий риск сердечно-сосудистых нежелательных явлений при его применении [9, 11].
Таким образом, представляется актуальным выявить преимущества и недостатки близких по свойствам НПВП в клинической практике.
Цель исследования
Сравнительная оценка клинической эффективности и безопасности ацеклофенака (Аэртал®) и мелоксикама в комплексном лечении пациентов с острой вертеброгенной дорсалгией.
Материал и методы
В открытом наблюдательном проспективном когортном исследовании приняло участие 186 пациентов с ведущей жалобой на боль в нижней части спины, соответствующих следующим критериям включения:
- верифицированный диагноз вертеброгенной дорсалгии пояснично-крестцовой локализации (M.54 по Международной классификации болезней 10-го пересмотра);
- возраст старше 18 лет;
- болевой синдром продолжительностью не более семи дней.
Критерии исключения:
- противопоказания к приему ацеклофенака и мелоксикама:
- эрозивно-язвенные поражения желудочно-кишечного тракта в фазе обострения;
- желудочно-кишечное кровотечение в анамнезе или подозрение на него;
- указания в анамнезе на бронхоспазм, крапивницу, ринит после приема ацетилсалициловой кислоты или других НПВП (полный или неполный синдром непереносимости ацетилсалициловой кислоты – риносинусит, крапивница, полипы слизистой оболочки носа, бронхиальная астма);
- ранний период (до трех месяцев) после аортокоронарного шунтирования;
- выраженная печеночная недостаточность или активное заболевание печени;
- нарушения кроветворения и коагуляции;
- выраженная почечная недостаточность, прогрессирующие заболевания почек;
- подтвержденная гиперкалиемия;
- беременность;
- период лактации (грудное вскармливание);
- недавно перенесенные цереброваскулярные кровотечения;
- болезнь Крона или язвенный колит в стадии обострения;
- выраженная неконтролируемая сердечная недостаточность;
- ишемическая болезнь сердца;
- дефицит сахаразы/изомальтазы, непереносимость фруктозы, глюкозо-галактозная мальабсорбция;
- фенилкетонурия;
- радикулопатия;
- невозможность вербального контакта с пациентом, балльной оценки эффективности лечения (вследствие деменции, психических заболеваний и т.д.);
- использование глюкокортикоидов в течение ближайшего месяца до начала исследования;
- применение симптоматических противовоспалительных препаратов замедленного действия для лечения остеоартроза (Symptomatic Slow-Acting Drugs in Osteoarthritis – SYSADOA) в период исследования;
- известная специфическая причина боли невертеброгенной природы (новообразование, герпетический ганглионеврит, вирус иммунодефицита человека, травма и проч.);
- химиотерапия по поводу онкологического заболевания в течение последних пяти лет.
Все пациенты стратифицированы на две равноценные группы: первой группе был назначен ацеклофенак (Аэртал®) в виде порошка по 200 мг, второй – мелоксикам в виде таблеток по 15 мг. Продолжительность приема НПВП определялась индивидуально в зависимости от клинического течения заболевания, однако оценка эффективности и переносимости препаратов ограничивалась 30 сутками. Дизайн исследования подразумевал четыре визита: первый – скрининг, и далее еще три визита каждые десять дней в течение первого месяца. В случае сохранения болевого синдрома пациент предпринимал еще два визита через два и три месяца от начала лечения. Таким образом, общая длительность периода наблюдения составила 90 дней.
Эффективность терапии оценивалась с учетом анализа результатов нескольких опросников и шкал.
- Цифровая рейтинговая шкала (Numerical Rating Scale – NRS), предназначенная для субъективной оценки выраженности боли, получила широкое распространение в связи с легкостью применения, воспроизводимостью и отличной корреляцией с другими инструментами, используемыми с этой же целью [16]. На первом визите выраженность болевого синдрома с помощью NRS оценивалась дважды. Сначала регистрировался исходный уровень интенсивности боли, затем через два часа после принятия первой дозы НПВП пациент по телефону сообщал об инициальном обезболивающем эффекте. Дальнейшее анкетирование выполнялось на визитах согласно протоколу исследования. Изменение результатов шкалы NRS более чем на 20%, фиксируемое на двух временных точках, считалось клинически значимым [17].
- Опросник Роланда – Морриса (Roland-Morris Disability Questionnaire – RM24) – один из инструментов, позволяющих оценить влияние болевого синдрома на повседневную активность пациента.
- Частота хронизации болевого синдрома, выраженная в абсолютных значениях (количество пациентов) и процентах.
- Число больных, которых необходимо лечить (Number-Needed-to-Treat – NNT) – количество пациентов, которым необходимо дать препарат для того, чтобы у одного из них интенсивность болевого синдрома снизилась на 50% через четыре – шесть часов от момента приема лекарства. Данный параметр – один из важнейших для клинической практики, поскольку отражает эффективность противоболевой терапии.
- Продолжительность терапии НПВП (дни) – общая длительность использования препарата. Препарат отменялся на основании субъективной (позиция пациента) и объективной (врачебный осмотр) оценки результатов лечения в случае тотального нивелирования болевого синдрома или увеличения двигательной активности больного и значительного снижения выраженности боли.
Безопасность лечения оценивалась путем анализа частоты нежелательных явлений, возникших в ходе лечения (НЯВЛ), серьезных нежелательных явлений, нежелательных явлений, которые стали причиной отказа от лечения. На всех визитах пациенты проходили физикальный и неврологический осмотр. Кроме того, у 95 больных (48 пациентов в группе ацеклофенака и 47 в группе мелоксикама) можно было оценить результаты электрокардиографии, а также анализов крови (общеклинический анализ, биохимический анализ – уровень аланинаминотрансферазы, глюкозы, мочевины, креатинина, калия, натрия, общего билирубина, креатинфосфокиназы, общего холестерина) и мочи до и после лечения. Все пациенты самостоятельно измеряли артериальное давление дважды в день.
Для статистической обработки данные были внесены в базу, сформированную на основе программного обеспечения Microsoft Excel. Статистический анализ осуществлялся с помощью общепринятых методов из пакета программ SAS 9.4.
Для сравнительного анализа качественных параметров использовали критерии χ2 или Фишера (при малом числе наблюдений). Значимость различий между количественными величинами оценивали по t-критерию Стьюдента (для нормально распределенных величин) или по непараметрическому критерию Манна – Уитни. Расчет относительного риска проводился согласно рекомендациям D.G. Altman (1991) [18]. Различия признавали значимыми при p < 0,05.
Результаты
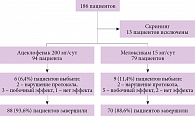
Из 186 пациентов с болью в области нижней части спины после скринингового визита и определения соответствия критериям включения/исключения 173 больных рандомизированы на две группы. В первой группе (n = 94, 54,3%) лечение осуществлялось ацеклофенаком, во второй (n = 79, 45,7%) – мелоксикамом (рис. 1). Вследствие ряда причин 15 (8,7%) пациентов исключены из исследования. Таким образом, статистический анализ и интерпретация полученных результатов выполнялись исходя из общего числа больных 158 человек.
Средний возраст пациентов составил 56,7 ± 6,5 года, большая часть респондентов оказалась женского пола (n = 93, 58,9%). Другие характеристики групп (наличие коморбидных заболеваний, сведения о приеме сопутствующих лекарственных препаратов и др.) приведены в табл. 1.
Эффективность терапии
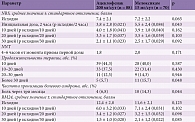
Анализ результатов лечения по шкале NRS показал, что уже на десятые сутки выраженность болевого синдрома достоверно (р < 0,05) снизилась по сравнению с исходным уровнем в обеих группах и в дальнейшем продолжала снижаться (табл. 2). Статистически достоверного различия в отношении интенсивности болевого синдрома между группами начиная с десятых суток терапии и далее зарегистрировано не было. В группе ацеклофенака инициальный эффект (в первые два часа) от приема препарата оказался достоверно (р = 0,043) более выраженным по сравнению с группой мелоксикама.
NNT, рассчитанное для интервала четыре – шесть часов от момента приема первой дозы препарата, в первой группе было недостоверно (р = 0,171) ниже (1,8), чем во второй группе (2,0).
Оценка продолжительности терапии показала, что большинство пациентов завершили прием препаратов к 20-м суткам лечения: в группе ацеклофенака – 72 (81,8%) больных, в группе мелоксикама – 50 (71,4%) больных. Тем не менее пять (5,7%) пациентов первой группы и 11 (15,7%) пациентов второй группы продолжали прием препаратов даже после 30 суток наблюдения ввиду сохраняющегося болевого синдрома (р = 0,048).
Анализ результатов тестирования пациентов по опроснику RM24 не установил достоверного различия между группами по увеличению повседневной активности: у больных обеих групп достоверно (р < 0,05) отмечалось значительное улучшение физического состояния начиная с десятых суток лечения по сравнению с исходным значением, и в дальнейшем эта тенденция сохранялась.
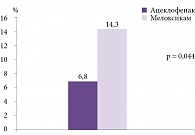
Хронизация болевого синдрома достоверно чаще наблюдалась у больных, принимавших мелоксикам (n = 10), по сравнению с пациентами, получавшими ацеклофенак (n = 4) (р = 0,044) (рис. 2).
В обеих группах зафиксированы случаи неэффективности лечения: один (1,1%) в группе ацеклофенака и два (2,8%) в группе мелоксикама (снижение по шкале NRS < 20%). Эти больные получали НПВП в течение 10–20 суток и отказались от дальнейшего приема препаратов, что послужило поводом к исключению их из исследования. В дальнейшем эти пациенты были направлены на углубленное обследование и подбор индивидуальной терапии.
Безопасность лечения
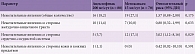
За период наблюдения НЯВЛ отмечены у 35 (22,1%) пациентов, причем в первой группе у трех (3,3%) больных возникшие нежелательные явления стали причиной отказа от дальнейшего лечения, во второй группе таких больных оказалось пять (6,7%) (р = 0,299). Ни одного серьезного нежелательного явления не отмечено. Наиболее часто встречались нежелательные явления со стороны желудочно-кишечного тракта и сердечно-сосудистой системы – по 17 (10,8%) случаев (табл. 3).
Относительный риск развития НЯВЛ (любого вида) в первой группе (здесь и далее эта группа считалась референтной) составил 1,57 (95%-ный доверительный интервал (ДИ) 0,88–2,80) (различия недостоверны, р = 0,175) (табл. 4, рис. 3).
НЯВЛ со стороны желудочно-кишечного тракта. В первой группе боль в животе, диспепсия, диарея наблюдались у десяти (11,4%) пациентов, в то время как во второй группе – у семи (10%). Относительный риск развития НЯВЛ со стороны желудочно-кишечного тракта во второй группе составил 0,80 (95% ДИ 0,32–1,99) (различия не достоверны, р = 0,633) (см. табл. 4).
НЯВЛ со стороны сердечно-сосудистой системы. За все время наблюдения выявлено два варианта НЯВЛ этой категории – повышение артериального давления и появление периферических отеков. При этом повышение артериального давления достоверно чаще отмечалось во второй группе – у семи (10%) больных (в первой группе – у одного (1,1%) больного) (р = 0,039). Относительный риск развития НЯВЛ со стороны сердечно-сосудистой системы во второй группе составил 3,02 (95% ДИ 1,12–8,16) (различия достоверны, р = 0,029) (см. табл. 4).
НЯВЛ со стороны кожи и кожных придатков. Зарегистрирован всего один (1,1%) случай аллергического дерматита за весь период лечения в первой группе (р = 0,591). Относительный риск развития НЯВЛ со стороны кожи и кожных придатков во второй группе составил 0,42 (95% ДИ 0,02–10,10) (различия недостоверны, р = 0,591) (см. табл. 4).
Анализ результатов электрокардиографии, а также ряда параметров крови (общеклинический анализ, биохимический анализ – уровень аланинаминотрансферазы, глюкозы, мочевины, креатинина, калия, натрия, общего билирубина, креатинфосфокиназы, общего холестерина) никаких значимых отклонений в обеих группах не выявил. К моменту окончания терапии у четырех (8,3%) пациентов первой группы и пяти (10,6%) пациентов второй группы зафиксировано незначительное повышение уровня аланинаминотрансферазы в крови (на 10,5 ± 3,4 и 8,9 ± 4,7 Ед/л соответственно) (различия между группами не достоверны, р = 0,135).
Обсуждение результатов
В настоящем открытом наблюдательном исследовании изучены клиническая эффективность и безопасность применения двух препаратов: ацеклофенака и мелоксикама – в лечении пациентов с острой болью в нижней части спины (M.54).
Выбор лекарственных средств не был случайным – они занимают лидирующее место на фармацевтическом рынке Российской Федерации и позиционируются как препараты, обладающие умеренной селективностью в отношении ЦОГ-2 (золотая середина).
Ацеклофенак (Аэртал®) представляет собой производное фенилацетиловой кислоты, то есть близок по строению к диклофенаку. Однако гидроксильная группа в молекуле диклофенака была заменена на карбоксильную у ацеклофенака, что существенно изменило фармакологические свойства препарата. По данным S. Saraf, коэффициент селективности для ацеклофенака составляет 26 [19]. Клинические и эпидемиологические исследования показали, что препарат характеризуется хорошей переносимостью со стороны желудочно-кишечного тракта и сердечно-сосудистой системы [20]. Достоинство ацеклофенака – высокая биодоступность, близкая к 100%. Пиковая концентрация в плазме крови достигается через 75–180 минут после приема внутрь, при этом прием пищи замедляет всасывание препарата, но не влияет на его степень. Важная особенность ацеклофенака для клинической практики – способность проникать в синовиальную жидкость, где его концентрация достигает 60% от содержания в плазме крови.
Помимо основного фармакологического эффекта (блокада ЦОГ) ацеклофенак влияет на синтез важнейших цитокинов, таких как интерлейкин 1 и фактор некроза опухоли. Кроме того, ацеклофенак способен подавлять процесс ассоциированной с интерлейкином 1 активации металлопротеиназ, что наряду с другими факторами обусловливает его положительное воздействие на синтез протеогликанов суставного хряща [21]. В ряде исследований установлено, что ацеклофенак не только не разрушал хрящ (что свойственно для ибупрофена, индометацина, диклофенака), но и способствовал его активному восстановлению, подавляя катаболизм хрящевой ткани [22, 23]. Рекомендуемая доза препарата – 100 мг два раза в сутки (утром и вечером).
Мелоксикам представляет собой производное эноловой кислоты с большим периодом полувыведения: максимальная концентрация (Cmax) в плазме после приема 15 мг достигается через пять-шесть часов, период полувыведения составляет 20–24 часа, поэтому препарат назначают однократно по 7,5 или 15 мг/сут [24]. Около 77% всех продаваемых упаковок приходится на максимальную дозировку – 15 мг [25].
Структурно отличаясь от других ингибиторов ЦОГ-2, например коксибов, мелоксикам вступает в контакт с верхней, а не с боковой частью канала ЦОГ-2. Он практически полностью связывается с белками плазмы (99,5%), а его концентрация в синовиальной жидкости составляет 45–57% от концентрации в плазме [26]. Коэффициент селективности для мелоксикама равен 18 [27], средний процент in vivo ингибирования ЦОГ-2 – 77,5%, а ЦОГ-1 – 53% [28].
Эффективность мелоксикама при лечении больных остеоартрозом сопоставима с таковой ряда традиционных НПВП (диклофенака, пироксикама) [29]. Мелоксикам, вероятно, обладает более благоприятным профилем воздействия на желудочно-кишечный тракт по сравнению с диклофенаком и пироксикамом. Однако однозначно утверждать это некорректно, поскольку такое представление о влиянии мелоксикама на желудочно-кишечный тракт появилось после завершения двух крупных кратковременных (28 дней) исследований – MELISSA и SELECT, где препарат использовался в редкой для него низкой дозе 7,5 мг/сут.
Наше прямое сравнительное исследование – первое в своем роде, где была предпринята попытка оценить эффективность и безопасность кратковременного применения ацеклофенака и мелоксикама в лечении пациентов с вертеброгенной дорсалгией. Помимо кратности приема препараты отличались формой выпуска: ацеклофенак применялся в виде порошка для приготовления суспензии для приема внутрь, а мелоксикам – в виде таблеток.
Исследуемая когорта больных характеризовалась гетерогенностью по возрасту, коморбидным заболеваниям и приему сопутствующих препаратов. Тем не менее удалось рандомизировать пациентов на две группы без достоверных различий в отношении факторов, которые могли бы прямо или косвенно повлиять на исход исследования.
Анализ эффективности
Оба препарата продемонстрировали достаточную эффективность, выражавшуюся в снижении интенсивности болевого синдрома и улучшении повседневной активности у большинства пациентов. Анализ изменений данных по шкале NRS показал, что достоверное снижение интенсивности боли уже к десятым суткам лечения отмечалось в обеих группах, эта тенденция сохранилась и в дальнейшем.
Ацеклофенак в виде порошка для приготовления суспензии для приема внутрь ожидаемо гораздо раньше оказывал противоболевой эффект по сравнению с мелоксикамом в виде таблеток (NRS через два часа, р = 0,043). Это важный аспект в лечении пациентов с болевым синдромом, поскольку наличие боли требует ее незамедлительного купирования, а быстрый эффект значительно повышает комплаентность [30]. Сходная ситуация наблюдалась также при оценке результатов опросника RM24 – достоверное улучшение через десять суток терапии по сравнению с исходными баллами и сохраняющейся положительной динамикой в дальнейшем. Большинство пациентов (44,3% в группе ацеклофенака и 40% в группе мелоксикама) принимали НПВП только в течение десяти дней – этого оказалось достаточно для излечения.
Тем не менее, несмотря на терапию, у части больных достичь клинического эффекта не удалось: наблюдалось четыре (6,8%) случая хронизации болевого синдрома в первой группе и десять (14,3%) – во второй (разница достоверна, р = 0,044). Следует отметить, что 12 (85,7%) пациентов (трое больных в первой группе и девять во второй), у которых был диагностирован хронический болевой синдром, изначально страдали депрессией/тревожным расстройством и принимали препараты из группы селективных ингибиторов обратного захвата серотонина (СИОЗС). Вероятно, именно этот факт стал определяющим в появлении достоверного различия между группами.
В настоящее время анализ особенностей взаимодействия НПВП и СИОЗС – одно из приоритетных направлений в исследованиях в области психиатрии по нескольким причинам. Во-первых, воспалительный процесс в организме рассматривается рядом авторов как этиологический фактор [31] или фактор риска [32] развития депрессии. Во-вторых, назначение НПВП пациентам, которые уже принимают СИОЗС, может существенно изменить течение имеющихся аффективных расстройств [33]. Согласно данным литературы, результаты сочетанного приема НПВП и СИОЗС весьма противоречивы. В некоторых работах показано, что ацетилсалициловая кислота и целекоксиб обладают прямым антидепрессивным эффектом [34, 35]. Другие исследования свидетельствуют о том, что НПВП и парацетамол снижают эффективность СИОЗС, в частности циталопрама [36]. И, наконец, высказываются мнения о том, что прием НПВП не влияет на эффективность СИОЗС у пациентов с аффективными нарушениями [37]. При этом общепризнанно, что СИОЗС потенцируют риск возникновения ассоциированных с приемом НПВП серьезных нежелательных явлений со стороны желудочно-кишечного тракта и сердечно-сосудистой системы [38, 39]. В то же время к одним из важнейших модифицируемых факторов риска хронизации боли в спине относятся именно психологические факторы: стресс, тревожное расстройство, депрессия и т.д. [40].
Таким образом, полученная в нашем исследовании достоверно более высокая частота хронизации вертеброгенной дорсалгии на фоне приема мелоксикама, возможно, объясняется его способностью снижать эффективность СИОЗС. Наиболее вероятно имеет место периферическое взаимодействие НПВП и СИОЗС (в том числе блокада транспортных белков), поскольку мелоксикам не так легко проникает через гематоэнцефалический барьер [41], чтобы создавать достаточную концентрацию в мозговой ткани для возникновения подобного клинического эффекта.
Анализ безопасности
Как ацеклофенак, так и мелоксикам продемонстрировали хорошую переносимость: серьезные нежелательные явления отсутствовали, а общее количество нежелательных явлений в первой группе составило 16 (18,1%) случаев, а во второй группе – 19 (27,1%) (р = 0,175). За весь период исследования наблюдались три типа нежелательных явлений – со стороны желудочно-кишечного тракта (диспепсия, боль в животе, диарея), сердечно-сосудистой системы (повышение артериального давления, отечность) и кожи и кожных придатков (кожная сыпь). Достоверных различий по относительному риску возникновения нежелательных явлений со стороны желудочно-кишечного тракта, а также кожи и кожных придатков в группах не зарегистрировано (ОР 0,80, 95% ДИ 0,32–1,99, р = 0,633 и ОР 0,42, 95% ДИ 0,02–10,10, р = 0,591 соответственно). По причине выраженности нежелательных явлений со стороны желудочно-кишечного тракта три (3,3%) пациента в первой группе и пять (6,7%) больных во второй группе приняли решение отказаться от дальнейшего приема НПВП (р = 0,299).
При анализе структуры нежелательных явлений со стороны сердечно-сосудистой системы определен их достоверно более высокий относительный риск возникновения (ОР 3,02, 95% ДИ 1,12–8,16, p = 0,029) в первой группе, причем он реализован преимущественно за счет повышения артериального давления (р = 0,039). В настоящее время очевидно, что все НПВП способны в той или иной степени повышать артериальное давление [42]. Согласно метаанализу C. Chan и соавт., в большей степени это характерно для коксибов (ОР по сравнению с плацебо 1,49, p = 0,04, по сравнению с неселективными НПВП – 1,12, p = 0,23) [43]. При этом влияние коксибов на артериальное давление неодинаково – наиболее оно выражено у рофекоксиба и эторикоксиба. Таким образом, именно влияние на ЦОГ-2 главным образом «ответственно» за данный тип нежелательных явлений. Основными патогенетическими механизмами при этом служат:
- задержка в организме ионов натрия и соответственно воды;
- уменьшение образования в сосудистой стенке естественного вазодилататора простациклина;
- ослабление эффекта ряда антигипертензивных препаратов [44].
Последний механизм, вероятно, один из самых важных, поскольку, например, в метаанализе A.G. Johnson и соавт. достоверное повышение артериального давления на фоне приема НПВП наблюдалось именно у пациентов с артериальной гипертензией, у которых ранее медикаментозно была достигнута нормотензия [44]. При этом степень ослабления эффекта различных антигипертензивных препаратов при одновременном приеме НПВП сильно варьируется. Она наиболее значима при использовании бета-блокаторов и лекарственных средств, блокирующих ренин-ангиотензин-альдостероновую систему [45]. Это обусловлено тем, что в нормальных условиях при приеме НПВП происходит снижение синтеза ренина в качестве компенсации за задержку в организме ионов натрия и воды, а также вследствие прямого ингибирования ЦОГ-2. В том случае, когда ренин-ангиотензин-альдостероновая система хронически «подавлена» использованием соответствующих антигипертензивных препаратов, указанный выше компенсаторный механизм неэффективен, что приводит к увеличению артериального давления [46].
Кроме того, важный фактор, определяющий частоту и выраженность нежелательных явлений со стороны сердечно-сосудистой системы, – период полувыведения НПВП. Полагают, что при коротком периоде полувыведения у ряда НПВП, обладающих значительным потенциалом ингибирования ЦОГ-2, активность последней в период между приемом препаратов частично восстанавливается, что может способствовать меньшей частоте и выраженности нежелательных явлений со стороны сердечно-сосудистой и реноваскулярной систем [47]. Таким образом, более высокий относительный риск повышения артериального давления и соответственно нежелательных явлений со стороны сердечно-сосудистой системы может объясняться более длительным по сравнению с ацеклофенаком периодом полувыведения мелоксикама и использованием данного препарата в максимальной дозе – 15 мг/сут, что индуцирует более стойкое блокирование ЦОГ-2. В этой связи в исследовании ожидалось более выраженное противоболевое действие мелоксикама по сравнению с ацеклофенаком, но этого не произошло, на наш взгляд, из-за лучшей способности ацеклофенака проникать в синовиальную жидкость. Поскольку при вертеброгенной дорсалгии один из важнейших источников боли – фасеточные суставы [48], то по противоболевой эффективности ацеклофенак не уступал мелоксикаму.
При анализе результатов электрокардиографии, а также большинства параметров крови никаких значимых отклонений в обеих группах не получено. У части больных наблюдалась гиперферментемия (повышение аланинаминотрансферазы), выраженность которой достоверно не отличалась между группами (р = 0,135) и не привела к отмене НПВП.
Заключение
Кратковременное (до 30 суток) применение ацеклофенака (препарат Аэртал®) 200 мг/сут и мелоксикама 15 мг/сут эффективно и относительно безопасно при вертеброгенной дорсалгии. Оба препарата достоверно уменьшают выраженность болевого синдрома (по шкале NRS) и увеличивают повседневную активность пациентов (в соответствии с опросником RM24) уже к десятым суткам лечения, при этом достоверных различий между группами не обнаружено.
Аэртал® в виде порошка для приготовления суспензии для приема внутрь оказывает более быстрый противоболевой эффект по сравнению с мелоксикамом в виде таблеток и реже приводит к хронизации боли. Последний факт, наиболее вероятно, объясняется ингибирующим воздействием мелоксикама на эффективность действия СИОЗС.
Оба препарата обладают сравнимым благоприятным профилем переносимости, за исключением более высокого относительного риска развития нежелательных явлений со стороны сердечно-сосудистой системы (повышение артериального давления) на фоне приема мелоксикама, что связано, по всей вероятности, с более длительным по сравнению с ацеклофенаком периодом полувыведения препарата.
I.N. Samartsev, S.A. Zhivolupov, R.Z. Nazhmudinov, Ye.V. Yakovlev
Military Medical Academy named after S.M. Kirov, Saint Petersburg
Elizabethan Hospital, Saint Petersburg
Medical Center of JSC ‘Admiralty Shipyards’, Saint Petersburg
Contact person: Igor Nikolayevich Samartsev, alpinaigor@mail.ru
Purpose. Evaluation of clinical efficacy and safety of application of two nonsteroidal anti-inflammatory drugs having moderate selectivity for cyclooxygenase 2 aceclofenac and meloxicam in the treatment of patients with acute vertebrogenic dorsalgia.
Material and methods. 158 patients with vertebrogenic dorsalgia (non-specific pain in the lower back) (code M.54 according to the International Classification of Diseases of the 10th revision) were randomized into two groups: the first received aceclofenac (Airtal®) 200 mg/day, the second received meloxicam 15 mg/day. The duration of administration was determined individually depending on the clinical course of the disease. The effectiveness of therapy was analyzed using a Numerical Rating Scale (NRS), Roland-Morris Disability Questionnaire (RM24), the frequency of pain syndrome chronization. The safety assessment was carried out by monitoring adverse events.
Results. Both drugs significantly (p < 0.05) reduced the manifestation of pain syndrome (on the NRS) and increased the daily activity of patients (in accordance with the RM24) by the tenth day of treatment, with no significant differences in this respect between the groups. Aceclofenac had more rapid analgesic effect (p = 0.043) in comparison with meloxicam, and less frequently resulted in chronic pain (p = 0.044). Both drugs had comparable favorable tolerability profile, with the exception of higher relative risk of adverse events from the cardiovascular system in meloxicam (HR 3.02, 95% CI: 1.12–8.16, p = 0.029), mainly due to increased blood pressure (p = 0.039).
Summary. Short-term (up to 30 days) use of aceclofenac (Airtal®) and meloxicam is effective and relatively safe in the treatment of patients with vertebrogenic dorsalgia. There are significant differences between the drugs in a number of parameters (more fast speed of analgesia development in the case of aceclofenac and higher frequency of chronic pain syndrome in meloxicam) and tolerability (higher relative risk of adverse events from the cardiovascular system meloxicam) that requires clarification in further studies.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.