Карнитин и ацетилкарнитин в лечении мужского бесплодия
- Аннотация
- Статья
- Ссылки

Широкое применение вспомогательных репродуктивных технологий, которое принято считать одним из методов решения этой проблемы, характеризуется рядом недостатков. К их числу относятся значительные материальные затраты и отсутствие достаточного числа данных о долгосрочных последствиях их применения, а в случае лечения изолированного мужского бесплодия также необходимость проведения гормональной терапии и инвазивных манипуляций у здоровых партнерш больных мужчин (2). Все это придает особую актуальность исследованию методов улучшения качества эякулята и лечения мужского бесплодия.
Применение большого количества различных веществ было изучено в качестве методов лечения мужского бесплодия, однако эффективность лишь немногих из них можно считать сколько-нибудь достоверной (3). К этим немногим и относятся карнитин и его производные (прежде всего ацетилкарнитин), которым и будет посвящена данная работа.
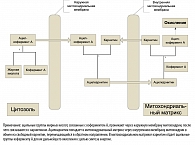
Карнитин (L-3-гидрокси-4-N,N,N-триметиламинобутират) был открыт более 100 лет назад, однако его физиологические функции все еще окончательно не изучены. Основной ролью карнитина в организме человека является участие в энергетическом обмене, а именно перенос ацильных групп жирных кислот внутрь митохондрий, где они подвергаются β-окислению (рисунок) (4).
Именно зависящий от карнитина процесс переноса ацильных групп из цитозоля в митохондриальный матрикс регулирует скорость окисления жирных кислот, являющихся основным источником энергии для большинства клеток и тканей организма (4). Как видно из рисунка, ацетилкарнитин – это промежуточная форма, которую условно можно считать биологически активным вариантом карнитина. Кроме этого карнитин также регулирует концентрацию коэнзима А, оказывая влияние на различные процессы, включая цикл Кребса и окисление аминокислот. Таким образом, основной ролью карнитина является регуляция клеточного энергетического баланса.
В отличие от многих видов организмов, клетки человека способны синтезировать карнитин из аминокислот лизина и метионина. Этот процесс происходит преимущественно в почках и печени. Тем не менее большая часть карнитина попадает в организм человека с пищей. Наиболее богаты карнитином продукты животного происхождения, такие как мясо, рыба и молоко (4).
Учитывая биохимическую роль карнитина, неудивительно, что большая его часть (около 97%) находится в мышцах. В то же время наиболее высокая концентрация карнитина отмечена в ткани придатка яичка и выделяемой им жидкости (5). Посредством специальной транспортной системы клетки придатка яичка способны накапливать и выделять большие количества карнитина. В результате деятельности этого механизма концентрация карнитина в секрете придатка яичка и сперматозоидах превышает таковую в плазме крови примерно в 2000 раз (5). В экспериментальных условиях показано, что этот процесс может являться андроген-зависимым (6).
При этом известно, что сперматозоиды становятся подвижными именно в период нахождения в придатке яичка (7). Кроме того, жирные кислоты являются основным источником энергии для сперматозоидов (8). Эти факты указывают на то, что карнитин играет важную роль в энергетическом обмене сперматозоидов и, как следствие, влияет на их подвижность.
Карнитин также может оказывать влияние и на другие характеристики сперматозоидов. Предполагается, что высокие концентрации карнитина поддерживают стабильность мембран сперматозоидов (9), в частности, обеспечивают целостность акросомы (10). Подобное действие имеет большое значение, так как известно, что преждевременное развитие акросомальной реакции лишает сперматозоиды способности к оплодотворению яйцеклетки.
Изложенным выше функции карнитина в организме в целом и в репродуктивных путях в частности не ограничиваются. Значительный интерес исследователей вызывает способность карнитина препятствовать запрограммированной клеточной гибели, апоптозу. Показано, что карнитин способен снижать число погибших в результате ишемии клеток сердечной мышцы (11). Действие карнитина установлено также и для других клеток, включая нейроны (12), миоциты (13), клетки тератомы (14), гепатоциты (15) и лимфоциты (16).
Возможные биохимические механизмы подавления апоптоза карнитином включают: предотвращение выделения ферментов группы каспаз из митохондрий (17), а также снижение разрушения сфингомиелинов (18). Напомним, что каспазы являются основными ферментами, ответственными за развитие апоптоза, а сфингомиелины составляют основу клеточной мембраны. Высказаны также и другие предположения о возможных механизмах влияния карнитина на апоптоз (5).
Следует отметить, что повышение активности апоптоза в процессе сперматогенеза может быть причиной нарушения качества эякулята, прежде всего снижения концентрации сперматозоидов. Возможность действия карнитина на процессы апоптоза изучена в нескольких экспериментальных работах.
Amendola и соавт. изучили влияние ацетилкарнитина на восстановление сперматогенеза у мышей после облучения яичек (19). Карнитин вводили в брюшную полость в дозе 100 мг на кг массы тела. В целом у животных, получавших карнитин, было отмечено достоверно более быстрое и полноценное восстановление сперматогенеза. Теми же авторами было продемонстрировано благоприятное влияние карнитина на возобновление сперматогенеза после теплового воздействия на яички у мышей (20). Сходные результаты были получены в исследовании действия карнитина на сперматогенез после магнитного воздействия (21). Таким образом, карнитин может оказывать благоприятное влияние на восстановление сперматогенеза после его подавления под действием различных агрессивных физических факторов, однако точная природа подобных эффектов не ясна.
Несмотря на то что концентрация карнитина является наиболее высокой в придатке яичка, ткань самого яичка также богата этим веществом. Это стало причиной предположения о том, что наряду с действием на апоптоз, карнитин может влиять на сперматогенез и другими путями. Точками приложения подобного действия карнитина могут также являться клетки Сертоли, играющие ключевую роль в обеспечении нормального сперматогенеза. Добавление карнитина к культуре подобных клеток стимулирует выделение ими пирувата и лактата (22), которые являются важнейшими источниками энергии для предшественников сперматозоидов.
Еще одним эффектом карнитина, потенциально полезным для сперматозоидов, является его антиоксидантное действие. Хорошо известно, что окислительный стресс может значительно снижать качество эякулята, приводя к снижению подвижности и жизнеспособности сперматозоидов. Было показано, что прием карнитина приводит к снижению содержания реактивных форм кислорода в эякуляте у пациентов с бесплодием и воспалительными процессами в половых путях (23).
Это действие сопровождалось повышением подвижности и жизнеспособности сперматозоидов. Показана также возможность антиоксидантного влияния карнитина и в других клетках, таких как лимфоциты периферической крови у больных вирусом иммунодефицита человека (24) и кардиомиоциты (25).
Возможный механизм подобного действия неясен, но предполагается, что он может быть связан с нейтрализацией избыточных количеств внутриклеточного ацетилкоэнзима А. Кроме того, карнитин может способствовать устранению последствий негативного влияния окислительного стресса на клетки путем участия в восстановлении поврежденных фосфолипидных компонентов клеточных мембран (26). Клиническое значение подобных эффектов не установлено.
Исследование концентрации карнитина в эякуляте может иметь диагностическое значение. Как уже упоминалось выше, основным источником карнитина, попадающего в эякулят, является придаток яичка. Следовательно, нарушение функции придатка яичка может отражаться на концентрации карнитина. Показано, что воспаление придатка яичка сопровождается снижением содержания карнитина в эякуляте примерно в 2 раза (27). Кроме того, пониженные концентрации карнитина отмечены в эякуляте у мужчин с уплотненными придатками яичек, косвенно указывающими на длительное течение воспалительного процесса (28).
Учитывая представленные выше данные о важности карнитина и ацетилкарнитина для сперматогенеза и дальнейшего созревания сперматозоидов, неудивительно, что эти вещества привлекают большое внимание исследователей в области мужского бесплодия. Было выяснено, что концентрация карнитина положительно связана с концентрацией и подвижностью, а также с содержанием морфологически нормальных форм сперматозоидов (29, 30). Показано также, что концентрация общего и свободного карнитина в эякуляте мужчин со сниженной концентрацией сперматозоидов (олигозооспермией) меньше таковой у здоровых мужчин (31). Кроме того, аналогичное различие имело место при сравнении мужчин с нормальной концентрацией сперматозоидов, не способных достичь зачатия, и контрольной группы (32). Последнее указывает на то, что различия в уровнях карнитина между больными с мужским бесплодием и здоровыми мужчинами не связаны с количеством сперматозоидов в эякуляте.
Эффективность перорального приема карнитина и ацетилкарнитина в лечении мужского бесплодия была изучена в достаточно большом числе работ (23, 33, 34, 35, 36, 37). Здесь необходимо остановиться на ряде методологических проблем, неизбежно сопутствующих проведению исследований эффективности различных препаратов в лечении мужского бесплодия. Понимание этих сложностей позволяет правильно оценить существующие данные, касающиеся эффективности карнитина.
Мужское бесплодие является гетерогенным заболеванием, при этом в значительном числе случаев истинная причина имеющихся нарушений остается неизвестной. Соответственно, отдельные формы лечения могут быть эффективными у части пациентов с определенной патогенетической формой заболевания и неэффективными у других больных. Таким образом, на результат исследования эффективности лечения в группе пациентов может оказывать влияние состав этой группы, соотношение числа пациентов с различными причинами бесплодия.
Как правило, эффективность разных методов лечения мужского бесплодия оценивают по изменениям показателей спермограммы. Подобный подход имеет как преимущества, так и недостатки. Преимуществом оценки эффективности лечения по показателям спермограммы, а не, к примеру, по числу беременностей, является то, что на последнее влияет множество факторов, не связанных с качеством эякулята, включая наличие нарушений фертильности у партнерши и частоту половых актов. В то же время показатели спермограммы не всегда непосредственно связаны с фертильностью мужчины, повышение которой является основной целью лечения. Кроме того, результаты исследования спермограммы могут варьировать в существенных пределах у одних и тех же мужчин, а также зависят от того, кто выполняет исследование.
Существенное значение также имеет длительность приема препаратов. Так как полный цикл синтеза сперматозоидов занимает более 70 дней, а изучаемому веществу еще необходимо накопиться в тканях яичка, для получения полноценных данных об эффективности лечения его длительность должна быть не менее 3, а лучше 6 месяцев.
Основные результаты исследований клинической эффективности карнитина и/или ацетилкарнитина, проведенных к настоящему времени, представлены в таблице.
В исследовании Costa и соавт. 100 мужчин с астенозооспермией (снижением числа подвижных сперматозоидов) неизвестного происхождения получали карнитин в дозе 3 г в день в течение 4 месяцев (34). Основным оценивавшимся показателем была подвижность сперматозоидов, которую исследовали до начала, во время и после окончания лечения. Проведенное лечение привело к повышению средней подвижности сперматозоидов с 26,9 ± 1,1% до 36,4 ± 0,9% (p < 0,01), при этом число перемещающихся прогрессивно и линейно сперматозоидов выросло с 10,8 ± 0,6% до 17,4 ± 0,8% (p < 0,01). Также было отмечено увеличение средних показателей общего количества сперматозоидов в эякуляте (с 14,4 ± 10,3 × 106/мл до 163,3 ± 11 × 106/мл (p < 0,01).
Аналогичное исследование было проведено Vitali и соавт. (35): 47 пациентов с идиопатической астенозооспермией принимали карнитин в дозе 3 г в день в течение 3 месяцев. По окончании периода лечения улучшение показателей спермограммы было отмечено у 80% участников. Средняя концентрация сперматозоидов выросла на 44,6% (с 88 × 106/мл до 159 × 106/мл), а средняя подвижность – на 99,6% (с 26,8% до 53,5%).
Представленные выше работы, как и другие исследования эффективности карнитина, проведенные ранее, имели существенные методологические недостатки. Прежде всего, в этих исследованиях отсутствовал плацебо-контроль, что значительно снижало достоверность их результатов. Общеизвестно, что многие препараты, длительное время применяемые в медицине, особенно в тех ее областях, где лечебные эффекты не являются непосредственными и очевидными (к этой группе относится и проблема мужского бесплодия), при их исследовании в рамках рандомизированных плацебо-контролируемых исследований оказались неэффективными. Точнее, их эффективность, как выяснилось, не превышала таковую у плацебо.
Все эти недостатки были преодолены в исследовании, проведенном Lenzi и соавт. (36). По своему дизайну это исследование было проспективным, рандомизированным, двойным слепым, перекрестным, то есть соответствовало всем современным требованиям, предъявляемым к клиническим исследованиям. В работу было включено 100 мужчин, которые были не способны достичь зачатия в течение 2 лет и более. Критериями включения в работу также являлись концентрация сперматозоидов в пределах от 10 до 20 × 106/мл, общая подвижность от 10% до 30%, прогрессивная подвижность менее 15%, число морфологически нормальных сперматозоидов 30% и менее, а также скорость движения сперматозоидов от 10 до 30 микрон/с. После вводного периода длительностью 2 месяца, в течение которого лечение не проводили, пациенты были рандомизированы на получение перорального карнитина в дозе 2 г в день или плацебо в течение 2 месяцев. За этим следовал еще один 2-месячный интервал без лечения, а потом пациентам проводили другой тип терапии (получавшие ранее карнитин принимали плацебо и наоборот). Результаты исследования показали, что прием карнитина приводил к достоверному увеличению концентрации и подвижности сперматозоидов, особенно выраженным среди пациентов с низкими исходными показателями. Кроме того, в период лечения карнитином у партнерш больных было отмечено развитие 8 беременностей.
К сожалению, и эта работа не была лишена отдельных недостатков. Прежде всего, период лечения длительностью 2 месяца, как мы уже отмечали выше, может быть недостаточным для выявления изменений сперматогенеза. Кроме того, перерыв между приемом карнитина и плацебо также мог оказаться недостаточным для полного удаления полученного карнитина из организмов пациентов. Это могло привести к сохранению действия карнитина в группе плацебо и повлиять на выявленные различия.
Следует также отметить, что теоретически более оправданным может быть сочетанное применение карнитина и ацетилкарнитина. Подобная комбинация самого действующего вещества и его активной формы может оказывать более сбалансированное действие на сперматогенез, будучи менее зависимой от метаболических особенностей организма больного.
В исследовании G. Balercia и соавт. (2005), в котором приняли участие 60 пациентов в возрасте от 20 до 40 лет (страдающие мужским бесплодием), было проведено сравнение комбинированного лечения (2 г карнитина и 1 г ацетилкарнитина в день) с монотерапией карнитином (3 г в день) и ацетилкарнитином (3 г в день)(37). Среди критериев включения следует отметить концентрацию сперматозоидов (более 20 × 106/мл), а также подвижность менее 50%. Таким образом, авторы прежде всего стремились выявить действие карнитина и ацетилкарнитина на подвижность сперматозоидов, справедливо предполагая, что его эффекты на их концентрацию выражены в меньшей степени. Длительность лечения составила 6 месяцев, кроме того, все пациенты проходили повторное обследование через 3 месяца после окончания лечения.
В целом комбинированная терапия оказалась самым эффективным методом лечения. И хотя все три формы лечения достоверно превосходили плацебо, именно сочетание карнитина и ацетилкарнитина в наибольшей степени (примерно на 70%) повышало число прогрессивно подвижных сперматозоидов. Во всех группах, кроме пациентов, получавших плацебо, было также отмечено повышение общей подвижности и концентрации сперматозоидов, а также снижение выраженности окислительного стресса. Через 3 месяца после окончания лечения все эти показатели возвратились к исходным значениям. Кроме того, из 12 беременностей, развившихся у партнерш пациентов в период лечения, 5 были зафиксированы в группе, получавшей комбинированное лечение.
В свете представленных выше сведений о высокой эффективности сочетания карнитина и ацетилкарнитина в лечении мужского бесплодия мы считаем необходимым подробнее остановиться на имеющих подобный состав препаратах, представленных на российском рынке. На данный момент единственным препаратом в нашей стране, включающим в свой состав одновременно карнитин и ацетилкарнитин, является препарат Спермактин®.
Спермактин® – это оригинальный комбинированный метаболический препарат для эффективного лечения мужского бесплодия. Форма выпуска – саше (пакетики) (30 пакетиков в упаковке), каждый из которых содержит по 1 г карнитина и 0,5 г ацетилкарнитина в сочетании с фруктозой (2 г). Основными показаниями к применению Спермактина являются все формы патоспермии, идиопатическое мужское бесплодие, подготовка к применению репродуктивных технологий, а также коррекция метаболических нарушений и митохондриальной патологии. Рекомендованный производителем режим приема – по одному пакетику с порошком 2 раза в день внутрь, предварительно растворив в воде.
Следует отметить, что по препарату Спермактин® был проведен ряд клинических исследований на базе ведущих учреждений России, в том числе и в Научном центре акушерства и гинекологии им. В.И. Кулакова.
Мы имеем собственный положительный клинический опыт применения данного препарата в разных группах мужчин, страдающих бесплодием, включая пациентов, перенесших микрохирургические вмешательства по поводу варикоцеле. В течение последних 2 лет по этой методике в нашей клинике прооперировано более 200 мужчин. По нашему мнению, для усиления благоприятных эффектов хирургического вмешательства подобные пациенты в послеоперационном периоде нуждаются в проведении стимулирующей медикаментозной терапии, включающей Спермактин®. Это лечение приводит к ускорению восстановления нарушенного сперматогенеза, кроме того, общее улучшение показателей спермограммы также значительно превышает таковое у пациентов, не получающих указанной терапии.
В заключении отметим, что применение карнитина не ограничивается лечением мужского бесплодия. Это не должно удивлять, учитывая большое число различных биохимических механизмов, в которых карнитин играет важную роль. Рассматривается возможность применения карнитина в качестве альтернативной формы лечения болезни Альцгеймера, синдрома хронической усталости, почечной недостаточности, эректильной дисфункции (38) и атеросклероза периферических артерий (39, 40). Кроме этого, данное вещество также принимают с целью повышения переносимости физических нагрузок (41).
Таким образом, карнитин и ацетилкарнитин занимают особое место среди существующих в настоящее время препаратов для лечения мужского бесплодия. В отличие от многих других средств, которые пробовали применять по этому показанию, клиническая эффективность карнитина и ацетилкарнитина доказана в рандомизированных, слепых плацебо-контролируемых исследованиях. Сочетание двух этих веществ по своей эффективности превосходит каждое из них в отдельности. Это определяет особое клиническое значение таких комбинированных препаратов, как Спермактин®, включающий в себя карнитин и ацетилкарнитин, и который вот уже на протяжении более 10 лет успешно применяется в широкой клинической практике.
