Патология щитовидной железы и беременность
- Аннотация
- Статья
- Ссылки
- English



Зародыш – плод – ребенок. Процессы, происходящие в период зарождения и развития, во многом остаются загадкой для медицины. Однако некоторые аспекты уже хорошо изучены, и врачам понятны механизм, а также причины закладки и формирования патологии будущего ребенка.
Изменения функции щитовидной железы (ЩЖ) занимают второе место среди эндокринопатий после сахарного диабета, именно поэтому попробуем проанализировать имеющиеся у нас знания и выработать тактику ведения пациенток во время беременности.
Закладка щитовидной железы плода происходит на четвертой-пятой неделях гестации, к шестой – восьмой неделям появляются первые признаки ее гормональной активности. На сроке 9–11 недель отмечается секреторная активность: дифференцировка эпителия, образование первых единичных фолликулов. В период 10–12 недель внутриутробного развития щитовидная железа плода приобретает способность накапливать йод и синтезировать йодтиронины, а после 12-й недели функционирует как самостоятельный орган. С этого момента формирование органов и систем происходит под контролем гормонов собственной ЩЖ плода. Постепенно гипофизарно-тиреоидная система плода становится автономной. На 16–17-й неделях фетальная ЩЖ полностью дифференцирована. Необходимо помнить, что тиреотропный гормон (ТТГ) и тиреоидные гормоны матери практически не проникают через плацентарный барьер, возможно, именно этим объясняется столь раннее начало самостоятельной активности данной эндокринной железы у плода.
Установлено, что во время беременности у 20% женщин уровень ТТГ может транзиторно уменьшиться до нижней границы нормы (менее 0,20 мЕД/л), происходит подавление гипофизарно-тиреоидной системы [1, 2]. При субнормальном уровне ТТГ в 10% случаев уровень свободного тироксина (св. Т4) может превышать норму, способствуя развитию транзиторного тиреотоксикоза в первом триместре. Синдром транзиторного тиреотоксикоза часто сопровождается неукротимой рвотой, что затрудняет его диагностику, поскольку на ранних сроках гестации часто развивается токсикоз, проявляющийся тошнотой, рвотой, сердцебиением, перепадами настроения, общим ухудшением самочувствия. Именно поэтому сложно исключить у беременных с неукротимой рвотой в первом триместре развитие истинного тиреотоксикоза [3]. Необходимо отметить, что транзиторный тиреотоксикоз беременных в отличие от истинного тиреотоксикоза не требует терапии тиреостатическими препаратами. Для дифференциальной диагностики необходимо оценить клинические признаки тиреотоксикоза и лабораторные показатели в динамике.
Второй и третий триместры беременности тоже имеют свои особенности по функционированию ЩЖ у плода. Так, с 18-й по 24-ю и с 33-й по 35-ю недели функция фетальной ЩЖ снижается. В период подготовки к рождению (36–40-я недели) во всей железе наблюдаются признаки гипофункции. В антенатальный период онтогенеза происходит полное формирование гистологической и цитологической структуры ЩЖ. Фетальная гипофизарно-тиреоидная система автономна, так как фетоплацентарный барьер относительно непроницаем для гормонов ЩЖ и ТТГ [4]. Активность фетальной ЩЖ полностью зависит от поступления йода из материнского организма [5]. Физиологически нормальная беременность характеризуется изменениями в тиреоидном статусе женщины. Возрастание потребности в тиреоидных гормонах обусловлено физиологическим повышением уровня тироксинсвязывающего глобулина, стимуляцией щитовидной железы высокими концентрациями хорионического гонадотропина (ХГ), увеличением дейодирования йодтиронинов матери за счет функционирования дейодиназы 3 для обеспечения повышенной потребности в тиреоидных гормонах. В результате этого повышается уровень общих фракций тироксина и снижается уровень ТТГ [6].
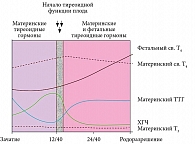
На протяжении всей беременности значения гормонов изменяются как у матери, так и у плода. Известно, что гормоны ЩЖ стимулируют функцию желтого тела. Для поддержания беременности на ранних сроках происходит постепенное повышение плацентарного дейодирования Т4, и концентрация св. Т4 у матери во втором триместре имеет тенденцию к снижению. При этом во время родов содержание ТТГ может возрастать в десять раз. У плода концентрация св. Т4 во втором триместре внутриутробного развития выше, трийодтиронина (св. Т3) – ниже, уровень реверсивного биологически инертного Т3 – выше. Во время родов уровень ТТГ у плода, так же как у матери, увеличивается. В качестве причин этого рассматриваются две гипотезы: попадание через плаценту или стимулированный выброс гипофизом плода (рисунок) [7].
Первичная диагностика функций щитовидной железы при беременности осуществляется по уровню ТТГ. Показатель ТТГ в сыворотке крови является исходным и наиболее надежным [8]. В соответствии с рекомендациями Американской тиреоидологической ассоциации (American Thyroid Association – АТА), уровень ТТГ в сыворотке крови во время беременности должен определяться с использованием референтных диапазонов с учетом популяции и триместра. Если нормальные диапазоны для популяции и триместра недоступны, эксперты АТА рекомендуют уменьшать нижнюю границу ТТГ на 0,4 мЕд/л, а верхнюю – на 0,5 мЕд/л, что будет соответствовать референтному диапазону 0,1–4,0 мЕд/л в течение первого триместра с постепенным возвращением к нормальному диапазону небеременных женщин во втором и третьем триместрах [9]. Уровень св. Т4, измеренный с помощью иммуноанализа, недостаточно надежный диагностический инструмент из-за изменений в связывающих белках во время беременности. В качестве альтернативы можно использовать значения общего Т4 или индекса св. Т4 [10].
Роль тиреоидных гормонов в нормальном развитии плода хорошо известна (табл. 1).
Адекватное количество гормонов ЩЖ у матери во время беременности необходимо не только для нормального развития плода, но и для оптимального исхода беременности [11].
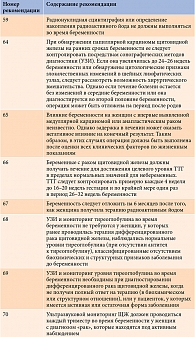
Нарушение функции щитовидной железы у матери (манифестный и субклинический гипо- и гипертиреоз) встречается в 2–4% случаев и ассоциировано с высоким риском неблагоприятных исходов беременности, таких как выкидыш, преэклампсия, преждевременные роды, низкий интеллектуальный уровень ребенка [12]. При уровне ТТГ 3,5–6,0 мМЕ/л выявлены следующие патологии беременных: анемия (80%), ранний токсикоз (73%), угроза прерывания беременности (73%), нарушение плацентарного кровотока (33%), слабость родовой деятельности (33%). У повторнобеременных с аналогичными показателями в два раза повышается риск привычного невынашивания, в три раза – риск антенатальной гибели плода [13].
В опубликованной в 2023 г. работе российских ученых отмечено, что при уровне ТТГ 3,06 ± 0,36 мЕД/л у пациенток с гипотиреозом в первом триместре беременности выявлены следующие осложнения беременности и родов: гестационный сахарный диабет (32%), анемия первой степени (12%), крупный плод (12%), преждевременный разрыв плодных оболочек (12%), разрыв промежности первой степени (16%), аномалии родовой деятельности при неэффективной родостимуляции (8%), тазово-головная диспропорция (8%). При этом субклинический гипотиреоз был выявлен у 48,6% пациенток [14].
В работе 2022 г. других российских ученых за референтные значения ТТГ для беременных был принят уровень менее 2,5 мМЕ/л. Установлено, что при данных параметрах значимо увеличивался риск развития гестационного сахарного диабета, преждевременных родов, преэклампсии, отслойки плаценты, дистресса плода. Все эти показатели имели устойчивую тенденцию к повышению при наличии антител к тиреоидной пероксидазе (АТ-ТПО) [15].
Как в мировой, так и в российской медицинской практике выявлено, что наиболее частой патологией щитовидной железы в период беременности является субклинический гипотиреоз. На втором месте по встречаемости – аутоиммунный тиреоидит. Далее следуют диффузный эндемический и узловой зоб [14].
Самая частая причина развития патологии ЩЖ во время беременности – дефицит йода. Несмотря на постоянно проводимые мероприятия по обеспечению населения йодом, на данный момент времени в России практически не существует территорий, на которых отсутствовал бы риск развития йододефицитных заболеваний. Согласно оценке по медианной концентрации йода в моче у беременных, проживающих в Москве, Смоленске и Иванове, значимый дефицит йода выявлен даже среди использовавших добавки йода [16].
Заслуживают также внимания данные, полученные в одноцентровом проспективном исследовании в отношении вставших на учет в первом триместре в женскую консультацию Тюмени. Только у 50,7% йодурия находилась в целевом диапазоне, у 3,4% – превышала 500 мкг/л, у 45,8% – экскреция йода с мочой не достигала рекомендованного для беременных значения [17].
В соответствии с современными клиническими рекомендациями, обеспеченность йодом, соответствующая гестационной норме, должна быть на уровне 150 мкг/л и более по медианной концентрации йода в моче. Этот показатель служит для оценки эффективности проводимой профилактики дефицита йода [16]. Дефицит йода во время беременности приводит к нарушению формирования головного мозга ребенка, проявления которого довольно широки – от снижения интеллекта легкой степени до тяжелых форм эндемического кретинизма. На фоне хронической недостаточности йода у 30–60% детей наблюдаются поведенческие и эмоциональные отклонения, нарушение формирования личности. Эти отклонения могут не обнаруживаться в период новорожденности и проявиться лишь в период полового созревания. Необходимо отметить, что проживание в районах с дефицитом йода даже при эутиреоидном зобе сопровождается снижением воспроизведения слуховой информации, ухудшением зрительной памяти, другой психической деятельности, а также адаптационных возможностей центральной нервной системы (ЦНС) [18].
К факторам, повышающим потребность матери в йоде во время беременности, прежде всего относится увеличение на 50% потребности в гормонах щитовидной железы, что обусловливает необходимость дополнительного потребления йода в дозе 50–100 мкг (к обычной профилактической дозе!). Отмечаются опосредованный эстрогенами повышенный уровень тироксинсвязывающего глобулина, высокие концентрации хорионического гонадотропина человека (ХГЧ), которые стимулируют работу щитовидной железы, увеличенное дейодирование йодтиронинов матери за счет функционирования дейодиназы третьего типа, а также повышенный почечный клиренс йода [19].
Эндемический дефицит йода обычно ассоциируется с гипотиреозом у беременных.
С учетом распространенности йодного дефицита и значительного влияния данного состояния на формирование плода разработаны рекомендации для беременных по суточным нормам потребления йода.
Согласно рекомендациям экспертов АТА и Всемирной организации здравоохранения (ВОЗ), ежедневное потребление йода во время беременности и кормления грудью должно составлять не менее 250 мкг. Однако во время беременности следует избегать чрезмерного потребления йода, так как в излишнем количестве он может быть вреден и вызывать гипотиреоз и развитие зоба у плода. По мнению экспертов ВОЗ, максимально допустимая (безопасная) суточная доза йода у беременных должна составлять 500 мкг [20].
В регионах с пополнением запасов йода наиболее частой причиной гипотиреоза во время беременности является хронический аутоиммунный тиреоидит (тиреоидит Хашимото) [21].
Спонтанный гипотиреоз во время беременности встречается у 2–3% пациенток, при этом у 0,3–0,5% наблюдается явный гипотиреоз, у 2,0–2,5% – субклинический [22]. Явный гипотиреоз может поражать 0,1–0,4% беременных [23].
Гипотиреоз во время беременности определяется как уровень ТТГ выше популяционного и референтного диапазона, специфичного для триместра. Разные тиреоидологические ассоциации указывают разные нормальные уровни ТТГ у беременных в зависимости не только от триместра, но и от срока прегравидарной подготовки. Разброс показателей от 2,5 до 4,0 мМЕ/л связан как с географически обусловленной йодной обеспеченностью, так и с этнической принадлежностью. Если недоступен референс по ТТГ, следует использовать верхний референтный диапазон – 4,0 мЕд/л. Явный гипотиреоз определяется как повышенный триместр-специфический уровень ТТГ и низкий уровень св. Т4, субклинический – как триместровый специфический уровень ТТГ и нормальный уровень св. Т4. Хочется обратить внимание на результаты работы Е.А. Матейкович и соавт., свидетельствующие об осложнениях на фоне беременности и родов у пациенток с уровнем ТТГ выше 2,5 мМЕ/л, не получавших лечения [15].
В проекте отечественных рекомендаций 2021 г. отмечено, что при явном гипотиреозе во время беременности показана заместительная терапия препаратами левотироксина натрия (19-я рекомендация). Риск преждевременного прерывания беременности возрастает пропорционально повышению уровня ТТГ. Поэтому женщины, у которых в анамнезе имеет место спонтанное прерывание беременности, требуют более тщательного обследования. При гипотиреозе, диагностированном во время беременности, необходимо сразу назначать полную заместительную дозу левотироксина натрия. У беременных с явным и субклиническим гипотиреозом, а также у женщин, относящихся к группе риска развития такового (носительниц АТ-ТПО), после гемитиреоидэктомии или получавших в анамнезе натрия йодид (131I), уровень ТТГ следует определять каждые четыре недели до середины беременности и еще как минимум один раз около 30-й недели беременности (20-я рекомендация).
Если женщина с гипотиреозом до беременности получала левотироксин натрия, с учетом того что потребность в нем будет возрастать приблизительно к четвертой – шестой неделям беременности, целесообразно сразу после наступления беременности увеличить дозу препарата на 20–30% [24, 25]. При гипотиреозе, развившемся в результате тиреоидэктомии или лечения радиоактивным йодом, требуется большая доза левотироксина натрия, чем при гипотиреозе в исходе аутоиммунного тиреоидита. Однако у пациенток с аутоиммунным тиреоидитом возможна повышенная потребность в левотироксине натрия, что связано с прогрессированием процесса [26].
После родов дозу левотироксина натрия рекомендуется уменьшить до той, которая принималась до беременности. Контрольное определение концентрации ТТГ показано примерно через шесть недель после родов [27].
При субклиническом гипотиреозе во время беременности терапия левотироксином натрия проводится при высоких титрах АТ-ТПО и уровне ТТГ более 4 и менее 10 мЕд/л, а также женщинам с положительными титрами АТ-ТПО и уровнем ТТГ более 2,5 и менее 4 мЕд/л, женщинам в отсутствие АТ-ТПО с уровнем ТТГ более 4,0 мЕд/л [28].
Согласно рекомендациям АТА, лечение субклинического гипотиреоза необходимо женщинам с положительными титрами АТ-ТПО и уровнем ТТГ более 2,5 мЕд/л [9]. Функцию щитовидной железы следует исследовать каждые четыре – шесть недель до 20-й недели и по крайней мере один раз примерно на 30-й неделе беременности. По мнению экспертов АТА, у 50–85% женщин с гипотиреозом, развившимся до беременности, в гестационный период повышена потребность в гормонах щитовидной железы. С течением беременности она увеличивается примерно на 30% [29].
Целью заместительной терапии во время беременности считается поддержание низконормального уровня ТТГ и высоконормального уровня св. Т4. У женщин с гипотиреозом, выявленным во время беременности, может быть сложно ориентироваться только на значения ТТГ, поскольку изначально высокий уровень ТТГ будет снижаться постепенно, поэтому необходим одновременный контроль св. Т4 [26]. Для адекватной оценки уровня св. Т4 забор крови на анализ проводится натощак, то есть препарат левотироксина натрия необходимо принять после процедуры.
Как было отмечено ранее, после родов потребность в левотироксине натрия снижается, поэтому следует уменьшить его дозу до исходной (до беременности) с последующим контролем уровня ТТГ через шесть недель. У пациенток с аутоиммунным тиреоидитом в послеродовом периоде может сохраниться потребность в увеличенной (на фоне беременности) дозе левотироксина натрия, что связано с прогрессированием аутоиммунного процесса, в этом случае коррекция дозы не проводится [26].
В первом триместре беременности часто встречается преходящий, или транзиторный, гестационный тиреотоксикоз, который поражает 1–3% пациенток [30]. Во время беременности потребность организма женщины в тиреоидных гормонах возрастает на 30–50%, поэтому изменение функции ЩЖ происходит уже с первых недель беременности. Повышение продукции тиреоидных гормонов является результатом влияния специфических факторов, приводящих к гиперстимуляции ЩЖ. Транзиторный субклинический гипертиреоз может развиваться из-за физиологической адаптации щитовидной железы, опосредованной высоким уровнем ХГЧ. При гестационном тиреотоксикозе наблюдается физиологическое снижение уровня ТТГ в течение первого триместра из-за опосредованной ХГЧ-стимуляции рецептора ТТГ (рТТГ). Пик ХГЧ достигается между 7-й и 11-й неделями беременности. Отличить гестационный тиреотоксикоз от болезни Грейвса (БГ) можно с помощью тщательного сбора анамнеза и проведения обследования. Дифференциальная диагностика БГ и гестационного гипертиреоза основывается на выявлении антител к рТТГ, наличии эндокринной офтальмопатии, данных ультразвукового исследования (УЗИ) ЩЖ с определением скорости кровотока. Исследование АТ-ТПО этого сделать не позволяет. Проведение сцинтиграфии ЩЖ абсолютно противопоказано [31]. При БГ в анализе крови будут повышены антитела к рецептору ТТГ (АТ-рТТГ) [32]. Всем женщинам с аутоиммунными заболеваниями щитовидной железы в анамнезе при первом установлении беременности следует определять уровень АТ-рТТГ в сыворотке крови [31], повторно – на 18–22-й неделе беременности. Антитела к рТТГ свободно проникают через трансплацентарный барьер и могут вызывать транзиторный тиреотоксикоз у плода и новорожденного [33, 34].
У женщин с более чем трехкратным увеличением уровня АТ-рТТГ необходимо проведение УЗИ плода с целью выявления признаков нарушения функции ЩЖ, к которым относятся задержка роста, отечность, зоб, сердечная недостаточность. Если у женщины не определяются АТ-рТТГ, риск фетального или неонатального нарушения функции ЩЖ очень низок [33, 34].
При выявлении подавленного уровня ТТГ (менее 0,1 мЕд/л), особенно в первой половине беременности, рекомендовано определять уровень св. Т4 и св. Т3 [31]. Следует отметить, что преходящий, или транзиторный, гестационный тиреотоксикоз не требует патогномоничной терапии (тиреостатиков) во время беременности. Таким пациенткам рекомендуется наблюдение с периодическим контролем показателей функции щитовидной железы каждые четыре – шесть недель [35].
Наиболее частой причиной явного гипертиреоза во время беременности считается БГ. К менее распространенным причинам относятся токсический узловой/многоузловой зоб, токсическая аденома и тиреоидит [36]. Только у 2% беременных развивается гестационный гипертиреоз в результате стимулирующего влияния ХГЧ [31].
Нелеченый или неадекватно леченный гипертиреоз во время беременности связан с повышенным риском преждевременных родов, самопроизвольных абортов, задержки внутриутробного развития, преэклампсии, макросомии, мертворождения и пороков развития плода [30].
Явный гипертиреоз во время беременности прежде всего характеризуется высоким уровнем св. Т4, субклинический – сниженным уровнем ТТГ и нормальным уровнем св. Т4 [32].
Препаратами выбора лечения тиреотоксикоза во время беременности считаются тиреостатики, или антитиреоидные препараты. Целью приема тиреостатиков является смягчение симптомов тиреотоксикоза у матери без развития гипотиреоза у плода. Это достигается путем подбора таких доз тиреостатика, которые позволят сохранить умеренно повышенный уровень св. Т4, не добиваясь нормализации ТТГ [31].
Целью лечения гипертиреоза во время беременности является поддержание умеренного гипертиреоза матери при избегании развития гипотиреоза у плода. Соотношение св. Т4/общего Т4 у матери должно поддерживаться на уровне верхней границы нормы референтного диапазона с использованием самой низкой эффективной дозы антитиреоидных препаратов. Тактика лечения гипертиреоза во время беременности зависит от этиологии, а также от тяжести заболевания [37].
Начальная суточная доза антитиреоидных препаратов подбирается с учетом тяжести тиреотоксикоза: тиамазол – 5–15 мг, пропилтиоурацил – 50–200 мг. При беременности всегда работает правило минимально эффективной дозы. Выбор препарата для начала терапии зависит от срока беременности.
Эмбриопатия на фоне приема тиамазола встречается у 2–4%, особенно в течение первых шести – десяти недель беременности. Распространенность врожденных дефектов одинакова при приеме пропилтиоурацила и тиамазола, однако их спектр менее выражен при применении пропилтиоурацила, поэтому препаратом выбора в первом триместре является именно он. С 16-й недели беременности необходимо рассмотреть возможность перехода на тиамазол. Во втором и третьем триместрах пропилтиоурацил следует заменить тиамазолом, вследствие более выраженной гепатотоксичности первого [38]. Во время беременности назначается минимально возможная доза тиреостатика, режим «блокируй и замещай» противопоказан [31].
Контроль эффективности терапии и необходимости коррекции дозы проводится каждые две недели от начала терапии и каждые четыре недели после достижения целевого уровня св. T4 и ТТГ [31].
После родоразрешения кормление грудью не противопоказано. Кормящим женщинам с БГ назначаются те же методы лечения, что и некормящим. В этот период предпочтение отдается тиамазолу, учитывая опасения по поводу опосредованной гепатотоксичности пропилтиоурацила. Известно, что в грудное молоко поступают небольшие количества тиреостатических препаратов, поэтому низкие дозы пропилтиоурацила (< 250 мг) и тиамазола (< 20 мг) считаются безопасными для матери и ребенка. Тиреостатики следует принимать после кормления ребенка грудью и в разделенных дозах [9, 39].
При необходимости применения бета-адреноблокаторов предпочтение отдается пропранололу в дозе 10–40 мг три-четыре раза в день. Однако следует избегать длительного лечения, так как бета-адреноблокаторы могут вызывать ограничение внутриутробного роста, брадикардию плода и неонатальную гипогликемию [31, 40].
Если у женщины до наступления беременности была выявлена БГ, ее следует информировать о необходимости предохранения от беременности до наступления стойкого эутиреоза, который должен быть подтвержден дважды в течение двух месяцев на стабильном терапевтическом режиме. При наступлении спонтанной беременности пациентка должна быть проинформирована о повышенном риске врожденных дефектов, вызванных приемом антитиреоидных препаратов, возможности прекращения приема тиреостатиков в течение шести – десяти недель беременности, предпочтении приема пропилтиоурацила до/во время первого триместра, тиамазола с 16-й недели беременности, необходимости немедленно обратиться к врачу. При планируемой беременности на фоне компенсированной БГ (стабильный эутиреоз перед попыткой забеременеть) получавшие тиамазол должны быть переведены на пропилтиоурацил в течение первого триместра беременности [31]. Однако у принимавших низкие дозы тиамазола (< 5–10 мг/сут) или пропилтиоурацила (< 50–100 мг/сут) при наступлении беременности препарат может быть отменен до шестой – десятой недели под контролем уровня св. Т4 и ТТГ [31]. Известно, что только у 5% пациенток с отрицательными титрами АТ-рТТГ происходит рецидив тиреотоксикоза в течение восьми недель после отмены тиреостатика [41]. В связи с этим в первом триместре возможна отмена тиреостатика с обязательным контролем функции щитовидной железы каждые две недели. Если эутиреоз сохраняется, функцию щитовидной железы контролируют каждые четыре недели в течение второго и третьего триместров. Риск рецидива после отмены антитиреоидных препаратов увеличивается при лечении менее шести месяцев, высокой ежедневной дозе тиреостатика, высоком уровне АТ-рТТГ, низком или подавленном уровне ТТГ в сыворотке крови во время приема препаратов и наличии эндокринной офтальмопатии [42, 43].
Аналогичной позиции в отношении лечения гипертиреоза придерживаются зарубежные эксперты. Согласно рекомендациям экспертов АТА, цели лечения гипертиреоза во время беременности состоят в том, чтобы поддерживать умеренный гипертиреоз матери, избегая при этом развития гипотиреоза у плода. Для поддержания умеренного гипертиреоза у матери соотношение св. Т4/общего Т4 должно быть на уровне верхней границы нормы референтного диапазона с использованием самой низкой эффективной дозы антитиреоидных препаратов. Лечение гипертиреоза во время беременности показано в зависимости от этиологии, а также от тяжести гипертиреоза [35].
Оперативное лечение – тиреоидэктомия показана в случае противопоказаний или несогласия с приемом тиреостатиков, тяжелого течения тиреотоксикоза и необходимости приема высоких доз антитиреоидных препаратов, а также в случае непереносимости тиреостатиков (аллергические реакции или выраженная лейкопения). При тяжелом течении тиреотоксикоза в первом триместре высока вероятность спонтанного аборта, а в третьем триместре – преждевременных родов. Оперативное лечение следует проводить во втором триместре. После тиреоидэктомии или предельно субтотальной резекции щитовидной железы назначается заместительная терапия левотироксином натрия из расчета 2,3 мкг/кг [31].
При проведении тиреоидэктомии для лечения БГ рекомендуется достижение эутиреоза до зачатия.
Женщинам, получавшим радиойодтерапию, показана контрацепция минимум на шесть месяцев. Радиойодтерапия беременным категорически противопоказана. Если радиоактивный йод был случайно назначен и принят после 12-й недели беременности, необходимо проинформировать пациентку о радиационном риске, включая риск разрушения у плода щитовидной железы [44]. Рекомендации за или против прерывания беременности, во время которой женщина получила радиоактивный йод, отсутствуют [31].
Как известно, у женщин репродуктивного возраста во время беременности довольно часто выявляется узловой зоб. Согласно данным зарубежных источников, распространенность узлов щитовидной железы во время беременности колеблется от 3 до 21%. Оценка и лечение узлов щитовидной железы аналогичны таковым у небеременных. Чтобы исключить токсическую аденому, необходимо выполнить УЗИ щитовидной железы, определить уровень ТТГ. Показания к проведению тонкоигольной биопсии такие же, как и у небеременных. Доказано, что проведение тонкоигольной биопсии для беременных безопасно [35].
При ведении беременных с узловым зобом особое внимание следует уделять динамике лабораторных показателей, таких как кальцитонин, паратгормон, тиреоглобулин, АТ-рТТГ, с целью своевременного выявления патологических изменений.
Установлено, что распространенность АТ-ТПО у женщин детородного возраста достигает 6–20%. Такие пациентки подвержены более высокому риску развития гипотиреоза во время беременности, поэтому у них следует контролировать функцию щитовидной железы. Положительная реакция на АТ-ТПО связана со спонтанным прерыванием беременности, а также с повышенным риском преждевременных родов [45].
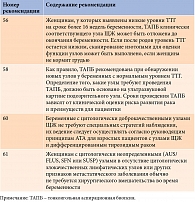
В настоящее время не получено достаточных доказательств, чтобы гарантировать назначение левотироксина натрия беременным с эутиреозом при наличии АТ-ТПО. Однако небольшая доза (от 25 до 50 мкг/сут) препарата может быть рассмотрена у беременных c положительным титром АТ-ТПО и эутиреозом, если в анамнезе имело место невынашивание беременности.
Другим важным вопросом эндокринологии является риск развития рака щитовидной железы у беременных. Современные тенденции в онкологии – четкая верификация опухоли, органосохраняющие операции, отсроченное медицинское пособие при возможности. Это нашло отражение в клинических рекомендациях по высокодифференцированному раку щитовидной железы (ВДРЩЖ).
В большинстве случаев ВДРЩЖ – опухоль с очень медленным ростом, латентным прогрессированием. Беременность не является фактором, способствующим прогрессированию ВДРЩЖ. Однако во время беременности снижается иммунитет, что может усилить злокачественный процесс. Отдаленный прогноз ВДРЩЖ, диагностированного во время беременности, не отличается от прогноза рака щитовидной железы, выявленного в других случаях. Поэтому при ВДРЩЖ прерывание беременности не рекомендуется [46].
В отечественных клинических рекомендациях по лечению ВДРЩЖ указано, что при цитологически диагностированном на ранних сроках беременности заболевании показано проведение УЗИ с частотой один раз в месяц. В большинстве случаев оперативное лечение может быть отложено до послеродового периода. Однако, если выявляется прогрессирующее увеличение опухоли или изменение в регионарных лимфатических узлах, рекомендовано оперативное лечение во втором триместре на сроке до 24-й недели с целью повышения контроля над заболеванием и выживаемостью [47]. У беременных, оперированных во втором триместре до 24-й недели, и у женщин, оперированных после родов, различий в показателях смертности и персистенции ВДРЩЖ не установлено.
Согласно данным ретроспективных исследований, прогноз не ухудшается даже при проведении оперативного лечения спустя год после первичной диагностики ВДРЩЖ во время беременности.
Если по результатам пункционной биопсии и цитологического исследования беременной поставлен диагноз ВДРЩЖ, показано оперативное лечение, однако решение о сроках его проведения должно быть индивидуализировано.
В ряде исследований сообщалось о более высокой частоте специфических и неспецифических осложнений у женщин, перенесших операцию в период беременности, по отношению к небеременным женщинам, что потребовало более длительного пребывания в стационаре и повышенных трат на лечение [46].
Женщинам, получавшим лечение по поводу ВДРЩЖ, рекомендуется планировать беременность через 6–12 месяцев после радиойодтерапии с целью снижения риска невынашивания беременности [48]. Объем комплексного лечения может быть индивидуализирован исходя из факта планирования беременности. В ряде случаев терапия радиоактивным йодом может быть отложена на более поздний период [47].
При планировании беременности после оперативного вмешательства на щитовидной железе показано поддержание стойкого эутиреоза с целью снижения риска рецидива и нормального развития плода [48].
Целесообразно назначение заместительной терапии левотироксином натрия с достижением целевых показателей ТТГ 0,1–2,5 мЕд/л. Контролировать содержание ТТГ в крови во время беременности следует один раз в шесть – восемь недель. Женщинам, которые получали лечение по поводу ВДРЩЖ, грудное вскармливание не противопоказано [47]. Мужчинам, леченным радиоактивным йодом, не следует участвовать в планировании беременности в течение 120 дней – периода жизни сперматозоида [47].
Рекомендации АТА 2017 г. представлены в табл. 3–5.
В целом российские и зарубежные рекомендации совпадают. Из различий следует отметить выделение пациенток с медуллярной карциномой или анапластическим раком, которым требуется более агрессивная тактика (оперативное лечение на момент выявления), указание на то, что после радиойодтерапии беременность возможна через шесть месяцев, при наблюдении за ВДРЩЖ контроль ЩЖ по результатам УЗИ и уровню тиреоглобулина проводится один раз в триместр, отдельную 66-ю рекомендацию – беременные с раком ЩЖ должны получать лечение для достижения уровня ТТГ в пределах нормальных значений для небеременных. ТТГ следует контролировать каждые четыре недели до 16–20-й недели гестации. Женщинам, имеющим в анамнезе лечение по поводу ВДРЩЖ, не требуются УЗИ и мониторинг уровня тиреоглобулина при ранее нормальном его уровне и отсутствии антител к тиреоглобулину.
Таким образом, дисбаланс тиреоидных гормонов у женщины во время беременности влияет на течение и исход беременности, а также на развитие плода и новорожденного. Основными путями достижения благополучного исхода беременности для матери и ребенка являются своевременная диагностика и контроль нарушений функции щитовидной железы, эффективная профилактика дефицита йода и коррекция выявленных осложнений.
A.N. Oranskaya, PhD
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
Contact person: Alevtina N. Oranskaya, anor2004@list.ru
Thyroid disease is common in the population. This article deals with the influence of thyroid hormones on the reproductive function of women, the development of the fetus and newborn. The normative ranges for hormone levels depending on the trimester of pregnancy are given. Influence of subclinical and clinical hypothyroidism, thyrotoxicosis. The question of the optimal and maximum allowable dose of iodine during pregnancy is considered. Dose adjustments of levothyroxine in preparation for pregnancy, against the background of gestation and the postpartum period. The use of drugs for the treatment of hyperthyroidism, which ones to choose and how to apply. Possibilities of surgical treatment during pregnancy. The tactics of managing patients with nodular goiter and neoplasms of the thyroid gland are considered. The recommendations of various thyroid associations are indicated.
