Ребамипид – гастроинтестинальный протектор с плейотропными свойствами
- Аннотация
- Статья
- Ссылки
- English
Актуальность защиты слизистой оболочки желудочно-кишечного тракта (ЖКТ) обусловлена многообразием экзогенных и эндогенных факторов агрессии. Собственный защитный аппарат ЖКТ (плотные межклеточные соединения, секреция бикарбонатов, факторы роста, мощная система кровоснабжения и т.д.) не всегда справляется с этой задачей, особенно при одновременном воздействии нескольких повреждающих факторов – соляной кислоты, протеолитических ферментов, Helicobacter pylori, нестероидных противовоспалительных препаратов (НПВП), алкоголя, никотина, компонентов желчи и др. [1, 2].
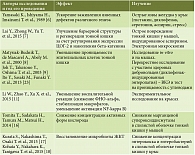
Новый препарат с гастро- и энтеропротективными свойствами ребамипид (производное 2-хинолинона) был разработан японскими учеными в конце XX в. Впоследствии были выявлены его основные эффекты: индукция синтеза простагландинов Е2 и GI2, улучшение кровотока в слизистой оболочке ЖКТ, уменьшение ее повышенной проницаемости, выведение свободных радикалов, противовоспалительное действие, повышение секреции желудочной слизи [3–5] (табл. 1).
Экспериментальные исследования ребамипида
Первые сообщения о препарате появились в конце 1980-х гг. Большинство экспериментальных работ по его изучению проводились японскими учеными. В экспериментах на крысах было показано, что новый препарат – суспензия ребамипида – отлично влиял на заживление язвенных дефектов различного генеза (аспирин, индометацин, стресс, химические агенты) и предотвращал их развитие. При этом препарат не ингибировал желудочную секрецию [6].
Результаты другого исследования продемонстрировали способность ребамипида подавлять целекоксиб-ассоциированный апоптоз клеток слизистой оболочки ЖКТ, чем и объяснялся его протективный эффект, подтвержденный позднее [3].
Чтобы вызвать острое повреждение тонкой кишки, в течение пяти дней мышам вводили аспирин (200 мг/кг/сут). Затем на протяжении пяти дней животные получали ребамипид (320 мг/кг/сут). Структурные изменения тонкой кишки оценивали с помощью электронной микроскопии. У мышей, получавших ребамипид, повреждения были менее выраженными, межклеточные пространства более плотными.
Исследователи сделали вывод, что введение ребамипида при аспирин-индуцированном повреждении улучшает барьерную структуру кишечника и способствует регенерации тонкой кишки за счет регулирования экспрессии циклооксигеназы 2 и накопления бета-катенина [7].
В ряде исследований in vitro при использовании ребамипида у крыс улучшалась целостность кишечного барьера и снижалась проницаемость эпителиальных клеток желудка [8, 9].
Японские ученые изучали возможности ребамипида в профилактике желудочно-кишечных кровотечений. В опытах на крысах стимулировали желудочную секрецию гистамином, после чего проводили перфузию аспирина. За 24 часа до перфузии аспирина применяли перорально клопидогрел. Исследователи оценивали профилактическое действие различных противоязвенных препаратов, в том числе ребамипида в дозах 3–30 мг/кг. Как показали результаты, способность ребамипида предупреждать кровотечения сопоставима с таковой антисекреторных препаратов и других протекторов (ирсогладин, тепренон). При этом ребамипид не влиял на желудочную секрецию [10].
Ребамипид характеризуется и противовоспалительным эффектом, причем не только в отношении заболеваний ЖКТ. Препарат уменьшает воспалительную реакцию, связанную с действием фактора некроза опухоли (ФНО) альфа, стабилизирует клеточную линию макрофагов, уменьшает активацию ядерного фактора каппа B (nuclear factor kappa B – NF-kappa B), прерывая воспалительный сигнальный путь [11].
Благодаря высокоэффективным гастропротективным свойствам ребамипид служил эталоном при исследовании других гастропротекторов. Так, в исследовании гастропротективных свойств препарата ПМК-S005 (синтетический S-аллил-L-цистеин) при остром этанол-индуцированном желудочном повреждении у крыс его сравнивали именно с ребамипидом (50 мг/кг) [12].
Сегодня в связи с широким применением НПВП, в том числе низких доз аспирина (НДА), препарат с высокими протективными свойствами актуален как никогда. Количество пациентов, особенно пожилых, постоянно принимающих аспирин и/или НПВП, неуклонно растет. Вместе с этим увеличивается частота желудочно-кишечных кровотечений, в частности тяжелых. Активное использование НДА в целях профилактики сердечно-сосудистых и цереброваскулярных осложнений приводит к изъязвлениям ЖКТ и кровотечениям. Изучение данной проблемы, равно как и профилактические меры, в большей мере касалось верхних отделов ЖКТ. Применение видеокапсульной энтероскопии (ВКЭ) показало, что НПВП повреждают не только верхние отделы ЖКТ, но и тонкую кишку, что проявляется изъязвлениями, кровотечениями и анемией. Если при кровотечениях из внутренних отделов ЖКТ определенную роль играет желудочная секреция, то механизм повреждения слизистой оболочки кишечника, где кислая среда отсутствует, не до конца понятен [13–15].
В ряде исследований индуцированное приемом НПВП увеличение активных форм кислорода (АФК) приводило к повреждению митохондрий. Как следствие, нарушалась целостность слизистой оболочки кишечника. Эти данные были подтверждены в опытах на мышах. При исследовании областей повреждения тонкой кишки на фоне приема НПВП методом флоуоресценции была выявлена повышенная концентрация АФК. Назначение ребамипида существенно снижало концентрацию АФК и количество поврежденных клеток в слизистой оболочке тонкой кишки. Скорее всего это было обусловлено активацией марганцевой супероксиддисмутазы [16].
Энтеропротективные свойства ребамипида объясняются его модулирующим воздействием на микробиоту. На фоне применения препарата снижается до нормального уровня концентрация энтерококка и энтеробактерий в слизистой оболочке подвздошной кишки. Кроме того, уменьшается воспаление за счет супрессии гена, ответственного за экспрессию ФНО-альфа и Duox2 (двойная оксидаза, регулирующая секрецию слюнных желез и желез ЖКТ) [17].
В экспериментах на крысах показано, что при использовании ребамипида изменяется состав микробиома пищевода, вследствие чего уменьшается риск развития пищевода Барретта [18].
К сожалению, эрадикация инфекции, вызванной H. pylori, не способна полностью устранить риск развития рака желудка. Поэтому проблема его профилактики актуальна и сегодня. В экспериментах на крысах при индуцированном канцерогенезе (N-метил-N’-нитро-N-нитрозогуанидин) показан превентивный эффект ребамипида. Заболеваемость раком в группе ребамипида была достоверно ниже, чем в группе контроля (р < 0,05). При этом наблюдалась тенденция к более низкой частоте инвазии карциномы в мышечный слой в группе ребамипида [19].
Большое количество пациентов нуждаются в антиагрегантной терапии. Но даже НДА при регулярном приеме более чем в 90% случаев приводят к развитию гастро- и энтеропатий (диспепсия, острое поражение слизистой оболочки, эрозии, язвы и их осложнения – язвенное кровотечение и смерть). Ингибиторы протонной помпы (ИПП) не всегда эффективны в целях профилактики и лечения НПВП-гастропатий. ИПП неэффективны при повреждениях слизистой оболочки тонкой кишки и могут снижать эффективность антиагрегантной терапии (омепразол, эзомепразол).
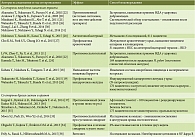
Протективные свойства ребамипида подтверждены не только экспериментально, но и клинически (табл. 2).
Клинические исследования
Противоязвенный и противовоспалительный эффекты ребамипида в отношении НПВП-энтеропатий, в том числе при приеме НДА, зафиксированы в исследовании с участием здоровых добровольцев. Общее количество аспирин-ассоциированных повреждений подвздошной кишки к четвертой неделе терапии у здоровых добровольцев было в три раза ниже при использовании ребамипида (р = 0,03). Интересно, что эффективность ребамипида обусловлена не только системным действием после абсорбции из ЖКТ, но и прямым местным проникновением в слизистую оболочку ЖКТ при перемещении по ЖКТ [20–22].
Одним из ключевых механизмов развития энтеропатии является нарушение проницаемости слизистой оболочки тонкой кишки. Этот механизм доказан в исследовании, посвященном сравнительной оценке эффективности ребамипида и ИПП при лечении диклофенак-индуцированной энтеропатии [23].
В другом исследовании изучали изменения гистологической картины гастрита у пациентов, получавших ребамипид после эрадикации H. pylori. 169 пациентов, достигшие успешной эрадикации, были случайным образом разделены на две группы – основную (n = 82) и контрольную (n = 87). Пациенты основной группы получали ребамипид. Гистопатологические изменения оценивали по обновленной системе Sydney в начале исследования и год спустя. Результаты показали достоверное уменьшение выраженности хронического воспаления в области малой кривизны тела желудка на фоне приема ребамипида после эрадикации H. pylori по сравнению с контрольной группой (1,12 ± 0,08 против 1,35 ± 0,08; р = 0,043) [24].
176 пациентов с хроническим гастритом получали ребамипид в течение 26 недель. При оценке до и после лечения в основной и контрольной группах методом иммуногистохимии установлено, что ребамипид улучшал состояние слизистой оболочки желудка за счет снижения в ней экспрессии CDX2 (р = 0,021) и TFF3 (р = 0,012) – иммуногистохимических маркеров дисплазии и карциномы. Отмечались высокая эффективность и безопасность препарата, а также хорошая приверженность пациентов лечению [25].
У 38 пациентов, получавших НДА (100 мг) свыше трех месяцев, для лечения энтеропатии использовали высокие дозы ребамипида (300 мг/сут). После восьми недель лечения в группе ребамипида по сравнению с группой плацебо достоверно уменьшилось количество повреждений (язвы, эрозии) слизистой оболочки (р = 0,046), что было подтверждено при выполнении ВКЭ. Высокие дозы переносились удовлетворительно [26].
Ребамипид достоверно снижает риск тонкокишечных кровотечений, что было показано с помощью ВКЭ в исследовании с участием 31 пациента с ИБС, получавших антитромбоцитарный препарат (тиенопиридин) и НПВП (отношение рисков 0,31, 95%-ный доверительный интервал 0,12–0,82, р = 0,02) [27].
Определенные трудности связаны с профилактикой и лечением язв желудка после эндоскопической подслизистой диссекции. Систематический обзор и метаанализ показали, что добавление к ИПП ребамипида в течение восьми недель до и четырех недель после процедуры сокращает частоту изъязвлений и ускоряет сроки заживления постоперационных язв по сравнению с монотерапией ИПП [28–30].
В пилотных проектах (шесть исследований, 611 пациентов) добавление ребамипида повышало эффективность эрадикации H. pylori. Так, в группе пациентов, получавших ребамипид в дополнение к амоксициллину и ИПП, эрадикация составила 73,3%, в группе без ребамипида – 61,4% (р < 0,05) [31].
Побочные эффекты препарата
Как протектор ребамипид сопоставим с мизопростолом, но более безопасен. Из 10 047 пациентов, принимавших ребамипид, нежелательные реакции, включая отклонение лабораторных показателей от нормы, отмечали 54 (0,54%). Нежелательные явления преимущественно были связаны с ЖКТ: запор, метеоризм, тошнота, диарея. Однако на фоне применения ребамипида эти явления наблюдались реже, чем при использовании мизопростола. Кроме того, зарегистрированы незначительные изменения в результатах анализов крови: повышение содержания печеночных ферментов, азота мочевины, щелочной фосфатазы, лейкопения, лимфоцитоз и тромбоцитопения. Важный момент: характер и частота возникновения нежелательных реакций у пожилых и непожилых пациентов не различались. Из 3035 пациентов в возрасте старше 65 лет нежелательные реакции имели место у 18 (0,59%) [32].
Возможно нарушение менструального цикла. Тройные дозы ребамипида (900 мг/сут), которые назначались здоровым добровольцам, а также пациентам с НПВП-индуцированной энтеропатией, переносились удовлетворительно [26].
Описано небольшое повышение уровня трансаминаз без гепатотоксического эффекта при гистологическом исследовании печени крыс, получавших ребамипид. Структурные изменения в печени отсутствовали, концентрация биомаркеров окислительного стресса не менялась [33–35].
В 12-недельном рандомизированном многоцентровом двойном слепом исследовании сравнивали эффективность и безопасность ребамипида с таковыми мизопростола у 479 больных с высоким риском НПВП-осложнений. Переносимость ребамипида была лучше [33].
Таким образом, ребамипид оказывает цитопротекторное действие в отношении слизистой оболочки желудка и тонкой кишки при повреждающем воздействии различных факторов, прежде всего НПВП. Препарат способствует активации энзимов, ускоряющих биосинтез высокомолекулярных гликопротеинов, повышает содержание слизи на поверхности стенки желудка, улучшает кровоснабжение слизистой оболочки желудка, активизирует ее барьерную функцию, усиливает пролиферацию и обмен эпителиальных клеток желудка, очищает слизистую оболочку от гидроксильных радикалов и подавляет супероксиды, продуцируемые полиморфноядерными лейкоцитами и нейтрофилами. Подтверждение тому – результаты экспериментальных и клинических исследований.
Эффекты ребамипида со стороны разных органов и систем
Положительные эффекты препарата наблюдаются не только со стороны ЖКТ. В ряде исследований показано, что ребамипид ингибирует воспаление суставов, восстанавливая дисбаланс между Th17 и T-регуляторными клетками и активируя оксигеназу Nrf2/HO-1 [36]. Кроме того, после использования в течение двух недель 2%-ного раствора ребамипида в виде глазных капель снижается уровень интерлейкинов (ИЛ) 6, 17, ФНО-альфа в слезной жидкости, а следовательно, уровень воспаления.
Показано, что 2%-ная суспензия ребамипида намного эффективнее 0,1%-ного раствора гиалуроната натрия у пациентов с синдромом «сухого глаза» [37].
Результаты пилотных исследований ребамипида продемонстрировали хороший эффект в заживлении язв и эрозий слизистой оболочки полости рта при рецидивирующем афтозном стоматите и болезни Бехчета. Полоскания раствором ребамипида эффективны при воспалении слизистой оболочки полости рта у пациентов после химиотерапии [38–40].
Изучается возможность использования ребамипида при витилиго. Ребамипид за счет ингибирования цитокинов ИЛ-6, ИЛ-8, ИЛ-10, ФНО-альфа и Th17 влияет на окислительный стресс, играющий определенную роль в развитии витилиго [41].
В 2016 г. ребамипид появился на российском фармацевтическом рынке под торговым названием Ребагит («ПРО.МЕД.ЦС Прага а.o.»). Теперь в арсенале отечественных врачей имеется уникальный гастро- и энтеропротектор, не имеющий аналогов в России, с доказанной эффективностью и безопасностью. Препарат можно использовать для лечения и предупреждения заболеваний не только ЖКТ, но также других органов и систем.
M.F. Osipenko, Ye.A. Bikbulatova
Novosibirsk State Medical University
Contact person: Marina Fedorovna Osipenko, ngma@bk.ru
In 2016, drug Rebagit (rebamipide) having no analogues in Russia, with proved efficacy and safety, appeared on domestic pharmaceutical market. This unique gastro- and enteroprotective agent is efficient in treatment and prevention of diseases not only targeting gastrointestinal tract, but other body organs and systems as well.