количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Теория
Роль фолатов в развитии осложнений беременности
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Акушерство и гинекология" № 3 (35)
- Аннотация
- Статья
- Ссылки
- English
В статье рассматриваются биологические функции фолатов в организме, описан метаболизм фолиевой кислоты. Анализируется роль фолиевой кислоты при беременности, а также обсуждаются негативные последствия дефицита и переизбытка фолатов в период гестации. Приведены результаты наблюдения за беременными с полиморфизмом гена метилентетрагидрофолатредуктазы, которые принимали витаминно-минеральный комплекс, содержащий активную форму фолатов – метафолин. Применение комплекса позволило качественно и количественно нормализовать гематологические показатели, а также значительно снизить риск осложнений беременности.
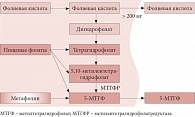
Рис. 1. Метаболизм фолатов в кишечнике
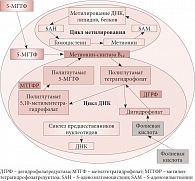
Рис. 2. Метаболизм фолатов в клетке

Рис. 3. Гематологические показатели у женщин с полиморфизмом гена метилентетрагидрофолатредуктазы (n = 51)

Таблица 1. Отягощенный акушерско-гинекологический анамнез у женщин с полиморфизмом гена метилентетрагидрофолатредуктазы (n = 51)
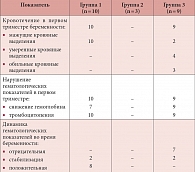
Таблица 2. Частота кровотечений и нарушений гематологических показателей у беременных с полиморфизмом гена метилентетрагидрофолатредуктазы (n = 22)
Роль фолиевой кислоты в организме. Дефицит фолатов и осложнения беременности
Фолаты, содержащиеся в пищевых продуктах, представляют собой химические соединения на основе фолиевой кислоты (витамина В₉). Они участвуют в важнейших обменных процессах в организме. Так, фолаты играют ключевую роль в синтезе нуклеотидов и репликации ДНК, без которых невозможны физиологическое деление и нормальный рост всех клеток [1, 2]. При дефиците фолатов процесс репликации нарушается, что в первую очередь отражается на быстро пролиферирующих клетках, таких как кроветворные и эпителиальные. Повреждение кроветворных клеток приводит к нарушению гемопоэза в костном мозге и формированию мегалобластного типа кроветворения, который обнаруживается фолиеводефицитной мегалобластной анемией [3]. В результате повреждения эпителиальных клеток ухудшается регенерация кожи и слизистых оболочек [1, 2].
Фолаты также принимают участие в реакциях метилирования белков, гормонов, липидов, нейромедиаторов и других субстратов обмена веществ [4]. Нарушения цикла метилирования проявляются различными невропатиями и болезнью Альцгеймера, что обусловлено повреждением оболочки нервных окончаний и нарушением проводимости по ним нервных импульсов [4, 5, 7].
Важнейший субстрат для метилирования в организме – ДНК. Метилирование ДНК обеспечивает функционирование клеточного генома, регуляцию онтогенеза и клеточную дифференцировку. Иммунная система через реакции метилирования распознает и подавляет экспрессию чужеродных генов. Результатом дефектов метилирования становятся такие патологические состояния, как рак, атеросклероз, нейродегенеративные, аутоиммунные и аллергические заболевания [4, 6, 8–10].
Наряду с кроветворными и эпителиальными клетками к быстро пролифелирующим относятся ткани хориона, которые также высокочувствительны к негативному влиянию дефицита фолатов. Расстройство работы генома эмбриональных клеток во время их деления и дифференцировки приводит к нарушению эмбриогенеза и формированию пороков развития у плода [11–15].
Один из тяжелейших пороков, связанных с дефицитом фолатов, – незаращение нервной трубки у плода. По данным рандомизированного плацебоконтролируемого исследования, дополнительный прием фолатов снижал частоту развития порока нервной трубки на 72% (1,0% у беременных, принимавших фолаты, и 3,5% у беременных, не принимавших фолаты) [11]. Необходимость дополнительного приема фолатов во время беременности для обеспечения нормального развития плода и рождения здорового ребенка подтверждают и другие масштабные исследования [16–20].
Существует четкая зависимость частоты порока нервной трубки у плода от уровня фолатов в эритроцитах крови беременной [21]. Минимально достаточная концентрация фолатов для рождения здорового ребенка составляет 906 нмоль/л и встречается в популяции всего в 13% случаев [22], поэтому программы по дотации фолатов беременным существуют во всем мире [4, 13, 17].
Дефицит фолатов приводит не только к дефектам нервной трубки у плода, но и к целому спектру различных аномалий мозга, конечностей, ушей, мочевыделительной системы, а также формированию расщелины верхнего неба и омфалоцеле [15, 23–25]. Чаще всего (примерно у одного из 100 новорожденных) встречаются пороки сердечно-сосудистой системы. В одном из исследований было показано, что дополнительный прием фолиевой кислоты на протяжении четырех недель до зачатия и первых 12 недель беременности снижает риск развития врожденного порока сердца на 26% и дефекта сердечной перегородки – на 40% [19].
Кроме негативного влияния на эмбриогенез недостаточное потребление фолатов во время беременности нарушает пролиферацию клеток хориона и формирование плаценты [15, 23, 25]. В дальнейшем это приводит к осложненному течению беременности: повышается риск невынашивания, плацентарной недостаточности и задержки роста плода, увеличивается количество случаев преэклампсии [20, 21, 24, 26]. Риск данных осложнений еще более возрастает при обнаружении в крови высокого уровня гомоцистеина, метаболизм которого напрямую связан с метаболизмом фолатов [25–30].
Метаболизм фолатов
Как известно, фолаты не синтезируются в организме, поэтому их нужно получать либо из продуктов питания, либо посредством дополнительного приема. Большинство пищевых фолатов при поступлении в организм биологически не активны. Всасывается в систему кровообращения и затем потребляется клетками только одна форма фолиевой кислоты – моноглутамат 5-метилтетрагидрофолат (5-МТГФ) (рис. 1). Остальные формы фолатов представляют собой полиглутаматы, которые в щеточной каемке слизистой кишечника преобразуются в моноглутаматы и при всасывании из кишечника в кровь под воздействием фермента метилентетрагидрофолатредуктазы (МТГФР) тоже превращаются в моноглутамат 5-МТГФ. Последний поступает в клетки организма и участвует в биологических процессах: циклах клеточной репликации и метилирования (рис. 2) [1, 2, 4].
Цикл метилирования включает трансформацию аминокислоты метионин, поступающей в организм с продуктами животного происхождения (мясом, молоком и яйцами), в S-аденозилметионин и затем гомоцистеин. S-аденозилметионин является донором метила для всех клеточных метилтрансфераз, метилирующих различные субстраты (ДНК, белки, липиды). После потери метильной группы он преобразуется в гомоцистеин, часть которого метаболизируется при участии В₆-зависимого фермента цистатионин-синтазы и выводится почками, а часть повторно метилируется и превращается в метионин, что ведет к возобновлению клеточного цикла метилирования.
Повторное метилирование гомоцистеина происходит за счет метильных групп поступившего в клетки моноглутамата 5-МТГФ, которые транспортируются с помощью В₁₂-зависимого фермента метионин-синтазы. Таким образом, фолаты обеспечивают постоянное снабжение метильными группами циклы метилирования [1, 2, 4, 31]. После участия в цикле метилирования 5-МТГФ вновь превращается в полиглутаматы фолиевой кислоты.
Полиглутаматы участвуют в другом не менее важном процессе обмена веществ: обеспечивают цикл синтеза ДНК и клеточную репликацию. В результате данных реакций образуются промежуточные формы фолиевой кислоты: полиглутамат, дигидрофолат и 5,10-метилентетрагидрофолат. Дигидрофолаты с помощью фермента дегидрофолатредуктазы обратно превращаются в полиглутаматы тетрагидрофолатов и вновь используются в синтезе предшественников нуклеотидов для образования ДНК и клеточного деления. В свою очередь 5, 10-метилентетрагидрофолаты под воздействием фермента МТГФР повторно превращаются в активный моноглутамат 5-МТГФ, который наряду с поступившим из крови метилфолатом используется для повторного метилирования гомоцистеина в метионин и участия последнего в циклах метилирования [1, 2, 4, 31].
Уровень гомоцистеина в крови строго контролируется как реметилированием, так и выведением его из организма. Исследования последних лет показывают, что любое увеличение уровня гомоцистеина в крови повышает риск тромбофилических осложнений: инфаркта миокарда, инсульта и венозной тромбоэмболии [32, 34]. Вместе с тем непосредственного участия в деятельности свертывающей системы крови гомоцистеин не принимает, и его эффект осуществляется опосредованно. Гипергомоцистеинемия вызывает повреждение сосудистого эндотелия, в результате чего активируются факторы свертывающей системы крови и повышается риск тромбообразования, в то время как деятельность антисвертывающего звена гемостаза ухудшается. Кроме того, в местах повреждения сосудистой стенки откладываются холестерин и кальций, образуя атеросклеротические бляшки, в результате чего просвет сосудов сужается, нарушается кровообращение и развивается ишемическая болезнь сердца [3, 34–36].
Нижний уровень содержания гомоцистеина в сыворотке крови составляет 5 мкмоль/л, верхний предел варьирует между 10 и 20 мкмоль/л в зависимости от возраста, пола, этнической группы и особенностей потребления фолатов. В ряде крупномасштабных исследований было показано, что при сывороточной концентрации гомоцистеина выше 10 мкмоль/л значительно увеличивается риск развития ишемической болезни сердца, инсульта, инфаркта, а также злокачественных новообразований [32, 35]. Повышение уровня гомоцистеина крови всего на 5 мкмоль/л увеличивает риск атеросклеротического поражения сосудов на 80%, острого инфаркта и инсульта – на 50% [32]. Наряду с этим значительно растет показатель общей смертности, включающий смертность как от сердечно-сосудистых заболеваний, так и от не связанных с ними причин, в том числе злокачественных новообразований [8, 32, 37, 38].
В акушерской практике также актуален контроль уровня гомоцистеина в сыворотке крови [25, 29, 39, 40]. При повышенном содержании гомоцистеина усиливается тромбообразование в зоне плацентации, что ведет к развитию отслоек и инфарктов плаценты, нарушению кровообращения в ней с формированием плацентарной недостаточности и осложненному течению беременности [26, 28]. Результаты масштабного исследования [33], охватившего 5883 женщины и их 14 415 беременностей в период 1967–1996 гг., подтвердили достоверное повышение риска развития преэклампсии, отслойки плаценты, преждевременных родов и рождения детей с низкой массой тела (менее 1500 г) при концентрации гомоцистеина в сыворотке крови более 9 мкмоль/л. Частота осложнений беременности коррелировала со степенью повышения уровня гомоцистеина [33, 38].
В других исследованиях было показано достоверное снижение частоты преждевременных родов и рождения детей с экстремально низкой массой тела при дополнительном приеме фолиевой кислоты, причем с четкой зависимостью от длительности назначения фолиевой кислоты до наступления беременности [20, 40, 41].
Гипергомоцистеинемия может быть приобретенной и наследственной. Приобретенная гипергомоцистеинемия возникает при недостаточном поступлении фолатов с пищей, нарушении их всасывания в кровь на фоне заболеваний кишечника, дефиците витамина В₁₂. Алкоголизм, курение, некоторые лекарственные средства (противосудорожные, противоопухолевые, гормональные контрацептивы), гипотиреоз, сахарный диабет могут также приводить к дефициту фолатов и развитию гипергомоцистеинемии. Накопление сывороточного гомоцистеина может быть следствием нарушения его выведения, например, при заболеваниях почек и недостатке витамина В₆ [2, 4, 30, 31].
Причиной наследственной гипергомоцистеинемии является полиморфизм гена фермента МТГФР – основного фермента метаболизма фолатов в организме. Он преобразует все неактивные формы фолиевой кислоты, поступившие в организм (рис. 1), а также полиглутаматы, находящиеся в клетках, в биологически активный 5-МТГФ (рис. 2). В результате генетического полиморфизма функция данного фермента снижается (при гомозиготной форме – на 75% от исходной, при гетерозиготной – на 30%), что ведет к резкому снижению поступления в кровь активных фолатов и образования их в клетках, а также развитию дефицита фолатов [1, 2, 42, 43]. Женщины с полиморфизмом гена МТГФР относятся к группе высокого риска по развитию сердечно-сосудистых заболеваний [36, 43]. Кроме того, у них значительно чаще регистрируются пороки развития плода и осложненное течение беременности [1, 28, 44–45].
Применение фолиевой кислоты во время беременности
Как показали последние исследования, традиционное назначение препаратов фолиевой кислоты при нарушении функции ферментов фолатного цикла оказалось малоэффективным [1, 43]. Синтетическая фолиевая кислота так же, как и большинство пищевых фолатов, биологически не активна и только с помощью фермента МТГФР преобразуется в активный моноглутамат 5-МТГФ. Следует отметить: в отличие от пищевых фолатов синтетическая фолиевая кислота даже в неметаболизированном виде может поступать в системный кровоток и захватываться клетками. Появление неметаболизированной формы в крови происходит уже при суточном потреблении фолиевой кислоты более 200 мкг, что обусловлено ограниченными возможностями ферментативной системы слизистой оболочки кишечника. Поступая в клетки, она блокирует рецепторы и ферменты, с которыми взаимодействуют эндогенные активные фолаты, и, несмотря на достаточный и даже избыточный прием фолиевой кислоты, возникает или еще больше усугубляется функциональный дефицит фолатов. Активные эндогенные фолаты не могут реализовать свои эффекты из-за избытка введенной синтетической фолиевой кислоты [43–45].
Таким образом, для организма опасен не только недостаток фолатов, но и избыток синтетической фолиевой кислоты. Эпидемиологические и клинические исследования позволили установить двунаправленную связь между приемом фолиевой кислоты, уровнем фолатов в крови и онкологическими заболеваниями. Онкологический риск повышается как при дефиците фолатов, так и при передозировке синтетической фолиевой кислоты [8, 46–48, 50].
Избыток синтетических фолатов при беременности также ассоциирован с неблагоприятными последствиями для плода. С ним связывают нарушение когнитивных способностей и зрения у новорожденного, ожирение в старшем возрасте [12, 26, 44]. Избыток витаминов группы В, к которым относится фолиевая кислота, может вызывать тяжелые аллергические реакции в организме беременной вплоть до генерализованной токсикодермии. Нами был описан случай, когда беременная принимала по четыре таблетки, содержащие 1 мг фолиевой кислоты, в сутки в сочетании с поливитаминами [51]. Есть данные о повышении впоследствии риска развития рака молочной железы при применении высоких доз (5 мг) фолиевой кислоты во время беременности [52].
В этой связи отношение к фолиевой кислоте по принципу «много не бывает» в настоящее время признано ошибочным. Суточная потребность в фолатах составляет всего 400 мкг или 0,4 мг. Для беременных эта доза может быть несколько увеличена, но не должна превышать 1 мг в сутки – так называемый физиологический предел [1, 45]. В приказе Министерства здравоохранения РФ от 12 ноября 2012 г. № 572н «Об утверждении Порядка оказания медицинской помощи по профилю „акушерство и гинекология (за исключением использования вспомогательных репродуктивных технологий)“» также рекомендован ежедневный прием 400 мкг фолиевой кислоты на протяжении первого триместра беременности [53].
Метафолин – биологически активная форма фолатов
В последние годы исследования по профилактике осложнений, связанных с дефицитом фолатов, сфокусированы на дополнительном приеме другой формы фолиевой кислоты – 5-МТГФ, или метафолина. Это обусловлено высокой распространенностью генетического полиморфизма МТГФР среди населения, с чем связана пониженная активность основного фермента фолатного цикла. Так, гомозиготный полиморфизм встречается в 15–20% случаев, гетерозиготный – в 40–60%. В отличие от синтетической фолиевой кислоты метафолин является биологически активной формой фолатов и всасывается в кровь без участия ферментативных систем кишечника, в том числе фермента МТГФР. Он непосредственно захватывается клетками и используется в обменных процессах – репликации ДНК и циклах метилирования (рис. 1, 2) [15, 39]. При исследовании уровня фолатов в эритроцитах крови у женщин с полиморфизмом гена МТГФР с различным типом наследования R. Prinz-Langenohl и соавт. показали, что метафолин значительно в большей степени повышает их содержание, чем фолиевая кислота [42]. Кроме того, метафолин в большей степени, чем фолиевая кислота, влияет на сывороточный уровень гомоцистеина [52].
Биологически активная форма фолиевой кислоты – метафолин содержится в препарате Фемибион. В состав препарата входит 400 мкг фолатов, половина из которых представлена фолиевой кислотой и половина – метафолином. Фемибион включает другие витамины группы В (В₁, В₂, В₅, В₆ и В₁₂), а также витамины С, Е, РР и йод.
Назначать препараты, содержащие фолиевую кислоту, необходимо не менее чем за восемь недель до планируемой беременности. Именно такой срок необходим для накопления клетками минимально достаточного количества фолатов, обеспечивающего профилактику осложнений беременности и пороков развития у плода. При наступлении беременности прием фолатов необходимо продолжить до 12 недель, то есть на весь период закладки органов и систем плода и формирования плаценты [54].
При наличии генетического полиморфизма фермента МТГФР дополнительный прием фолатов проводится не только на прегравидарном этапе и во время первого триместра беременности, но и на протяжении всей беременности, а также трех – шести месяцев послеродового периода, когда риск тромбофилических осложнений особенно высок [55].
Дефицит фолатов у женщин с полиморфизмом гена МТГФР связан не только с тромбофилическими и онкологическими рисками. Наши исследования показали, что при этом значительно повышается риск геморрагических осложнений, в частности аномальных маточных кровотечений.
Клиническое наблюдение женщин с полиморфизмом гена МТГФР
В период 2012–2014 гг. под нашим наблюдением находилась 51 женщина в возрасте 18–45 лет с генетическим полиморфизмом фермента МТГФР (рис. 3). У 57% из них была выявлена гомозиготная форма полиморфизма, у 43% – гетерозиготная. Обследование проводилось в многопрофильном медицинском центре «КМ-Клиник» г. Москвы.
У 54% женщин определялась тромбоцитопения – снижение количества тромбоцитов в сыворотке крови. При этом наследственные и аутоиммунные причины тромбоцитопении (идиопатическая тромбоцитопеническая пурпура, болезнь Виллебранда и др.) были исключены. Тромбоцитопения во всех случаях была умеренной – от 105–180×10⁹/л.
Следует отметить: тромбоцитопения часто сочетается с другими признаками функциональной недостаточности тромбоцитарного звена гемопоэза (нарушением агрегации тромбоцитов, удлинением активированного частичного тромбинового времени, снижением адгезивности тромбоцитов, удлинением времени кровотечения). Данные изменения наряду с большим размером и объемом клеток тромбоцитарного ростка, как правило, характеризуют мегалобластный тип кроветворения и свидетельствуют о нарушениях гемопоэза в костном мозге [56]. Одной из причин замены нормобластного типа кроветворения на мегалобластный является недостаток фолатов. С дефицитом фолатов связывают нарушение синтеза ДНК и деления кроветворных клеток, что приводит не только к уменьшению их количества и увеличению объема, но и к функциональной недостаточности (как следствию укорочения периода жизни мегалобластов в циркулирующей крови) и более быстрому разрушению в костном мозге [45, 56]. При повреждении таким образом тромбоцитарного ростка повышается риск развития кровотечений.
В нашем исследовании тромбоцитопатия у женщин с генетическим полиморфизмом МТГФР встречалась значительно чаще, чем гипергомоцистеинемия (высокий уровень гомоцистеина в крови определялся у 22% (n = 11)). Вместе с тем только у 12% (n = 6) имелось повышенное количество тромбоцитов в крови, которое у половины сочеталось с их функциональной недостаточностью. Данную гипотезу подтверждает высокая частота патологических маточных кровотечений у женщин с полиморфизмом гена МТГФР: почти у половины (49%) имели место аномальные маточные кровотечения преимущественно в виде обильных и/или длительных менструаций и у каждой пятой – кровотечение после родов или аборта, которое в двух случаях привело к гемотрансфузии (табл. 1).
У 37% (n = 19) женщин с полиморфизмом гена МТГФР были выявлены лабораторные признаки анемии. В абсолютном большинстве случаев (n = 16) снижался только уровень гемоглобина (до 90–110 г/л), тогда как количество эритроцитов находилось в пределах нормы. Характерные для мегалобластного пути кроветворения макроцитоз и гиперхромия эритроцитов [56] отмечались только у трех женщин.
Таким образом, при полиморфизме гена МТГФР тромбоцитарный росток гемопоэза в сравнении с эритроцитарным подвержен большему повреждающему влиянию дефицита фолатов, что обусловливает высокую частоту гинекологических и акушерских кровотечений.
С дефицитом фолатов традиционно связывают акушерские осложнения [22, 33]. Так, 39% наших пациенток страдали бесплодием, у 30% была неразвивающаяся беременность, у 10% – преэклампсия в анамнезе. В 6% случаях зафиксированы пороки развития плода: дефект межжелудочковой перегородки, анэнцефалия и множественные пороки развития. Все полученные в данном исследовании показатели значительно превышали данные в общей популяции [33].
В нашем наблюдении 22 женщины с полиморфизмом гена фермента МТГФР были беременными (табл. 2). При этом у абсолютного большинства из них (86%) отмечалось кровотечение в первом триместре беременности, интенсивность которого варьировала от скудных мажущих кровяных выделений до 300–500 мл в сутки. Следует отметить, что все женщины получали от 0,4 до 5 мг/сут фолатов на протяжении всей беременности и трех месяцев после родов.
Десять из этих женщин с наступлением беременности начали принимать Фемибион (группа 1). Во всех случаях мы отмечали мажущие кровяные выделения из половых путей в первом триместре (использовались одна – три ежедневных прокладок в сутки). Течение беременности нормализовалось в течение пяти – десяти дней после назначения комплексной сохраняющей терапии. В ее состав входили вагинальный микронизированный прогестерон по 400–600 мг/сут до 12 недель (у пяти женщин с отягощенным акушерско-гинекологическим анамнезом вагинальный прогестерон назначался по 200 мг до 36-й недели беременности) и транексамовая кислота по 1,5–3 г/сут внутрь в течение одной-двух недель. Все беременности завершились рождением живых доношенных детей, кровотечений в родах и послеродовом периоде не наблюдалось.
Три женщины начали принимать Фемибион за шесть – восемь недель до наступления беременности (группа 2). У них кровотечений из половых путей и признаков отслойки хориона/плаценты не наблюдалось, беременность протекала без осложнений и закончилась рождением здоровых детей.
На фоне приема фолиевой кислоты у девяти беременных (группа 3), в том числе высоких доз – до 5 мг/сут, несмотря на проведение комплексной терапии микронизированным прогестероном по 400–600 мг/сут вагинально и транексамовой кислотой по 3–4 г/сут внутрь или 1–1,5 г/сут внутривенно, кровотечения в большинстве случаев были более обильными. Так, в трех случаях кровопотеря составила 300–500 мл/сут, в четырех – кровяные выделения были умеренными (до двух – трех прокладок средней впитываемости в сутки) и в двух отмечались мажущие кровяные выделения. Трех беременных с обильными и двух с умеренными кровяными выделениями перевели на прием Фемибиона вместо фолиевой кислоты, что во всех случаях позволило постепенно купировать кровотечение. В дальнейшем у двух из них произошли самопроизвольные выкидыши в 17 и 19 недель. У шести женщин беременность закончилась своевременными родами, осложнений в послеродовом периоде не отмечалось. В одном случае было произведено экстренное родоразрешение путем операции кесарева сечения в связи с развитием преэклампсии.
У абсолютного большинства беременных с полиморфизмом гена МТГФР были нарушены гематологические показатели: у 86,4% (n = 19) была обнаружена тромбоцитопения и у 72,7% (n = 16) – анемия. Снижение показателей во всех случаях было умеренным: уровень гемоглобина крови находился в пределах 88–112 г/л, количество тромбоцитов – в пределах 117–180×10⁹/л. При этом уменьшение количества эритроцитов в сыворотке крови встречалось также редко (n = 3), как и вне беременности. Следует отметить, что в половине случаев беременность наступила на фоне уже сниженных лабораторных показателей, а в половине анемия и тромбоцитопения присоединились достаточно рано – в конце первого или начале второго триместра беременности. Только у трех женщин, начавших принимать Фемибион за шесть – восемь недель до наступления беременности и продолживших его прием до родов, гематологические показатели находились в пределах нормы и сохранялись без изменений на протяжении всего периода гестации.
При дотации фолиевой кислоты (группа 3), в том числе в больших дозах – до 5 мг/сут, только у двух беременных наблюдалась стабилизация показателей крови, тогда как у остальных анемия и тромбоцитопения прогрессировали, и к концу беременности уровень гемоглобина и тромбоцитов снизился на 15–30% ниже от исходных показателей.
Назначение Фемибиона на протяжении беременности, наоборот, положительно влияло на гематологический статус (группа 1). Так, у восьми беременных уровень гемоглобина и тромбоцитов достиг нормативных значений (в том числе в случаях обильных кровотечений) и только у двух остался без изменений. Нормализация показателей крови происходила в течение двух – четырех недель после назначения препарата, содержащего активную форму фолиевой кислоты.
У четырех беременных была диагностирована гипергомоцистеинемия (уровень сывороточного гомоцистеина составил 11–14,2 ммоль/л), которую также удалось нормализовать в течение месяца применения Фемибиона.
Выводы
Проведенное исследование подтвердило роль дефицита фолатов в развитии акушерских осложнений: бесплодия, невынашивания беременности, преэклампсии, пороков развития у плода. Была установлена связь нарушений в метаболизме фолатного цикла с высокой частотой аномальных гинекологических и акушерских кровотечений: у каждой второй женщины с полиморфизмом гена МТГФР имелись обильные и/или длительные менструации, у каждой пятой – кровотечение в родах или после аборта и у 86% – кровотечение во время настоящей беременности. При этом у большинства обследованных женщин были изменены гематологические показатели в виде тромбоцитопении, анемии и/или гипергомоцистеинемии. Наиболее характерными, встречающимися у более половины (54%) женщин с полиморфизмом гена МТГФР и у 86,4% беременных с полиморфизмом МТГФР были повреждения тромбоцитарного звена гемопоэза – тромбоцитопатия, которая обнаруживалась снижением количества и увеличением объема тромбоцитов, а также признаками их функциональной недостаточности. У каждой третьей (37%) женщины с полиморфизмом генов ферментов фолатного цикла и у 73,7% беременных с нарушением метаболизма фолиевой кислоты выявлялась анемия.
Назначение беременным с полиморфизмом гена МТГФР препарата, содержащего активную форму фолатов – метафолин, позволило качественно и количественно нормализовать гематологические показатели, а также значительно снизить риск осложнений беременности. В то же время полученных нами данных недостаточно для формулирования окончательных выводов, поэтому требуется проведение дальнейших научных исследований в данном направлении.
1. Pietrzik K., Bailey L., Shane B. Folic acid and L-5-methyltetrahydrofolate: comparison of clinical pharmacokinetics and pharmacodynamics // Clin. Pharmacokinet. 2010. Vol. 49. № 8. P. 535–548.
2. Lucock M. Folic acid: nutritional biochemistry, molecular biology, and role in disease processes // Mol. Genet. Metab. 2000. Vol. 71. № 1–2. P. 121–138.
3. Cunningham F., Leveno K., Bloom S. et al. Williams Obstetrics. 23rd ed. New York: McGraw-Hill, 2009.
4. Crider K.S., Yang T.P., Berry R.J. et al. Folate and DNA methylation: a review of molecular mechanisms and the evidence for folate’s role // Adv. Nutr. 2012. Vol. 3. № 1. P. 21–38.
5. Müller T., Jugel C., Muhlack S. et al. Methyl group-donating vitamins elevate 3-O-methyldopa in patients with Parkinson disease // Clin. Neuropharmacol. 2013. Vol. 36. № 2. P. 52–54.
6. Smith A.D., Kim Y.I., Refsum H. Is folic acid food for everyone? // Am. J. Clin. Nutr. 2008. Vol. 87. № 3. P. 517–533.
7. Kidd P.M. Alzheimer’s disease, amnestic mild cognitive impairment, and age-associated memory impairment: current understanding and progress toward integrative prevention // Altern. Med. Rev. 2008. Vol. 13. № 2. P. 85–115.
8. Vogel S., Meyer K., Fredriksen A. et al. Serum folate and vitamin B12 concentrations in relation to prostate cancer risk: a Norwegian population-based nested case-control study of 3000 cases and 3000 controls within the JANUS cohort // Int. J. Epidemiol. 2013. Vol. 42. № 1. P. 201–210.
9. Duthie S.J. Folat and cancer: how DNA damage, repair and methylation impact on colon carcinogenesis // J. Inherit. Metab. Dis. 2011. Vol. 34. № 1. P. 101–109.
10. Yang I.V., Schwartz D.A. Epigenetic mechanisms and the development of asthma // J. Allergy Clin. Immunol. 2012. Vol. 130. № 6. P. 1243–1255.
11. Prevention of neural tube defects: results of the Medical Research Council Vitamin Study // Lancet. 1991. Vol. 338. № 8760. P. 131–137.
12. Ptikin R.M. Folate and neural tube defects // Am. J. Clin. Nutr. 2007. Vol. 85. № 1. P. 285–288.
13. De Wals P., Tairou F., Van Allen M.I. et al. Reduction in neural-tube defects after folic acid fortification in Canada // N. Engl. J. Med. 2007. Vol. 357. № 2. P. 135–142.
14. Beaudin A.E., Stover P.J. Folate-mediated one-carbon metabolism and neural tube defects: balancing genome synthesis and gene expression // Birth Defects Res. C. Embryo Today. 2007. Vol. 81. № 3. P. 183–203.
15. Greenberg J.A., Bell S.J., Guan Y. et al. Folic acid supplementaion and pregnancy: more than just neural tube defect prevention // Rev. Obstet. Gynecol. 2011. Vol. 4. № 2. P. 52–59.
16. Lumley J., Watson L., Watson M. et al. WITHDRAWN: periconceptional supplementation with folate and/or multivitamins for preventing neural tube defects // Cochrane Database Syst. Rev. 2011. Vol. 4. ID CD001056.
17. Blencowe H., Cousens S., Modell B. et al. Folic acid to reduce neonatal mortality from neural tube disorders // Int. J. Epidemiol. 2010. Vol. 39. Suppl. 1. P. 110–121.
18. Bentley S., Hermes A., Phillips D. et al. Comparative effectiveness of a prenatal medical food to prenatal vitamins on hemoglobin levels and adverse outcomes: a retrospective analysis // Clin. Ther. 2011. Vol. 33. № 2. P. 204–210.
19. Van Beynum I.M., Kapusta L., Bakker M.K. et al. Protective effect of periconceptional folic acid supplements on the risk of congenital heart defects: a registry-based case-control study in the northern Netherlands // Eur. Heart J. 2010. Vol. 31. № 4. P. 464–471.
20. Czeizel A.E., Puho E.H., Langmar Z. et al. Possible association of folic acid supplementation during pregnancy with reduction of preterm birth: a population-based study // Eur. J. Obstet. Gynecol. Reprod. Biol. 2010. Vol. 148. № 2. P. 135–140.
21. Daly L.E., Kirke P.N., Molloy A. et al. Folate levels and neural tube defects: implications for prevention // JAMA. 1995. Vol. 274. № 21. P. 1698–1702.
22. Fekete K., Berti C., Trovato M. et al. Effect of folate intake on health outcomes in pregnancy: a systematic review and meta-analysis on birth weight, placental weight and length of gestation // Nutr. J. 2012. Vol. 11. P. 75–86.
23. Williams P.J., Bulmer J.N., Innes B.A. et al. Possible roles for folic acid in the regulation of trophoblast invasion and placental development in normal early human pregnancy // Biol. Reprod. 2011. Vol. 84. № 6. P. 1148–1153.
24. Salerno P., Bianchi F., Pierini A. et al. Folic acid and congenital malformation: scientific evidence and public health strategies // Ann. Ig. 2008. Vol. 20. № 6. P. 519–530.
25. Kim M.W., Hong S.C., Choi J.S. et al. Homocysteine, folate and pregnancy outcomes // J. Obstet. Gynaecol. 2012. Vol. 32. № 6. P. 520–524.
26. Bodnar L.M., Himes K.P., Venkataramanan R. et al. Maternal serum folate species in earlypregnancy and risk of preterm birth // Am. J. Clin. Nutr. 2010. Vol. 92. № 4. P. 864–871.
27. Bailey L.B., Berry R. Folic acid supplementation and the occurrence of congenital heart defects, orofacial clefts, multiple births, and miscarriage // Am. J. Clin. Nutr. 2005. Vol. 81. № 5. P. 1213–1217.
28. Puri M., Kaur L., Walia G.K. et al. MTHFR C677T polymorphism, folate, vitamin B12 and homocysteine in recurrent pregnancy losses: a case control study among North Indian women // J. Perinat. Med. 2013. Vol. 41. № 5. P. 549–554.
29. Micle O., Muresan M., Antal L. et al. The influence of homocysteine and oxidative stress on pregnancy outcome // J. Med. Life. 2012. Vol. 5. № 1. P. 68–73.
30. Takimoto H., Mito N., Umegaki K. et al. Relationship between dietary folate intakes, maternal plasma total homocysteine and B-vitamins during pregnancy and fetal growth in Japan // Eur. J. Nutr. 2007. Vol. 46. № 5. P. 300–306.
31. Szegedi S.S., Castro C.C., Koutmos M. et al. Betaine-homocysteine S-methyltransferase-2 is an S-methylmethionine-homocysteine methyltransferase // J. Biol. Chem. 2008. Vol. 283. № 14. P. 8939–8945.
32. Vollset S.E., Refsum H., Tverdal A. et al. Plasma total homocysteine and cardiovascular and noncardiovascular mortality: the Hordaland Homocysteine Study // Am. J. Clin. Nutr. 2001. Vol. 74. № 1. P. 130–136.
33. Vollset S.E., Refsum H., Irgens L.M. et al. Plasma total homocysteine, pregnancy complications, and adverse pregnancy outcomes: the Hordaland Homocysteine study // Am. J. Clin. Nutr. 2000. Vol. 71. № 4. P. 962–968.
34. Xiao Y., Zhang Y., Wang M. et al. Plasma S-adenosylhomocysteine is associated with the risk of cardiovascular events in patients undergoing coronary angiography: a cohort study // Am. J. Clin. Nutr. 2013. Vol. 98. № 5. P. 1162–1169.
35. Naess I.A., Christiansen S.C., Romundstad P.R. et al. Prospective study of homocysteine and MTHFR 677TT genotype and risk for venous thrombosis in a general population: results from the HUNT 2 study // Br. J. Haematol. 2008. Vol. 141. № 4. P. 529–535.
36. Potter K. Homocysteine and cardiovascular disease: should we treat? // Clin. Biochem. Rev. 2008. Vol. 29. № 1. P. 27–30.
37. Wong Y., Almenda O.P., McCaul K.A. et al. Homocysteine, frailty, and all-cause mortality in older men: the health in men study // J. Gerontol. A. Biol. Sci. Med. Sci. 2013. Vol. 68. № 5. P. 590–598.
38. Virtanen J.K., Voutilainen S., Alfthan G. Homocysteine as a risk factor for CVD mortality in men with other CVD risk factors: the Kuopio Ischaemic Heart Disease Risk Factors (KIHD) Study // J. Intern. Med. 2005. Vol. 257. № 3. P. 255–262.
39. Hogeveen M., Blom H.J., den Heijer M. Maternal homocysteine and small-for-gestational-age offspring: systematic review and meta-analysis // Am. J. Clin. Nutr. 2012. Vol. 95. № 1. P. 130–136.
40. Timmermans S., Jaddoe V.W., Hofman A. et al. Periconception folic acid supplementation, fetal growth and the risks of low birth weight and preterm birth: the Generation R Study // Br. J. Nutr. 2009. Vol. 102. № 5. P. 777–785.
41. Bukowski R., Malone F.D., Porter F.T. et al. Preconceptional folate supplementation and the risk of spontaneous preterm birth: a cohort study // PLoS Med. 2009. Vol. 6. № 5. ID 1000061.
42. Prinz-Langenohl R., Brämswig S., Tobolski O. et al. (6S)-5-methyltetrahydrofolate increases plasma folate more effectively than folic acid in women with the homozygous or wild-type 677C>T polymorphism of methylenetetrahydrofolate reductase // Br. J. Pharmacol. 2009. Vol. 158. № 8. P. 2014–2021.
43. Trabetti E. Homocysteine, MTHFR gene polymorphisms, and cardio-cerebrovascular risk // J. Appl. Genet. 2008. Vol. 49. № 3. P. 267–282.
44. Morris M.S., Jacques P.F., Rosenberg I.H. et al. Circulating unmetabolized folic acid and 5-methyltetrahydrofolate in relation to anemia, macrocytosis, and cognitive test performance in American seniors // Am. J. Clin. Nutr. 2010. Vol. 91. № 6. P. 1733–1744.
45. Holm P.I., Hustad S., Ueland P.M. et al. Modulation of the homocysteine-betaine relationship by methylenetetrahydrofolate reductase 677 C->t genotypes and B-vitamin status in a large-scale epidemiological study // J. Clin. Endocrinol. Metab. 2007. Vol. 92. № 4. P. 1535–1541.
46. Громова О.А., Торшин И.Ю. Применение фолиевой кислоты в акушерско-гинекологической практике: методические рекомендации. М., 2010.
47. Kim Y.I. Folate and colorectal cancer: an evidence-based critical review // Mol. Nutr. Food Res. 2007. Vol. 51. № 3. P. 267–292.
48. Stolzenberg-Solomon R.Z., Chang S.C., Leitzmann M.F. et al. Folate intake, alcohol use, and postmenopausal breast cancer risk in the prostate, lung, colorectal, and ovarian cancer screening trial // Am. J. Clin. Nutr. 2006. Vol. 83. № 4. P. 895–904.
49. Sauer J., Mason J.B., Choi S.W. Too much folate: a risk factor for cancer and cardiovascular disease? // Curr. Opin. Clin. Nutr. Metab. Care. 2009. Vol. 12. № 1. P. 30–36.
50. Van Guelpen B. Folate in colorectal cancer, prostate cancer and cardiovascular disease // Scand. J. Clin. Lab. Invest. 2007. Vol. 67. № 5. P. 459–473.
51. Пустотина О.А., Орджоникидзе Н.В., Бутов Ю.С. Редкий случай токсикодермии у беременной // Акушерство и гинекология. 2002. № 3. С. 53–54.
52. Charles D., Ness A.R., Campbell D. et al. Taking folate in pregnancy and risk of maternal breast cancer // BMJ. 2004. Vol. 329. № 7479. P. 1375–1376.
53. Приказ Министерства здравоохранения РФ от 12 ноября 2012 г. № 572н «Об утверждении Порядка оказания медицинской помощи по профилю „акушерство и гинекология» (за исключением использования вспомогательных репродуктивных технологий“» // www.rosminzdrav.ru/documents/5828-prikaz-minzdrava-rossii-ot-12-noyabrya-2012g-572n.
54. Lamers Y., Prinz-Langenohl R., Brämswig S. et al. Red blood cell folate concentrations increase more after supplementation with [6S]-5-methyltetrahydrofolate than with folic acid in women of childbearing age // Am. J. Clin. Nutr. 2006. Vol. 84. № 1. P. 156–161.
55. Heit J.А., Kobbervig C.E., James A.H. et al. Trends in the incidence of venous thromboembolism during pregnancy or postpartum: a 30-year population-based study // Ann. Intern. Med. 2005. Vol. 143. № 10. P. 697–706.
56. Шехтман М.М. Руководство по экстрагенитальной патологии у беременных. 5-е изд. М.: Триада-Х, 2011.
A role of folates in developing complications of pregnancy
O.A. Pustotina, A.E. Akhmedova
KM-clinic, Moscow
Contact person: Olga Anatolyevna Pustotina, pustotina@gmail.com
Here, in vivo biological functions of folates are discussed, with describing metabolism of folic acid. A role of folic acid in pregnancy as well as negative sequelae caused by its deficiency or overabundance during gestation period is analyzed. Results obtained after observation for pregnant women administered with metafolin as a vitamin-mineral complex containing active form of folates having polymorphism in the methylenetetrahydrofolate reductase gene are provided. This medicinal complex let to qualitatively and quantitatively normalize hematological parameters as well as markedly reduce a risk of complications under pregnancy.
Новости на тему
15.08.2022 01:00:00
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.