Роль орексинергической системы мозга в регуляции бодрствования и сна
- Аннотация
- Статья
- Ссылки
- English
В начале XX в., несмотря на блестящие работы М.М. Манасеиной [1], мнение о сне как о важном процессе, заслуживающем изучения ничуть не меньшего, чем бодрствование, все еще не было признанным. Однако события Первой мировой войны привлекли внимание к проблеме сна, и его пассивная природа была поставлена под сомнение. В конце этой войны мир поразила невиданная эпидемия таинственной болезни, с которой человечество не сталкивалось ни до, ни, к счастью, после того.
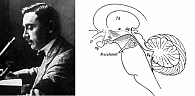
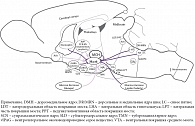
В 1917 г. в одной из венских психиатрических клиник, переполненной ранеными военнослужащими, работал врач – специалист по ранениям и травмам головы Костантин фон Экономо (Konstantin von Economo). Это был выдающийся невролог и нейроанатом, греческий аристократ по происхождению, родившийся в Румынии, но проживший большую часть жизни в Вене (рис. 1) [1].
В клинику поступило несколько гражданских лиц с различными неврологическими нарушениями, на которых персонал не обратил никакого внимания. Однако К. фон Экономо заметил у семи из них общую черту в симптоматике – неудержимую сонливость и заключил, что, несмотря на различия в симптомах, все они страдают от одного и того же ранее не известного заболевания, которое он назвал encephalitis letargica. Эта «сонная болезнь» развивалась в результате проникновения в мозг некоего вируса, природа которого осталась неизвестной.
В дальнейшем К. фон Экономо описал еще 13 таких случаев. Болезнь возникала как эпидемическая, порой в ограниченных коллективах. Для нее были характерны высокая температура, нарушение сознания, зрительные расстройства, конвульсии и другие неврологические симптомы. Бóльшая часть больных, исследованных К. фон Экономо, страдала от непреодолимой сонливости, меньшая – от бессонницы, невозможности уснуть.
Тщательное изучив патологоанатомический материал, К. фон Экономо пришел к выводу, что «центр бодрствования», разрушение которого вирусом вызывало «сонную болезнь», расположен где-то на уровне соединения ствола и межуточного мозга, а «центр сна», поражение которого вызывало инсомнию, – в переднем гипоталамусе. В дальнейшем он описал и промежуточную область в дорсолатеральном гипоталамусе, разрушение которой, по его мнению, вызывало симптомы нарколепсии/катаплексии (рис. 1).
Выводы К. фон Экономо были встречены с недоверием, но через 80 лет, в самом конце ХХ в., все три его открытия были блестяще подтверждены. Теперь мы знаем, что через ростральную часть ствола проходят оба потока активирующих кору импульсов. В переднем гипоталамусе локализуется ГАМКергический «центр медленного сна», а в срединной его части расположены орексинергические нейроны, ответственные за «правильное» включение «центра быстрого сна» [1].
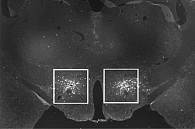
В 1998 г. группа авторов из США опубликовала статью о том, что им удалось обнаружить в гипоталамусе крыс матричную РНК, кодирующую белок, в состав которого входили ранее не известные аминокислотные последовательности двух сходных пептидов. Эти пептиды сначала были приняты за представителей кишечных гормонов секретинов и поэтому получили название «гипокретины» («гипо» – от hypothalamus, «кретин» – от secretin), в дальнейшем это сходство было опровергнуто. Одновременно группа японских ученых, работавшая в Техасском университете в США и занимавшаяся поиском лигандов к «сиротским» рецепторам, то есть «подбором ключей к найденным замкам», обнаружила в гипоталамусе два близких по строению пептида, названных ими орексином А и B (от греч. orexis – аппетит) (рис. 2) [1–5].
Вскоре стало ясно, что гипокретины 1 и 2 и орексины А и B – одни и те же субстанции, олигопептиды: орексин А содержит 33 аминокислотных остатка, а B – 28. Орексин А имеет свернутую (петлеобразную) конформацию, удерживаемую дисульфидными мостиками. У орексина B – линейная структура. Молекула орексина А довольно стабильна, тогда как орексин В при введении извне быстро распадается [1, 2, 4–6].
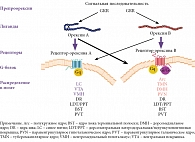
Орексины А и В являются результатом расщепления белка-предшественника, препроорексина (прерогипокретина), из которого выщепляется более короткий полипептид проорексин (рис. 3) [6]. Были обнаружены рецепторы к орексинам/гипокретинам и гены, кодирующие эти рецепторы. Оказалось, что действие орексинов опосредуется двумя метаботропными рецепторами, связанными с G-белком. При этом рецептор первого типа (OX1R) избирательно связывается только с орексином А, а рецептор второго типа (OX2R) неселективен и связывается с обоими орексинами. Рецептор орексина А связан исключительно с подклассом Gq гетеротримерных G-белков, рецептор орексина B – с подклассом Gi/Go и/или Gq [1, 6].
Сразу было высказано предположение, что эти пептиды играют важную роль в регуляции пищевого поведения. Тела нейронов, концевые пластинки аксонов которых выделяют орексин/гипокретин, локализуются в глубине головного мозга, у самого его основания, в дорсолатеральной и дорсомедиальной области гипоталамуса, вблизи так называемого пищевого центра, где находятся клетки, участвующие в регуляции голода и насыщения.
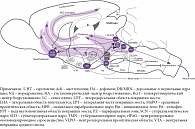
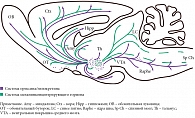
Подобно аминергическим нейронам, орексинергические клетки весьма немногочисленны (в полутораграммовом мозге крысы их всего 3200, а в 1000 раз большем по весу мозге человека – не более 80 тыс.). Однако их аксоны сильно ветвятся, иннервируя множество клеток в коре и активирующих системах мозга, выделяющих все основные медиаторы: ацетилхолин, глутамат, ГАМК, мозговые амины (рис. 4) [1, 5, 7–10]. Интересно, что клетки «центра сна» вентролатеральной преоптической области не содержат орексиновых рецепторов, что, по-видимому, повышает надежность гипоталамического триггера [1, 4].
В большинстве нейронов орексин локализуется вместе с другим пептидом – динорфином. Многие орексиновые нейроны содержат также глутамат. Во всех орексиновых клетках гипоталамуса присутствует особый секретируемый нейрональный белок пентраксин, регулирующий нейронную активность. Этот белок связан с регуляцией синапсов и образуется одним из «немедленных ранних генов» – представителем группы генов, которые быстро экспрессируются (активируются) в нейронах при повышении метаболической активности последних. Орексинергические нейроны проецируются, в частности, и на норадренергические клетки синего пятна, вызывая их деполяризацию – активацию, «подбуживание». Недостаточная активация приводит к тому, что нейроны синего пятна приобретают «неприятную» способность внезапно «замолкать» не только во время быстрого сна, как им «положено», но и во время бодрствования, способствуя возникновению приступов нарколепсии/катаплексии [1, 5].
Орексинергическая система получает мощные активирующие афференты со стороны глутаматергической системы: precoeruleus/parabrachialis (PC/PB) и дорсомедиального ядра – высшего гипоталамического командного центра. Активирующие холинергические импульсы поступают на орексинергические нейроны со стороны рострально расположенных ядер базальной области переднего мозга (безымянная субстанция и др.). Кроме того, ряд модулирующих пептидов: аргинин, вазопрессин, холецистокинин 8, нейротензин, окситоцин – также стимулируют орексинергическую передачу. Активируют ее и возникновение голода (снижение уровня глюкозы) и появление грелина в крови (рис. 5) [4, 9].
На орексинергическую систему оказывается и тормозное влияние. Оно несколько слабее, но присутствует со стороны серотонинергической системы ядер шва (по-видимому, прямое), норадренергической системы синего пятна (по-видимому, опосредуемое ГАМКергическими нейронами), ноцицептивных элементов миндалины и, что особенно важно, ГАМК/галанинергического «центра сна» в преоптической области. Снижают активность орексинергических нейронов повышение уровня глюкозы и появление лептина в крови (см. рис. 5) [4, 11].
Однако сильнее всего подавляет орексинергическую систему так называемая меланинергическая система. Орексиновые нейроны гипоталамуса тесно переплетаются и взаимодействуют с морфологически очень схожими клетками, содержащими другой нейропептид, называемый меланинконцентрирующим гормоном – МКГ. Это вещество, первоначально выделенное из гипофиза лосося, было затем обнаружено в гипоталамусе лабораторных крыс. Разумеется, присутствует оно и в головном мозге человека. Описан белок-предшественник МКГ и кодирующий его ген. МКГ представляет собой 19-членный циклический пептид, близкий по строению к семейству соматостатина. В мозге крысы имеется около 12 тыс. нейронов, содержащих МКГ, расположенных главным образом в латеральном гипоталамусе и zona incerta. В меньшем количестве этот пептид присутствует в ретикулярной формации моста и каудальной части латеродорсальной покрышки. В головном мозге млекопитающих нейроны, содержащие орексин и МКГ, образуют взаимоперекрывающиеся проекции:
- в кору больших полушарий;
- гиппокамп;
- миндалину;
- nucleus accumbens перегородки;
- гипоталамус, включая гистаминергические нейроны его задней части;
- таламус;
- холинергические клетки базальной области переднего мозга;
- дофаминергические клетки вентральной области покрышки;
- норадренергические нейроны синего пятна;
- серотонинергические клетки ядер шва (рис. 6) [7].
Как видно из рисунка 6, обе системы проецируются на главные «центры бодрствования» головного мозга, в том числе на норадренергические клетки синего пятна, гистаминергические нейроны заднего гипоталамуса, холинергические клетки базальной области переднего мозга, выделяющие серотонин клетки ядер шва и дофаминергические нейроны вентральной покрышки [12, 13].
Большинство МКГ-нейронов содержат также семейства пептидов, транскрипта, регулируемого кокаином и амфетамином, и некоторые – ГАМК.
Обнаружен рецептор МКГ, распределение которого в мозге соответствует распределению обоих рецепторов орексина. Система МКГ является тормозной, реципрокной по отношению к нейронам орексина: МКГ-нейроны «молчат» в бодрствовании, слабо разряжаются в медленном сне, но весьма активны в быстром. Внутрижелудочковое введение МКГ крысам в дозах 0,2, 1 и 5 мкг вызывает дозозависимое увеличение периодов быстрого сна без изменения средней длительности каждого периода, а также небольшое увеличение представленности медленного сна. Эти эффекты реализуются посредством комбинированного воздействия МКГ и ГАМК, по-видимому, через торможение орексинергических, аминергических и ГАМКергических нейронов, которые сами тормозят быстрый сон (так называемые REM-off). У больных нарколепсией система МКГ остается нетронутой. В настоящее время разрушение содержащих МКГ нейронов рассматривается в качестве одной из возможных причин развития болезни Паркинсона. Считается, что система МКГ ответственна, в частности, за торможение механизмов пробуждения и регуляцию быстрого сна [12–14].
Орексинергическая система, наоборот, является одной из важнейших в регуляции бодрствования. До недавнего времени ее считали своеобразным «дирижером стройного оркестра» систем поддержания бодрствования головного мозга, первой скрипкой в котором является расположенная рядом и частично перекрывающаяся гистаминергическая система [1, 2, 15, 16]. Однако полученные за последние пять лет экспериментальные данные свидетельствуют в пользу предположения о том, что главную роль в системе регуляции цикла «сон – бодрствование» играет все же глутаматергическая arousal-система PC/PB, проецирующаяся непосредственно в базальной области, и реципрокная ей ГАМКергическая система парафациальной зоны [9, 10]. Именно поражение глутаматергической PC/PB системы ответственно за наиболее выраженные коматозные состояния как в экспериментальных, так и в клинических условиях. Тем не менее важность участия в процессах бодрствования орексинергической передачи не вызывает сомнений [13].
Орексиновые нейроны весьма активны в бодрствовании, особенно при ориентировочно-исследовательском поведении подопытных животных, очень слабо разряжаются в медленном и практически «молчат» в быстром сне. Введение орексина в желудочки мозга крыс дозозависимо удлиняет бодрствование и подавляет сон. Роль орексиновых нейронов в регуляции цикла «сон – бодрствование» заключается, видимо, в некоторой критически важной дополнительной активации пробуждающих систем головного мозга, их «подбуживании», «активации активаторов», которая придает надежность и устойчивость всей этой системе. Орексиновую нейронную сеть образно сравнивают с прижимающей пружиной (или давящим на кнопку пальцем), которой непременно снабжается всякий электрический переключатель – триггер, чтобы его контакты были всегда зафиксированы и кнопка произвольно не «болталась». Соответственно недостаточность орексиновой системы приводит к формированию нарколептического фенотипа со свойственными ему нарушениями строгой координации между механизмами бодрствования, медленного и быстрого сна, в то время как сами эти механизмы остаются неповрежденными [1, 7].
Вспоминая об исследовании К. фон Экономо, важно отметить появление новых случаев детской нарколепсии в Китае, Норвегии и некоторых других странах после пандемии вирусного гриппа H1N1 в 2009 г. Оказалось, что противогриппозная вакцина содержит фрагменты вируса, который запускает аутоиммунную реакцию, приводящую к апоптозу орексиновых нейронов [8].
Кроме проекций на кору и компоненты системы восходящей активации, орексиновые нейроны перифорникальной области латерального гипоталамуса посылают свои проекции и к «центру сна» вентролатеральной преоптической области. Однако, как уже отмечалось выше, «центр сна» не содержит орексиновых рецепторов. Следовательно, орексиновые нейроны латерального гипоталамуса активно участвуют в поддержании бодрствования, но не имеют реципрокных связей с ГАМКергическими нейронами вентролатеральной преоптической области и соответственно являются «внешними» по отношению к триггерному механизму сна – бодрствования. Именно такое положение орексиновой системы позволяет ей выполнять функцию стабилизатора поведенческих состояний, минимизируя переходы от бодрствования ко сну и обратно. В то время как у людей и животных с признаками нарколепсии число таких переходов резко увеличено. Несмотря на то что орексиновый «центр бодрствования» не управляет «центром сна» вентролатеральной преоптической области, последний проецируется на латеральный гипоталамус и тормозит орексиновые нейроны, не давая им разряжаться во сне [1, 7, 13].
Орексиновые нейроны играют важнейшую роль в координации активности аминергических систем головного мозга, интегрируя поступающие циркадианно-оптические импульсы, с одной стороны, и нутриционно-метаболические – с другой. Максимальная частота разрядов орексиновых так же, как и аминергических, нейронов наблюдается в состоянии активного бодрствования, а минимальная (нулевая) – в быстром сне. Исключительно важны взаимосвязи между орексин/гипокретинергической и гистаминергической системами мозга, расположенными в туберомамиллярных ядрах заднего гипоталамуса. Наиболее мощные активирующие проекции на туберомамиллярные ядра исходят именно от содержащих орексин/гипокретин нейронов. Активация гистаминовых нейронов – одна из важнейших функций орексинергической системы. Это впервые было показано уже вскоре после открытия орексин/гипокретинергической системы, когда в опытах с непосредственным введением орексина в желудочки мозга крыс последующее повышение поведенческой активности исчезало, если блокировалась гистаминергическая передача. Кроме того, было установлено, что содержание гистамина в мозге мутантных собак-«нарколептиков» и ликворе больных нарколепсией отличается от нормы [17, 18].
Оба медиатора – орексин и гистамин действуют синергично, играя уникальную роль в поддержании бодрствования. Орексин/гипокретинергические нейроны располагаются в заднелатеральном гипоталамусе и перифорникальной области, в непосредственной близости от гистаминергических нейронов туберомамиллярных ядер. Оба ядра частично перекрываются и образуют функциональное единство. Оба орексина/гипокретина непосредственно возбуждают гистаминовые нейроны через рецепторы второго типа и активацию натрий-кальциевого ионного обмена. Орексин часто солокализуется с динорфином, который также может участвовать в возбуждении гистаминергических нейронов путем подавления ГАМКергического тормозного пути. Однако гистаминовые нейроны, по-видимому, не влияют непосредственно на возбудимость орексиновых нейронов, так что прямое взаимодействие этих двух систем носит односторонний характер. Подобно гистаминовым, орексиновые нейроны могут вовлекаться в реакцию пробуждения, вызываемую гиперкапнией: они активируются при кратковременной гипоксии и умеренном ацидозе [17, 18].
До недавнего времени считалось, что гистаминергическая система является нисходящей по отношению к орексинергической, которая ею управляет, используя мощные древовидные ветвления своих аксонов, проецирующихся на нейроны туберомамиллярных ядер. Однако недавние опыты показали, что фенотип гомозиготных мышей, нокаутных по гену гистидиндекарбоксилазы, ключевого фермента синтеза гистамина, лишь частично сходен с таковым у гомозиготных орексиннокаутных животных. Обе мутантные линии демонстрируют избыточную фрагментацию сна и увеличение представленности быстрого сна. Отличия заключаются в следующем:
у мышей, лишенных гистамина, повышенный процент быстрого сна наблюдается в светлый, менее активный период суток, а у мышей без орексина – в темный, более активный;
в отличие от мышей, лишенных гистамина, у животных, лишенных орексина, отсутствуют снижение бодрствования в «сумеречный» период (непосредственно предшествующий и следующий сразу за выключением света), нарушения на электроэнцефалограмме, они нормально реагируют увеличением бодрствования на помещение в новую обстановку;
у животных, лишенных орексина, в отличие от лишенных гистамина, имеют место нарколептоподобные приступы, а при помещении на вращающееся колесо у них отсутствует двигательная активность [17, 18].
Орексинергическая система, тесно связанная с гистаминовой, в большей степени ответственна за поведенческие проявления пробуждения и бодрствования, такие как мышечный тонус, постуральные и локомоторные функции, потребление пищи и эмоциональное реагирование. Орексиновая недостаточность у человека ведет к возникновению нарколептических приступов [17, 18].
Скопления орексиновых нейронов перекрываются с меланинергической, гистаминергической и другими нейронными системами, поэтому только новейшие генно-инженерные методы позволяют проводить с ними избирательные манипуляции. Оказалось, что оптогенетическая активация орексиновых нейронов вызывает реакцию arousal, а их торможение методом DREDD (Designer Receptors Exclusively Activated by Designer Drugs) – сон. Это подтверждает ранее полученные традиционными методами данные об участии орексинергической системы в регуляции бодрствования. И вся совокупность данных за 18 лет, прошедших с момента открытия орексина: клинических (нарколепсия), нейроанатомических, электрофизиологических, фармакологических, нейрогенетических (мыши, нокаутные по гену препроорексина или по генам его рецепторов), DREDD/оптогенетических – не оставляет сомнений в справедливости гипотезы о роли орексиновых нейронов в регуляции бодрствования (восходящая активация) и мышечного тонуса (нисходящая активация) в качестве «активатора активаторов» [8, 19].
Если агонисты рецепторов орексина вызывают пробуждение и бодрствование, то антагонисты, как и следует ожидать, – сон. Однако относительная роль каждого из рецепторов остается неясной. Так, мыши, нокаутные по рецептору орексина 1, не демонстрируют нарколептико-катаплектического фенотипа. Вместе с тем у мышей, нокаутных по обоим рецепторам орексина, симптомы нарколепсии/катаплексии более выражены, чем у мышей, нокаутных по гену рецептора орексина 2. Поскольку приступы нарколепсии/катаплексии провоцируются эмоциональным возбуждением, очевидно участие в этих процессах также и нейронных систем миндалины. И действительно, эксперименты с орексиннокаутными мышами показали, что эксайтотоксическое разрушение миндалины у них снижает частоту и выраженность катаплектических припадков [8].
Интересно, что орексиновая система – это эволюционно древняя система активации. Она присутствует в головном мозге холоднокровных позвоночных, у которых никаких признаков быстрого сна, как известно, не наблюдается. Однако и у рыбки-зебры, нокаутной по гену препроорексина, отмечается «нарколептический» фенотип. Он проявляется в виде учащенных переходов из состояния активности в состояние покоя и обратно, а это является одним из симптомов этого заболевания и у человека. Соответственно гиперэкспрессия гена препроорексина у рыбки-зебры вызывает удлинение и учащение периодов активности и подавляет состояние покоя. У человека, как теперь хорошо известно, пониженный уровень орексина 1 в ликворе коррелирует с выраженностью нарколептической симптоматики и признан важнейшим диагностическим критерием [8].
Несмотря на то что орексин не проникает через гематоэнцефалический барьер, интраназальное введение орексина 1 весьма эффективно для лечения нарколепсии с катаплексией. Суворексант – мощный селективный антагонист обоих рецепторов орексина – разрешен к применению в США как эффективное, безопасное и хорошо переносимое снотворное. В отличие от большинства традиционных снотворных, действие которых основано на активации тем или иным способом ГАМКергической системы, во сне, возникающем под действием суворексанта, значительную долю занимает быстрая фаза. Сейчас ряд исследовательских лабораторий проводит эксперименты с селективными антагонистами рецептора орексина 2. Предполагается, что такие вещества продемонстрируют не меньшую эффективность в борьбе с инсомнией, чем антагонисты обоих рецепторов. При этом они будут вызывать структурно более «естественный» сон и, таким образом, окажутся предпочтительными в лечении первичной инсомнии и коморбидных расстройств. При панических расстройствах отмечен повышенный уровень обоих орексинов, а антагонисты их рецепторов эффективно устраняют резкие скачки артериального давления на крысиной модели панических атак. Таким образом, кроме лечения инсомнии орексиновые антагонисты могут быть также использованы для борьбы с такими эмоциональными расстройствами, как посттравматический стресс, тревожность и панические атаки [8]. В целом, избыточная активность орексин/гипокретинергической системы связана с бессонницей и панической тревожностью, а недостаточная – с нарколепсией, болезнями Альцгеймера и Паркинсона и ожирением [20].
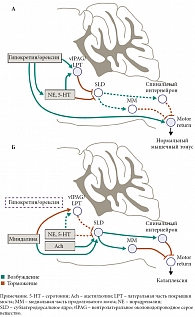
Как уже говорилось, нисходящие орексинергические проекции играют ключевую роль в возникновении катаплектических приступов при нарколепсии. Как видно из рисунка 7А, существуют несколько проводящих путей, которые при нормальном бодрствовании исключают возможность возникновения атонии [21]. Орексин/гипокретиновые нейроны активны во время бодрствования и помогают поддерживать нормальный мышечный тонус путем возбуждения ГАМКергических нейронов в области вентролатерального околоводопроводного серого вещества/латеральной части покрышки моста, норадренергических нейронов NA/LC, серотонинергических нейронов 5-HT/DR и мотонейронов. Кроме этого, они блокируют активность ГАМКергических нейронов субдорсолатерального ядра. На рисунке 7B показано, что происходит при нарколепсии, когда орексин/гипокретиновые нейроны разрушены. В этом случае сильные положительные эмоции вызывают усиление амигдалярного и холинергического притоков, которые возбуждают ГАМКергические нейроны субдорсолатерального ядра и тормозят ГАМКергические нейроны вентролатерального околоводопроводного серого вещества/латеральной части покрышки моста. Тогда субдорсолатеральное ядро возбуждает нейроны в медиальной части продолговатого мозга и спинном мозге, которые сильно гиперполяризуют мотонейроны, что и приводит к катаплексии. Иными словами, в норме мощная активность орексин/гипокретиновой системы, а также постоянный нисходящий моноаминергический приток импульсов на каудальную область моста, продолговатый мозг и непосредственно мотонейроны спинного мозга, поддерживаемый все той же орексинергической импульсацией, противодействуют возникновению атонии. Однако в отсутствие орексина/гипокретина этот активирующий поток импульсов исчезает, что приводит к возникновению приступов катаплексии [21].
Участие орексина в эмоциональных реакциях связано с его воздействием на дофаминовую систему. Специальные исследования показали, что при аппликации на дофаминергическую область вентральной покрышки орексин усиливает реакцию поощрения, блокируя выброс динорфина, с которым он солокализуется в одних и тех же везикулах. А на мышиной модели, нокаутной по генам обоих орексиновых рецепторов, каталептоподобные приступы устраняются при селективном восстановлении этих рецепторов на серотонинергических нейронах дорзальных ядер шва. Аналогичным образом избирательная активация этих нейронов хемогенетическим методом устраняет нарколептический фенотип, демонстрируемый мышами без орексиновых нейронов [22].
Норадренергическая область синего пятна (locus coeruleus – LC) получает наиболее насыщенные афференты из гипоталамуса. Манипулируя активацией и торможением нейронов этой области с помощью оптогенетических методов, можно управлять состоянием и уровнем бодрствования подопытной мыши in vivo. Это подтверждает, что стабилизация бодрствования является одной из важнейших функций орексиновой системы, а норадренергическая система синего пятна – ее главный эфферент. Показано, что одновременное торможение норадренергических нейронов синего пятна и активация орексиновых нейронов снижают количество переходов от сна к бодрствованию, которое возрастает при активации последних. Наоборот, повышение возбудимости нейронов синего пятна снижает латентность бодрствования, вызванного оптогенетической стимуляцией орексиновых нейронов. Эти опыты с оптогенетическим манипулированием нейронами Orx/LH и NA/LC подтверждают, что система Orx/LH→NA/LC критически важна в тонкой настройке регуляции переходов от сна к бодрствованию и обратно. Недавно было показано, что длительная оптогенетическая активация орексиновых нейронов повышает активность оси «гипоталамус – гипофиз – кора надпочечников» и вызывает стрессорное поведение. Эти данные говорят о том, что орексиновые нейроны участвуют и в регуляции выброса кортикостерона, и их активность в ответ на стресс модулируется периферическими метаболическими сигналами. Стало ясно, что нейронные системы 5-HT/DR и NA/LC демонстрируют различные стороны нарколептического синдрома [22].
Можно заключить, что орексинергические нейроны интегрируют метаболические, эмоциональные и циркадианные сигналы для «подгонки» уровня бодрствования под текущие факторы внешней среды. Возможно, что именно орексин – это ключевой фактор реализации известного в экспериментальной психологии
закона Йеркса – Додсона. В соответствии с этим законом для успешного взаимодействия с окружающей средой животному (и человеку) необходим некий оптимальный уровень эмоционально-мотивационного возбуждения (бодрствования). Как снижение, так и чрезмерное повышение уровня бодрствования приводит к ухудшению поведенческих и когнитивных процессов [22].
V.M. Kovalzon
Severtsov Institute of Ecology and Evolution of the Russian Academy of Sciences, Moscow
Contact person: Vladimir Matveyevich Kovalzon, kovalzon@sevin.ru
Orexin/hypocretin system discovered in 1998–1999 is the main regulatory center of the brain. It is a key factor among a hierarchy of neuronal clusters which participate in neocortical and archepaleocortical activation as well as tonic depolarization of motoneurons. Orexin/hypocretinergic neurons integrate metabolic, emotional and circadian signals to fitting the waking level for the current factors of the surrounding. Excessive activity of the orexin/hypocretinergic system is related to insomnia and panic anxiety, and its insufficient activity is related to narcolepsy, obesity, Alzheimer and Parkinson diseases.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.