количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Исследования
Лечение острого неосложненного цистита у женщины – чего ожидать от современных антимикробных препаратов?
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Урология и Нефрология" №4
- Аннотация
- Статья
- Ссылки
В статье представлены результаты исследования профиля чувствительности возбудителей острых неосложненных циститов у женщин детородного возраста Московского региона по состоянию
на 2010–2011 гг.
Проанализирована эффективность двух стандартных и широко рекомендуемых схем антибактериальной терапии (левофлоксацином и фосфомицином) с точки зрения как купирования клинических проявлений и эрадикации возбудителя в ближайшей перспективе, так и возможного влияния антибиотиков на частоту рецидивирования острого цистита при сроке наблюдения 6 месяцев.
В статье представлены результаты исследования профиля чувствительности возбудителей острых неосложненных циститов у женщин детородного возраста Московского региона по состоянию
на 2010–2011 гг.
Проанализирована эффективность двух стандартных и широко рекомендуемых схем антибактериальной терапии (левофлоксацином и фосфомицином) с точки зрения как купирования клинических проявлений и эрадикации возбудителя в ближайшей перспективе, так и возможного влияния антибиотиков на частоту рецидивирования острого цистита при сроке наблюдения 6 месяцев.

Рис. 1. Международная классификация ИМП
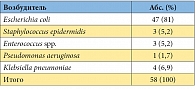
Таблица 1. Уропатогены, выявленные на первом визите у пациенток, включенных в исследование (n = 58)
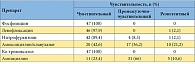
Таблица 2. Чувствительность кишечной палочки, выявленной на первом визите у пациенток, включенных в исследование (n = 47)
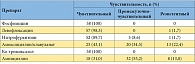
Таблица 3. Чувствительность всех микроорганизмов, выявленных на первом визите у пациенток, включенных в исследование (n = 58)
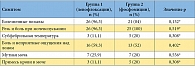
Таблица 4. Симптомы, выявленные на первом визите у пациенток, включенных в исследование
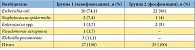
Таблица 5. Уропатогены, выявленные на первом визите у пациенток, включенных в исследование

Таблица 6. Наличие рецидивов за 6 месяцев наблюдения у пациенток, включенных в исследование (n = 52)

Таблица 7. Риск развития рецидива в зависимости от наличия примеси крови в моче у пациенток в группе фосфомицина (n = 25)
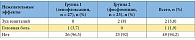
Таблица 8. Зарегистрированные на фоне применения левофлоксацина и фосфомицина нежелательные явления (n = 52)
Введение
Инфекции мочевых путей (ИМП) в настоящее время являются самыми часто встречающимися в клинической практике бактериальными инфекциями [1]. Подавляющее большинство мочевых инфекций – это острые неосложненные циститы у женщин детородного возраста. Только в России ежегодно регистрируется 26–36 млн случаев острого цистита. Показатель заболеваемости по этой нозологии в среднем составляет 0,5–0,7 эпизода заболевания на 1 женщину в год. Острый неосложненный цистит (или острая неосложненная инфекция нижних мочевых путей) не представляет угрозы для жизни пациенток, но существенно снижает ее качество.
На сегодняшний день разработаны принципы рациональной терапии мочевых инфекций, которые подразумевают точную топическую и лабораторную диагностику, исключение осложняющих факторов и выбор эмпирической терапии с учетом постоянно меняющихся профилей резистентности уропатогенов. Новая классификация ИМП, разработанная Международным консультативным советом по урологическим заболеваниям (ISUD), позволяет в полной мере соблюсти данные принципы и в значительной степени индивидуализировать диагноз (рекомендации Европейской ассоциации урологов (EAU), 2012) [2]. В классификации учитывается уровень поражения инфекционным процессом, cтепень его тяжести, имеющиеся факторы риска и микробиологические характеристики возбудителя (рис.). Диагноз при «стандартной» острой неосложненной инфекции нижних мочевых путей, к примеру, выглядит следующим образом: CY-1O Escherichia coli (a).
Следует подчеркнуть, что в соответствии с приведенной классификацией даже при остром неосложненном цистите по результатам посева в конечном итоге устанавливается микробиологический диагноз. Такой подход позволяет не только корректировать антимикробную терапию в случае выявления резистентного уропатогена, но и с течением времени ретроспективно оценивать изменение профиля чувствительности возбудителей острых циститов, вырабатывать актуальные схемы эмпирической терапии мочевых инфекций.
С одной стороны, современная эмпирическая терапия острого неосложненного цистита короткими курсами антимикробных препаратов позволяет добиваться эрадикации возбудителей и клинического выздоровления у 90–98% пациенток [3]. С другой стороны, у 50% женщин, перенесших острый неосложненный цистит, в течение последующего года заболевание рецидивирует. Более того, у половины этих женщин количество рецидивов за год достигает 3 и более [4, 5], что обусловлено, по всей видимости, несколькими причинами, одной из которых является недостаточная эффективность терапии первичного эпизода.
Неэффективная первичная антибиотикотерапия острых циститов частично может быть связана с повышением резистентности возбудителей в отдельно взятом регионе к наиболее широко используемым антибактериальным средствам. Именно поэтому так важно регулярно получать свои данные об особенностях чувствительности возбудителей ИМП и каждый раз пересматривать схемы, рекомендуемые для эмпирической антибиотикотерапии. Другим важным фактором, способным оказывать влияние на частоту рецидивов острого неосложненного цистита, по нашему мнению, может быть различная способность как уропатогенов, так и антибактериальных средств проникать в слизистую/стенку мочевого пузыря.
Далее будут представлены результаты исследования профиля чувствительности возбудителей острых неосложненных циститов у женщин детородного возраста Московского региона по состоянию на 2010–2011 гг. В ходе исследования был также проведен анализ эффективности двух стандартных и широко рекомен дуемых схем антибактериальной терапии с точки зрения не только купирования клинических проявлений и эрадикации возбудителя в ближайшей перспективе, но и возможного их влияния на частоту рецидивирования острого цистита при сроке наблюдения 6 месяцев.
Материалы и методы исследования
В рамках исследования с целью изучения профиля уропатогенов в Московском регионе за период с сентября 2010 г. по январь 2011 г. было обследовано 58 женщин с острым неосложненным циститом в возрасте от 18 до 38 лет.
На первом визите после подписания информированного согласия, сбора жалоб и анамнеза всем пациенткам выполнялось физикальное обследование. Диагноз острого неосложненного цистита устанавливался клинически, микроскопически (по данным анализа мочи) и бактериологически (по результатам посева мочи). В исследование не включались женщины с факторами риска рецидивирования, осложняющими факторами или с сопутствующими признаками инфекции верхних мочевых путей. Для сравнительного анализа эффективности двух современных схем антибактериальной терапии пациентки были рандомизированы на 2 группы: 1-я группа получала левофлоксацин (Флексид) 250 мг 1 р/сут в течение 3 дней; 2-я группа – фосфомицин (Монурал) 3 г однократно на ночь.
На втором визите (через 4 дня) оценивалась симптоматика, проводился общий и бактериологический анализ средней порции мочи. В случае отрицательного результата бактериального посева мочи или отсутствия чувствительности микроорганизма к назначенному препарату пациентка исключалась из исследования.
На третьем визите (через 1 месяц) также оценивалась симптоматика, проводился общий и бактериологический анализ средней порции мочи. Помимо этого производилось анкетирование и пациенток, и врачей с целью субъективной оценки результатов лечения.
На четвертом визите через 6 месяцев с момента назначения лечения регистрировалось количество рецидивов инфекции мочевых путей в группах, анализировались корреляции рецидивов с исходными симптомами в общей когорте и внутри групп. С целью сравнительной оценки профилей безопасности используемых схем лечения проводилась регистрация нежелательных явлений в группах. Статистическая обработка проводилась в программе SPSS.10. Сравнение между группами производилось с использованием критерия хи-квадрат, теста Манна – Уитни, точного критерия Фишера и оценки соотношения рисков.
Результаты
В исследование было включено 58 пациенток с острым неосложненным циститом, подтвержденным бактериологически. Характеристики возбудителей острой неосложненной инфекции нижних мочевых путей, определенные на первом визите, представлены в таблицах 1, 2 и 3. Полные данные по результатам обследования, лечения и 6-месячного наблюдения собраны у 52 па циенток: у 27 пациенток группы 1 (получали левофлоксацин) и у 25 пациенток группы 2 (получали фосфомицин). Прекратили участие в исследовании 6 пациенток: 5 отказались от контрольных визитов, у 1 пациентки по результатам бактериального посева на первом визите была выявлена резистентность возбудителя к назначенному при рандомизации препарату, и она была исключена из исследования. При оценке исходных данных между группами статистически значимых отличий ни по одному из исходных симптомов выявлено не было (табл. 4). По процентному составу возбудителей на первом визите отличий между группами сравнения также не выявлено (р = 0,32) (табл. 5). На втором визите (через 4 дня) эрадикация в группе левофлоксацина отмечена у 26 больных (96,3 %), персистирование – у 1 (3,7 %). В группе фосфомицина эрадикация выявлена у 25 (100 %) пациенток. Различия между группами статистически не значимы (р = 0,519) (применялся точный критерий Фишера). На третьем визите (через 1 мес.) в группе левофлоксацина эрадикация микроорганизмов установлена у всех 27 (100%) пациенток. В группе фосфомицина эрадикация имела место у 23 (92%) больных, персистирование – у 1 (4%), реинфекция установлена у 1 (4%) пациентки. Отличия между группами статистически незначимы (р = 0,325) (применялся критерий хи-квадрат).
При оценке симптомов на втором визите (через 4 дня) частое мочеиспускание в группе левофлоксацина отмечено у 3 (11,1%) пациенток, в группе фосфомицина – у 8 (32%). По данному показателю различия между группами были выраженными, однако не достигли статистически значимых величин (р = 0,066) (применялся точный критерий Фишера). Болезненных позывов не было зарегистрировано ни у одной из пациенток. Резь и боль при мочеиспускании в группе левофлоксацина сохранились у 2 (7,4%) пациенток, в группе фосфомицина – у 3 (12 %) пациенток. Различия между группами сравнения статистически незначимы (р = 0,462) (применен точный критерий Фишера). Повышения температуры тела, озноба не было ни у одной из пациенток. Болевые ощущения над лоном сохранялись у 1 (3,7 %) пациентки из группы левофлоксацина. Помутнение и/или примесь крови в моче не были зарегистрированы ни у одной из пациенток в группах. На третьем визите частое мочеиспускание отмечено у 2 (8 %) пациенток в группе фосфомицина, в группе левофлоксацина – не выявлено. Болезненных позывов не было ни у одной из пациенток. Резь и боль при мочеиспускании в группе левофлоксацина не отмечены, в группе фосфомицина сохранились у 1 (4 %) пациентки. Повышение температуры тела, озноб, помутнение и/или примесь крови в моче не были зарегистрированы ни у одной из пациенток в группах. Таким образом, по степени выраженности симптомов острого цистита на втором и третьем визите эффективность левофлоксацина и фосфомицина не имела статистически значимых отличий. Единственным симптомом, по которому отличия приблизились к статистически значимым величинам, но не достигли их, был симптом частых мочеиспусканий: на втором визите он чаще сохранялся в группе фосфомицина.
По субъективной оценке пациентками на третьем визите (через 1 месяц) в группе левофлоксацина терапия оценена как «удовлетворительная» 1 (3,7 %) пациенткой, «очень хорошая» – 26 (96,3 %) пациентками, в группе фосфомицина как «удовлетворительная» – 4 (16 %), как «очень хорошая» – 21 (84 %) пациенткой. Значимых различий между группами по данному показателю не выявлено (р = 0,152) (применялся точный критерий Фишера). По субъективной оценке эффективности терапии лечащими врачами на третьем визите в группе левофлоксацина «выздоровление» отмечено у 27 (100 %) пациенток, в группе фосфомицина – у 21 (84 %) пациентки, еще у 4 (16 %) пациенток – «улучшение». По данному показателю результаты значимо лучше в группе левофлоксацина (р = 0,047) (применялся точный критерий Фишера). Наличие рецидивов через 6 месяцев после визита 1 в группах левофлоксацина и фосфомицина представлено в таблице 6. В группе лечения фосфомицином рецидивы имели место чаще, чем в группе левофлоксацина, причем отличие между группами оказалось статистически значимым (р = 0,035) (применялся точный критерий Фишера). Соотношение рисков рецидивов в группах фосфомицина и левофлоксацина составило 4,5 (95% ДИ 1–19,2). В общей когорте пациенток (n = 52) нами не было выявлено статистически значимых корреляций между исходными клиническими проявлениями острого цистита и риском рецидива:
- частое мочеиспускание при первом визите не было связано с возникновением рецидива (р = 0,778) (применен точный критерий Фишера);
- болезненные позывы к мочеиспусканию не коррелировали с возникновением рецидива (р = 0,717);
- боль и резь при мочеиспускании не связаны с рецидивом (р = 0,778);
- повышение температуры тела не связано с рецидивом (р = 0,456);
- боль и неприятные ощущения над лоном не коррелировали с рецидивом (р = 0,331);
- помутнение мочи не коррелировало с рецидивом (р = 0,625);
- наличие примеси крови в моче не имело статистически значимой связи с возникновением рецидива (р = 0,216), однако у больных с этим симптомом рецидивы были чаще.
При анализе взаимосвязей между исходными клиническими проявлениями острого цистита и риском рецидива в группах сравнения у пациенток, принимавших фосфомицин, рецидив возникал чаще тогда, когда на первом визите была обнаружена примесь крови в моче (табл. 7), однако данная закономерность не была статистически значимой (р = 0,23). В группе левофлоксацина признаков взаимосвязи рецидива и наличия крови в моче на момент обращения выявлено не было (р = 0,692). Профиль безопасности сравниваемых схем лечения оказался благоприятным и не имел статистически значимых отличий (p = 0,211). Нежелательные явления в группах сравнения представлены в таблице 8.
Обсуждение результатов
По состоянию на 2010–2011 гг. в Московском регионе основными возбудителями острого неосложненного цистита являлись Escherichia coli (81 %), Klebsiella pneumoniae (6,9 %), Staphylococcus epidermidis (5,2 %) и Enterococcus spp. – 3 (5,2 %). Наибольшая чувствительность возбудителей неосложненных острых циститов отмечена к левофлоксацину (98,3 %), фосфомицину (94,8 %) и ко-тримоксазолу (100 %). Левофлоксацин (Флексид) и фосфомицина трометамол (Монурал) имеют сходную высокую клиническую и микробиологическую эффективность. По субъективной оценке пациентками результатов лечения значимых различий между группами не выявлено (р = 0,152). По субъективной оценке лечащих врачей левофлоксацин статистически значимо превосходил фосфомицина трометамол по клинической эффективности (p = 0,047). В группе лечения фосфомицином рецидивы имели место чаще, чем в группе, получавшей терапию левофлоксацином, при этом отличия между группами достигли статистически значимого уровня (р = 0,035). Соотношение рисков рецидивов между группой фосфомицина и группой левофлоксацина составило 4,5 (95 % ДИ 1 – 19,2). У пациенток с макрогематурией на момент обращения рецидивы при лечении фосфомицином возникали чаще, чем у пациенток без макрогематурии. Однако данная закономерность не достигла статистической значимости (р = 0,211).
Заключение
Результаты проведенного нами исследования позволяют сделать вывод о том, что даже при сходной эффективности стандартной антибактериальной терапии по привычным клиническим критериям среднесрочные результаты по частоте рецидивов могут существенно разниться. К сожалению, в настоящее время как в российской, так и в западной литературе практически отсутствуют работы по оценке результатов эмпирической терапии острых неосложненных циститов в контексте риска их последующего рецидивирования. В связи с этим нам представляется целесообразным проведение подобных исследований на бoльших группах пациенток и, возможно, с бoльшим периодом наблюдения.
1. Olson R.P., Harrell L.J., Kaye K.S. Antibiotic resistance in urinary isolates of Escherichia coli from college women with urinary tract infections // Antimicrob. Agents Chemother. 2009. Vol. 53. № 3. P. 1285– 1286.
2. EAU clinical guidelines // www.uroweb.org/fileadmin/guidelines/ 2012_Guidelines_large_text_print_total_file.pdf.
3. Naber K.G. Short-term therapy of uncomplicated cystitis // Curr. Opin. Urol. 1999. Vol. 9. № 1. P. 57–64.
4. Foxman B. Recurring urinary tract infection: incidence and risk factors // Am. J. Public Health. 1990. Vol. 80. № 3. P. 331–333.
5. Hooton T.M., Stamm W.E. Diagnosis and treatment of uncomplicated urinary tract infection // Infect. Dis. Clin. North Am. 1997. Vol. 11. № 3. P. 551–581.
Новости на тему
17.02.2023
Отправить статью по электронной почте
Ваш адрес электронной почты:
В статье представлены результаты исследования профиля чувствительности возбудителей острых неосложненных циститов у женщин детородного возраста Московского региона по состоянию на 2010–2011 гг.
Проанализирована эффективность двух стандартных и широко рекомендуемых схем антибактериальной терапии (левофлоксацином и фосфомицином) с точки зрения как купирования клинических проявлений и эрадикации возбудителя в ближайшей перспективе, так и возможного влияния антибиотиков на частоту рецидивирования острого цистита при сроке наблюдения 6 месяцев.
" id="sender_art_description" name = "SENDER_ART_DESCRIPTION" />
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
