Абдоминальная боль и висцеральная гиперчувствительность – две грани одной реальности для пациентов с СРК
- Аннотация
- Статья
- Ссылки
- English


Синдром раздраженного кишечника (СРК) является одним из наиболее распространенных функциональных заболеваний желудочно-кишечного тракта (ЖКТ). Во всем мире приблизительно 9,8–12,8% взрослого населения, преимущественно женщины, имеют симптомы, соответствующие СРК. Пик заболеваемости приходится на самый активный трудоспособный возраст – 24–41 год [1]. Важно подчеркнуть, что симптомы СРК продолжают беспокоить пациентов в течение длительного периода, могут сочетаться с другими функциональными расстройствами, а у части пациентов – с возникающими или имеющимися органическими заболеваниями (например, дивертикулярной болезнью). Пусковыми факторами CРК признаны воспаление и инфекция ЖКТ, пищевая непереносимость, хронический стресс, дивертикулит, хирургические вмешательства, прием антибиотиков и др.
В качестве основных звеньев патогенеза СРК, реализующихся при нарушении взаимодействия «кишка – мозг – микробиота», рассматриваются гипермоторная или спастическая дискинезия кишечника, висцеральная гиперчувствительность (ВГЧ), вегетативные и гормональные сдвиги, психосоциальные нарушения, генетические факторы и факторы окружающей среды. Значительная роль в патогенезе CРК отводится изменениям в составе кишечной микробиоты, в том числе после перенесенных кишечных инфекций (постинфекционный CРК). Изменения кишечной микробиоты на фоне повышенной проницаемости слизистой оболочки, сопровождающейся снижением экспрессии белков плотных контактов (клаудина, окклюдина и др.), могут приводить к активации иммунной системы стенки кишечника и формированию субклинического воспаления вблизи нервных окончаний, участвуя в патогенезе ВГЧ [2].
В 2016 г. были пересмотрены и опубликованы критерии диагностики СРК (Римские критерии IV), которые включают наличие рецидивирующей абдоминальной боли по крайней мере не реже одного дня в неделю на протяжении последних трех месяцев с началом симптомов за шесть месяцев до постановки диагноза, ассоциированной с двумя и более симптомами:
- дефекацией;
- изменением частоты стула;
- изменением формы стула.
Дополнительными симптомами являются:
- патологическая частота стула (менее трех раз в неделю или более трех раз в день);
- патологическая форма стула (комковатый/твердый или жидкий/водянистый);
- натуживание при дефекации;
- императивный позыв или чувство неполного опорожнения;
- выделение слизи;
- вздутие [3].
По сравнению с III Римскими критериями (2006) в настоящие критерии внесены некоторые изменения: убран термин «дискомфорт» в связи с неоднозначностью трактовки его пациентами, увеличена частота появления симптомов – не менее одного дня в неделю (в предыдущих критериях – три дня в течение месяца), а также заменен термин «облегчение боли после дефекации» на «ассоциацию с дефекацией», так как не у всех пациентов дефекация приводила к уменьшению болей.
Согласно Римским критериям III, IV, в зависимости от преобладания того или иного типа нарушений стула предлагается выделять следующие типы СРК:
- СРК с запором – при наличии твердого или бобовидного кала при > 25% из общего числа опорожнений кишечника, однако допускается и наличие разжиженного (кашицеобразного) или водянистого кала при < 25% из общего числа опорожнений кишечника;
- СРК с диареей, для которого характерно наличие кашицеобразного или водянистого кала при > 25% из общего числа опорожнений кишечника, однако допускается и наличие твердого или бобовидного кала при < 25% из общего числа опорожнений кишечника;
- СРК смешанного типа, при котором имеет место чередование твердого или бобовидного кала и кашицеобразного или водянистого кала при ≥ 25% из общего числа опорожнений кишечника;
- неклассифицированный СРК – недостаточная выраженность отклонений консистенции кала для вышеуказанных типов [4].
Диагноз СРК должен устанавливаться на основании жалоб пациента (соответствие Римским критериям IV), анамнеза, клинической картины, физикального осмотра, минимальных лабораторных тестов и методов инструментальной диагностики при необходимости их проведения. В процессе постановки диагноза должны быть исключены другие заболевания кишечника, кроме дивертикулярной болезни: воспалительные заболевания кишки, целиакия, лактазная и фруктозная недостаточность, микроскопический колит и пр., заболевания других органов пищеварения, других органов и систем, при которых имеют место функциональные расстройства кишечника, прием лекарственных препаратов, влияющих на функцию кишечника [3].
Лечение больных с СРК
Согласно Римским рекомендациям IV, медикаментозную терапию предлагается назначать с учетом преобладания у больных СРК тех или иных клинических симптомов.
При любом из типов СРК обязательным симптомом является рецидивирующая абдоминальная боль, обусловленная повышением внутрикишечного давления и наличием повышенной висцеральной чувствительности. Поскольку в основе повышения внутрикишечного давления лежит либо спастическая дискинезия – гипертонус циркулярной мускулатуры (вариант СРК с запором), либо гипермоторная дискинезия – гипертонус продольной мускулатуры (вариант СРК с диареей), то для нормализации моторных нарушений и купирования боли препаратами первой линии признаны миотропные спазмолитики.
Лекарственные средства для купирования болевого синдрома у больных СРК, разрешенные и рекомендованные к применению в России, включают несколько различных по своему механизму действия классов препаратов: антихолинергические (гиосцина бутилбромид), гладкомышечные миорелаксанты (мебеверин, алверина цитрат), а также селективные блокаторы кальциевых каналов (пинаверия бромид) и периферические агонисты опиатных рецепторов (тримебутин) [5].
В механизме возникновения абдоминальной боли большая роль отводится ВГЧ. В настоящее время ВГЧ рассматривается в качестве одной из основных гипотез в объяснении болевого синдрома при СРК и даже предложена в качестве «биологического маркера» этого заболевания. ВГЧ – это повышенная чувствительность к периферическим стимулам (механическим, термическим, химическим и др.), проявляющаяся болевыми ощущениями, моторными и секреторными нарушениями в ответ на допороговые стимулы. Патофизиологический феномен ВГЧ впервые был обнаружен в 80-е гг. у больных с СРК. Было установлено, что выраженность ВГЧ достоверно коррелировала с симптомами заболевания, а баллонно-дилатационный тест оказался высокоспецифичным и чувствительным методом ее исследования [6]. ВГЧ рассматривается в настоящее время в качестве первичного патофизиологического механизма, который обусловливает формирование и интенсивность абдоминальной боли при СРК. Поэтому при выборе препарата для купирования абдоминальной боли у больных СРК важно учитывать влияние его на ВГЧ.
Комбинация алверина цитрата и симетикона – Метеоспазмил («Майоли Спиндлер», Франция) используется в Европе с 1990 г. для лечения симптомов, связанных с функциональными нарушениями кишечника. В состав препарата входит 60 мг алверина цитрата и 300 мг симетикона (диметикон, обогащенный диоксидом кремния) в мягкой капсуле. Фармакологические исследования показали, что алверина цитрат влияет на перистальтику кишечника и висцеральную чувствительность, то есть на два фактора, которые вовлечены в процесс развития функциональных нарушений кишечника, и не вызывает выраженного системного эффекта [7, 8]. Алверина цитрат оказывает влияние на спонтанную и индуцированную мышечную сократимость путем кальцийзависимого или независимого ингибирования нейронной возбудимости, а также путем прямой инактивации Ca2+-каналов L-типа в клетках гладких мышц кишечника. Алверина цитрат блокирует поступление ионов кальция из внеклеточного пространства в гладкомышечные клетки через потенциалзависимые каналы (VOC) – прямой эффект, а также блокирует нейрорецепторы рецепторзависимых каналов (ROC) и препятствует проникновению кальция в гладкомышечную клетку – непрямой эффект. Кроме того, алверина цитрат оказывает прямое релаксирующее действие благодаря ингибированию фосфодиэстеразы гладкомышечной клетки. Таким образом достигается эффект купирования спазма гладкой мускулатуры кишечника, в результате чего снижается возбудимость механорецепторов в слизистой оболочке кишки и уменьшается передача болевого импульса в центральную нервную систему (ЦНС) [9].
Для функциональных заболеваний толстой кишки помимо моторных характерны и сенсорные отклонения, к которым относят гипералгезию – боль, возникающую под воздействием слабых повреждающих стимулов. Полагают, что ведущую роль в развитии гипералгезии играет серотонин. При повышении внутрипросветного давления в кишке энтерохромаффинные клетки выделяют серотонин, который, активизируя 5НТ-рецепторы, локализующиеся на первичных афферентных нейронах, вызывает появление периферических восходящих сенсорных импульсов. Сенсорные импульсы в коре головного мозга формируют различные ощущения, в том числе и болевые. Алверина цитрат не только надежно купирует спастические эффекты гладкой мускулатуры кишки, но и влияет на передачу нервных импульсов к периферическим и центральным нервным центрам по афферентным нервным волокнам [7]. Экспериментальными данными доказано наличие антиноцицептивного действия Метеоспазмила. Было показано, что алверина цитрат селективно связывается с рецепторами 5-HT1A и таким образом выступает в качестве антагониста, что приводит к снижению висцерального проноцицептивного эффекта 5HT-рецептора. Этот механизм может лежать в основе антиноцицептивного действия в отношении поствоспалительной ВГЧ [10]. Таким образом, алверина цитрат уменьшает болевую чувствительность и регулирует кишечный моторный ответ на воздействие боли.
В состав Метеоспазмила помимо алверина цитрата входит симетикон, что определяет преимущества использования этого препарата при функциональных расстройствах кишечника, сопровождающихся метеоризмом. Наличие в просвете полого органа жидкого содержимого с высоким поверхностным натяжением и избыточного количества газов приводит к образованию большого количества пузырьков газа («пены»). Это способствует значительному растяжению органа, повышению внутрипросветного давления и формированию или усилению болевого абдоминального синдрома. Исследования показали, что количество газа у больных с СРК не отличается от такового у здоровых людей, однако транзит его по кишечнику резко замедлен и даже незначительное увеличение объема кишечного газа может при СРК вызвать дискомфорт или абдоминальную боль [11]. Симетикон является инертным веществом с противовспенивающим действием. Он нерастворим в воде, быстро распространяется по разделу сред «жидкость – газ» в виде слоя и вытесняет пенообразователи из поверхностного слоя пленки. При этом происходит слияние газовых пузырьков и их осаждение, то есть разрушение пены, что приводит к уменьшению общего ее объема, восстановлению естественной абсорбции газов через кишечную стенку, снижению внутриполостного давления и ускорению транзита по кишке. Снижение давления газов благодаря симетикону способствует уменьшению раздражения механорецепторов кишки, тем самым уменьшая висцеральную гиперчувствительность. Кроме того, обволакивая слизистую, симетикон может снижать повышенную проницаемость толстой кишки. Ограничивая проникновение иммуностимулирующих веществ через слизистую кишки, симетикон, вероятно, снижает сенсибилизацию первичных афферентных нервных окончаний. Таким образом, не только алверин, но и симетикон способствует снижению висцеральной чувствительности и повышает порог болевой чувствительности к растяжению кишки у больных СРК как с метеоризмом, так и без него. Сочетание спазмолитического эффекта, адсорбции газа в просвете кишки, снижение висцеральной чувствительности позволяют Метеоспазмилу надежно купировать абдоминальную боль и восстанавливать функциональную активность кишки как у больных с СРК, так и при вторичных моторных нарушениях кишки (например, на фоне хронического панкреатита).
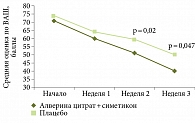
Эффективность Метеоспазмила в лечении функциональных нарушений кишечника доказана в многочисленных исследованиях. Одно из масштабных исследований – многоцентровое двойное слепое рандомизированное плацебоконтролируемое исследование Т. Wittmann и соавт. (2009) включало 409 пациентов с СРК. Его целью была оценка эффективности комбинации алверина и симетикона у пациентов с абдоминальной болью и дискомфортом по сравнению с плацебо. Интенсивность абдоминальной боли или дискомфорта оценивалась по визуально-аналоговой шкале (ВАШ) до и после четырех недель лечения. На четвертой неделе у пациентов, получавших алверина цитрат и симетикон (три капсулы Метеоспазмила в день), наблюдали более низкие баллы ВАШ при оценке абдоминальной боли или дискомфорта по сравнению с плацебо (средний показатель 40 и 50 мм соответственно, р = 0,047) и более высокий уровень ответа на лечение (46,8 и 34,3% соответственно) (рис. 1). У пациентов в группе алверина цитрата и симетикона отмечалось также более выраженное общее улучшение симптомов по сравнению с пациентами в группе плацебо (р = 0,0001). Сделан вывод, что комбинация алверина и симетикона была значительно более эффективной по сравнению с плацебо в уменьшении абдоминальной боли или дискомфорта у пациентов с СРК [12].
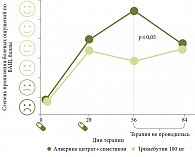
В сравнительных исследованиях по оценке эффективности Метеоспазмила и мебеверина и Метеоспазмила и тримебутина было показано, что эффективность Метеоспазмила при лечении СРК с запором и диареей сопоставима с результатами лечения мебеверином (через три недели терапии у пациентов, принимавших алверина цитрат и симетикон, наблюдалось статистически достоверное улучшение частоты и консистенции стула (р = 0,001), в то время как у больных, получавших мебеверин, существенной разницы не отмечено (р = 0,12)) и достоверно выше, чем у тримебутина (рис. 2) [13, 14].
При оценке динамики клинических симптомов и показателей висцеральной чувствительности отличный и хороший эффекты при приеме Метеоспазмила были достигнуты у 90% пациентов с СРК с преобладанием абдоминальной боли и метеоризма, а также у 54% пациентов с СРК с преобладанием запора и у 83% пациентов с преобладанием диареи. Исследование чувствительности с использованием баллонно-дилатационного теста показало, что при применении Метеоспазмила порог болевой чувствительности повысился у 95% больных с СРК, а у 22% из них достиг нормальных величин [15].
В нашем исследовании (2011) была также показана высокая эффективность двухнедельного приема Метеоспазмила в купировании болевого синдрома и диспепсических явлений как при СРК, так и при вторичных нарушениях моторной функции кишки, проявлявшихся спастической дискинезией толстой кишки (при язвенной болезни, патологии гепатобилиарной системы, дивертикулярной болезни). Хороший и удовлетворительный эффекты лечения получены у 95,1% больных, включенных в исследование: у 95% больных с СРК и у 95,2% с вторичными моторными нарушениями при заболеваниях ЖКТ. Нормализация стула отмечена у 77,8% больных как с диареей, так и с запорами. Результаты исследования подтверждают хороший терапевтический эффект Метеоспазмила при лечении больных с нарушениями моторной функции кишки как первичного (СРК), так и вторичного генеза, проявляющимися абдоминальными болями и метеоризмом, что позволяет рекомендовать препарат для широкого применения в клинической практике как при курсовом лечении, так и в качестве средства симптоматической терапии [16].
Практически во всех исследованиях доказаны хорошая переносимость и безопасность Метеоспазмила, в редких случаях сообщалось о кожных реакциях [16, 17].
Лечение СРК с диареей
При СРК с диареей рекомендуют диету исключения, которая не содержит кофеин, лактозу, фруктозу, сорбитол, уксус, алкоголь, перец, копчености, а также продукты, вызывающие чрезмерное газообразование. В Римских рекомендациях IV обсуждается целесообразность использования диеты Low FODMAP, название которой образуют первые буквы слов: ферментируемые (Fermentable) олиго- (Oligo-), ди- (Di-), моно- (Mono-) сахариды и (And) полиолы (Polyol). Ограничение содержания относящихся к группе FODMAP углеводов, как было показано в различных исследованиях, оказывает положительное действие при СРК и других функциональных заболеваниях ЖКТ. У некоторых пациентов с СРК бывает полезным исключение глютена даже при отсутствии доказательств наличия целиакии (повышенной сенситизации к глютену). Однако исключение пищевых волокон из рациона может оказать и негативное влияние как на рост и развитие микробиоты, так и в целом на функциональное состояние кишечника. Поэтому рекомендации по элиминационным диетам не должны распространяться на всех пациентов с СРК.
Медикаментозная терапия CРК с диареей (Рим IV) включает следующие препараты:
- лоперамид – агонист µ-опиоидных рецепторов. Снижает частоту стула и улучшает его консистенцию. Используется кратковременно и по требованию. Назначается 2 мг утром или дважды в день. При необходимости суточная доза может составлять 16 мг;
- секвестранты желчных кислот – холестирамин 9 г два-три раза в день. В настоящее время в России отсутствует. С этой целью может использоваться диосмектит – универсальный адсорбент и цитопротектор. Назначается по требованию от трех до шести пакетиков (3 г) в день;
- алосетрон (антагонист 5-HT3-серотониновых рецепторов) – разрешен к применению в США и назначается врачами, аккредитованными в специальной программе по лечению СРК. Препарат используется у женщин с СРК с диареей, не отвечающих на другие антидиарейные препараты. Ограничение применения этого препарата обусловлено возможным развитием опасного, хотя и редкого осложнения – ишемического колита. В России препарат не зарегистрирован;
- рифаксимин – невсасывающийся антибактериальный препарат, назначаемый в дозе 400 мг три раза в день, по данным многочисленных исследований, существенно снижает выраженность вздутия и диареи. Эффект препарата связывают с устранением синдрома избыточного бактериального роста в тонкой кишке, часто встречающегося при СРК. Препарат может использоваться повторными курсами без риска формирования резистентности и развития побочных эффектов.
Лечение CРК с запором
При лечении СРК с запором Римскими критериями IV рекомендована диета с высоким содержанием пищевых волокон или объемформирующие агенты, к которым относятся препараты псиллиума до 30 мг в разделенных дозах, а также осмотические слабительные – полиэтиленгликоль (17–34 мг в день). Активатор хлоридных каналов (любипростон 8 мг два раза в день), агонист гуанилатциклазы (линаклотид 250 мг четыре раза в день), элюксадолин (Eluxadoline – смешанный агонист µ-антагонист δ-опиоидных рецепторов) в России не зарегистрированы [3]. Объемформирующие и осмотические слабительные являются физиологичными, имеют доказанную базу их эффективности при запорах и входят в рекомендации многих гастроэнтерологических сообществ разных стран. Препараты лактулозы, относящиеся к осмотическим слабительным, в связи с наличием побочного эффекта – вздутия стали реже использоваться у больных CРК с запором. При неэффективности диеты, объемформирующих и осмотических средств у больных с СРК используется алгоритм ведения пациентов с функциональным запором, который включает использование раздражающих слабительных (бисакодила, препаратов сенны и др.) и энтерокинетиков (прукалоприда).
Коррекция микробиоты
Для здорового функционирования ЖКТ определяющим фактором является наличие стабильного и разнообразного состава кишечной микробиоты. У пациентов с СРК выявляются некоторые видовые различия в микробиоме, но четкой связи состава микробиоты с клинической картиной и вариантами СРК до настоящего времени не обнаружено. Однако следует учитывать, что при CРК c диареей отмечается ускоренный транзит химуса по кишке. Последствия быстрого транзита сводятся к нарушению процессов гидролиза и всасывания компонентов пищи. Это приводит к повышению осмолярности кишечного содержимого за счет уменьшения времени контакта ингредиентов пищи с ферментами, избыточному бактериальному росту в тонкой кишке, увеличению содержания в толстой кишке желчных кислот, а также метаболитов микробиоты – коротко- и среднецепочечных жирных кислот и других продуктов бактериального гидролиза. При СРК с запором отмечается замедленный транзит химуса, а длительный стаз кишечного содержимого также приводит к нарушению количественного и качественного состава кишечной микробиоты [18].
Основные направления терапевтического воздействия на кишечный микробиом включают использование диет, пробиотиков, пребиотиков, метабиотиков (продуктов жизнедеятельности нормальной кишечной микрофлоры) и по показаниям – антибактериальных средств (кишечных антисептиков). Ведущая роль в терапии синдрома избыточного бактериального роста в тонкой кишке отводится антибиотикам, назначение которых преследует цель не стерилизации тонкой кишки, а модификации состава тонкокишечных бактерий, максимального приближения его к норме. Антибактериальная терапия должна быть направлена на удаление грамнегативных и анаэробных бактерий. Показаниями для проведения деконтаминации кишечника являются:
- избыточный бактериальный рост в тонкой кишке;
- транслокация кишечных бактерий за пределы кишки;
- воспалительные процессы в кишечнике; г) выявление условно патогенной флоры в кишечнике;
- отсутствие эффекта от лечения без проведения деконтаминации кишечника.
Подход к назначению антибактериальных средств в основном эмпирический, в то же время необходимо учитывать, что при избыточном бактериальном росте в тонкой кишке и при транслокации бактерий за пределы кишечника приоритетными являются всасывающиеся, а при нарушении микрофлоры толстой кишки и сочетанных расстройствах – невсасывающиеся препараты. Из всасывающихся препаратов лекарственными средствами первого выбора являются фторхинолоны (ципрофлоксацин 500 мг два раза в день), метронидазол 250 мг три раза в день, амоксициллин + клавулановая кислота 625 мг два раза в день, фуразолидон 100 мг три раза в день и др., из невсасывающихся – рифаксимин 200 мг три-четыре раза в день, нифуроксазид 200 мг три-четыре раза в день. Продолжительность курса антибактериальной терапии составляет семь дней. Повторные курсы терапии проводятся при рецидивировании симптомов синдрома избыточного бактериального роста со сменой препаратов в очередном курсе.
После окончания антибактериальной терапии для восстановления микробиоты толстой кишки целесообразно принимать пробиотики, содержащие в своем составе анаэробные штаммы бифидо- и лактобактерий, в течение четырех недель [19, 20]. К таким пробиотикам относятся Пробиолог и Пробиолог форте, которые содержат анаэробные штаммы живых бактерий Lactobacillus acidophilus LA-5 и Bifidobacterium animalis subs. lactis BB-12. Общая доза микроорганизмов в Пробиологе – от 1 млрд, в Пробиологе Форте – в среднем 2,5 млрд.
В настоящее время продолжается активный поиск пробиотиков, которые не только бы оказывали положительное влияние на симптомы СРК, но и в целом способствовали улучшению качества жизни пациентов.
Исследованиями показано, что микробиота кишечника способна модулировать функцию иммунной системы и гладкомышечной ткани, оказывать влияние на проницаемость эпителиальных клеток, передачу нервных импульсов в кишечнике, висцеральную чувствительность и воспалительные ответы у человека; эффекты которых коррелируют с улучшением симптомов у пациентов с СРК. Продемонстрировано также, что эффекты кишечной микробиоты распространяются за пределы ЖКТ и оказывают влияние на ЦНС и поведение при отсутствии видимых изменений в уровне местных или циркулирующих цитокинов или уровня отдельных нейромедиаторов в кишечнике, позволяя предположить наличие прямой оси между кишечной микробиотой и головным мозгом [21, 22].
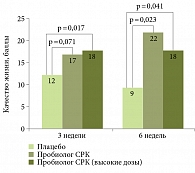
Многоцентровое рандомизированное двойное слепое плацебоконтролируемое интервенционное клиническое исследование показало, что новая комбинация трех пробиотических бактерий – двух штаммов Lactobacillus plantarum (CECT7484 и CECT7485) и одной Pediococcus acidilactici (CECT7483) в составе нового пробиотика Пробиолог СРК у пациентов с CРК с диареей в течение шести недель превосходила плацебо по положительному влиянию на качество жизни пациентов (рис. 3). Повышение качества жизни пациентов с СРК было преимущественно обусловлено улучшением психического статуса и сопровождалось снижением тревоги, связанной с состоянием кишечника. Ранее было показано, что данные штаммы бактерий, участвуя в ферментации пищевых волокон, продуцируют большое количество короткоцепочечных жирных кислот, в частности масляной кислоты, которая модулирует моторику кишечника и уменьшает висцеральную боль. Штаммы бактерий, входящие в эту комбинацию, способствуют также снижению воспаления в слизистой оболочке кишки и уменьшают диарею у больных СРК (таблица) [23].
Данная комбинация трех пробиотических бактерий вошла в практические рекомендации Всемирной гастроэнтерологической организации «Пробиотики и пребиотики 2017» для использования у пациентов с СРК. Одна капсула Пробиолог СРК (рис. 4) содержит не менее 3,0 млрд КОЕ Lactobacillus plantarum CECT 7484, Lactobacillus plantarum CECT 7485, Pediococcus acidilactici CECT 7483. Рекомендуется принимать в дозе не менее 3,0 млрд КОЕ раз в день не менее трех недель.
Примерная схема лечения CРК с преобладанием диареи
Диагноз: синдром раздраженного кишечника с диареей. Синдром избыточного бактериального роста в тонкой кишке.
Рекомендуется:
- диета (с исключением сырых овощей и фруктов, пресного молока);
- Метеоспазмил по одной капсуле три раза в день за 30 минут до еды в течение трех-четырех недель;
- рифаксимин 200 мг по две таблетки два раза в день в течение семи дней;
- далее Пробиолог форте по одной капсуле в день в течение 28 дней.
- Диагноз: синдром раздраженного кишечника с диареей.
Рекомендуется:
- диета (с исключением сырых овощей и фруктов, пресного молока);
- Метеоспазмил по одной капсуле три раза в день за 30 минут до еды в течение трех-четырех недель;
- Пробиолог CРК по одной капсуле в день в течение трех недель.
N.A. Agafonova, E.P. Yakovenko, A.N. Ivanov, A.V. Yakovenko
N.I. Pirogov Russian National Research Medical University
Contact person: Nataliya Anatolyevna Agafonova, kafgastro@mail.ru
A modern view on the pathogenesis and diagnostic criteria of IBS (Rome IV) is presented. Discusses the tactic of medical treatment of patients with different variants of IBS, targeted relief of pain and normalization of motor disorders with the use of antispasmodics, in particular Meteospasmyl. Also the modern point of view on the importance of the correction of the microbiota in IBS and the role of probiotics, such as Probiolog IBS.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.