Абсолютное маточное бесплодие (синдром Майера – Рокитанского – Кюстера – Хаузера)
- Аннотация
- Статья
- Ссылки
- English
Представлены клинические случаи СМРКХ с анализом этиологических факторов и клинических проявлений. Продемонстрирована важность своевременной диагностики и индивидуального подхода к лечению с учетом сочетания заболевания с другими гинекологическими и экстрагенитальными патологиями.
Проанализированы актуальные исследования и перспективы дальнейшего изучения СМРКХ: генетические факторы, нехирургическое лечение – бескровный кольпопоэз, лечение абсолютного маточного бесплодия путем трансплантации матки, что позволяет своевременно верифицировать синдром и разработать тактику лечения с целью достижения благоприятного результата в долгосрочной перспективе.
Представлены клинические случаи СМРКХ с анализом этиологических факторов и клинических проявлений. Продемонстрирована важность своевременной диагностики и индивидуального подхода к лечению с учетом сочетания заболевания с другими гинекологическими и экстрагенитальными патологиями.
Проанализированы актуальные исследования и перспективы дальнейшего изучения СМРКХ: генетические факторы, нехирургическое лечение – бескровный кольпопоэз, лечение абсолютного маточного бесплодия путем трансплантации матки, что позволяет своевременно верифицировать синдром и разработать тактику лечения с целью достижения благоприятного результата в долгосрочной перспективе.
Введение
Синдром Майера – Рокитанского – Кюстера – Хаузера (СМРКХ) представляет собой врожденное нарушение, характеризующееся аномалиями внутриутробного развития мюллеровых протоков [1, 2]. Как следствие – отсутствие или неполная сформированность матки и верхних двух третей влагалища при нормальном женском кариотипе (46 XX), нормальной структуре наружных половых органов и развитии вторичных половых признаков в период полового созревания [2]. В зарубежной литературе этот синдром также известен как CAUV-синдром (Congenital Absence of the Uterus and Vagina), MA-синдром (Mullerian Aplasia) и GRES-синдром (Genital Renal Ear Syndrome) [3].
Данная патология, частота встречаемости которой составляет примерно один случай на 4500–5000 новорожденных девочек [1–6], является второй по распространенности причиной первичной аменореи (после аменореи, обусловленной заболеваниями яичников) [1].
Эмбриология, этиология, классификация
Из парных парамезонефральных (мюллеровых) протоков (ПМП) развиваются маточные трубы, матка, шейка матки и верхние две трети влагалища, из мочеполового синуса – нижняя треть влагалища. ПМП закладывается на пятой-шестой неделе эмбрионального развития. Из целомического эпителия урогенитальных гребней формируются двухсторонние инвагинации, рост которых имеет краниокаудальный характер, в результате чего инвагинации достигают просвета урогенитального синуса. Каудальные части двух ПМП сливаются и дают начало матке, шейке матки и верхней части влагалища, а из краниальных частей образуются две маточные трубы. В отсутствие роста ПМП в каудальном направлении формируется аплазия влагалища и матки, а частичная аплазия влагалища – при нарушении слияния ПМП с урогенитальным синусом. При этом протяженность аплазии зависит от степени задержки роста протоков [1, 4, 7].
В мировой литературе выделяют следующие варианты СМРКХ:
тип I включает только аплазию матки и влагалища при нормальном развитии яичников и других систем, встречается в 44–47% случаев [3, 4];
тип II, или MURCS-ассоциация (Mullerian Duct Aplasia, Renal Dysplasia and Cervical Somite anomalies), встречается в 32% случаев, характеризуется аплазией матки и влагалища в сочетании с аномалиями почек, скелета (чаще – шейно-грудного отдела), дефектами слуха и редкими сердечными аномалиями [3]. MURCS-ассоциация может быть связана с нарушением морфогенеза генито-репродуктивного тракта плода: агенезией парамезонефрального протока или его неспособностью сформировать матку [5].
Некоторые авторы выделяют атипичный, или сложный, вариант СМРКХ. Для него характерна, кроме отсутствия матки и влагалища, почечная или скелетная патология [7].
В литературе описаны редкие случаи сочетания аплазии матки и влагалища с другими гинекологическими патологиями. Сообщается о наличии опухолей яичников на фоне СМРКХ, как доброкачественных, так и злокачественных. В структуре доброкачественных опухолей яичников муцинозные цистаденомы составляют 10–15% [5].
Лейомиома у больных СМРКХ встречается редко. Большинство лейомиом развиваются у женщин с моно- или двусторонней рудиментарной маткой. В литературе лейомиома в отсутствие рудиментарной матки описана только в двух случаях. Часто единственным диагностическим инструментом для определения характера поражения является хирургическое вмешательство, поскольку методы диагностической визуализации могут иметь неоднозначную интерпретацию [6].
Описаны случаи эндометриоза у пациенток с СМРКХ. Следует отметить, что обструктивные аномалии мюллеровых протоков тесно связаны с эндометриозом. Нарушение перистальтики маточных труб и рефлюкс менструальной крови при обструктивных аномалиях считаются факторами риска развития эндометриоза. Примерно у 40% пациенток с функционирующими мышечными валиками имеется эндометрий. Около 50% из них испытывают циклические менструальноподобные тазовые боли в отсутствие наружного кровотечения, что в свою очередь может привести к образованию гематометры и рефлюксу крови в брюшную полость. Таким образом, функциональные остатки, вызывающие циклическую тазовую боль, ассоциируются с развитием эндометриоза и существенно влияют на качество жизни пациенток [8].
В настоящее время наиболее современными классификациями аномалий женских половых органов являются классификация ESHRE 2013 г. [9] и обновленная классификация ASRM 2021 г. (MAC2021) [10].
В классификации ESHRE 2013 г. аномалии женских половых органов подразделены на две группы:
- аномалии матки;
- аномалии шейки матки и влагалища.
Аномалии развития матки в свою очередь разделяют на классы и подклассы. Выделяют несколько больших классов [11]:
- U0 – нормальная матка;
- U1 – аномальное строение матки, которое разделяют на основные подклассы: Т-образная матка, инфантильная матка и др.;
- U2 – матка с внутриматочной перегородкой. В данном классе выделяют два подкласса: частичная и полная внутриматочные перегородки;
- U3 – удвоение матки. В данном классе выделяют три подкласса: частичное, полное удвоение матки и удвоенная матка, разделенная перегородкой;
- U4 – однорогая матка, которая делится на два подкласса: однорогая матка с рудиментарной полостью или без таковой. Первый подкласс включает полость либо сообщающуюся с маткой, либо не сообщающуюся с ней. Соответственно второй подкласс может включать в себя рог без полости либо рог может вовсе отсутствовать;
- U5 – аплазия матки. Данный класс также разделяют на два подкласса – с рудиментарной полостью и без нее. Первый подкласс включает в себя уни-/билатеральный рог, второй класс – уни-/билатеральный рог или непосредственно аплазию;
- U6 – неклассифицируемые аномалии.
Аномалии шейки матки и влагалища разделяют на сосуществующие классы.
К мальформациям шейки матки относятся [11]:
- C0 – нормальная шейка матки;
- С1 – шейка матки с перегородкой;
- С2 – удвоение шейки матки;
- С3 – аплазия одной из шеек;
- С4 – аплазия шейки матки.
Аномалии влагалища классифицируют следующим образом [11]:
- V0 – нормальное влагалище;
- V1 – продольная перегородка влагалища без обструкции;
- V2 – продольная перегородка влагалища с обструкцией;
- V3 – поперечная перегородка влагалища и/или неперфорированная девственная плева;
- V4 – аплазия влагалища.
Этиология синдрома изучена недостаточно. По данным мировой статистики, наследственные факторы играют роль в 10–25% случаев [2]. Современные геномные исследования с использованием хромосомного микроматричного анализа и геномного секвенирования выявили мутации, связанные с СМРКХ: делеции 17q12 (LHX1, HNF1B) и 16p11.2 (TBX6), а также вариации в GENB1L и PAX8. Это указывает на многофакторную природу синдрома, связанную с участием различных генов [1].
Подавляющее большинство таких аномалий диагностируются в подростковом возрасте. Важным клиническим этапом лечения пациенток с аплазией влагалища является кольпопоэз или кольпоэлонгация, направленная на обеспечение полноценной половой жизни [2]. На сегодняшний день в мировом сообществе наиболее предпочтительным методом формирования неовлагалища у подростков и молодых девушек считается механическая кольпоэлонгация, также называемая консервативным бескровным или неоперативным кольпопоэзом [4]. При растяжении тканей влагалищной ямки за счет постепенного надавливания за задней спайкой малых половых губ образуется искусственное влагалище [5].
Поскольку СМРКХ вызывает абсолютное маточное бесплодие (absolute uterine factor infertility, AUFI), возникла необходимость в разработке методов его лечения, таких как трансплантация матки. В 2014 г. в Швеции впервые после успешной трансплантации матки родился ребенок, что стало важным этапом в лечении AUFI [1].
Клинический пример 1
Пациентка А., 16 лет, в связи с жалобами на отсутствие менструации и эпилептические приступы в анамнезе направлена в гинекологическое отделение Российской детской клинической больнице (РДКБ) – филиал ФГБОУ ВО «Российский научно-исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России.
Из анамнеза: асфиксии новорожденных, физиологической желтухи не было. Период адаптации благоприятный, раннее физическое развитие в соответствии с возрастом. Дебют эпилепсии в возрасте 14 лет, когда на фоне бодрствования произошел эпизод потери сознания с постприступной дезориентацией и подергиванием кистей рук. Спустя месяц случился генерализованный судорожный приступ с неуточненным началом. Ранее наблюдалась у невролога по поводу подергивания век, назначался тиоридазин. Уставлен диагноз генерализованной идиопатической эпилепсии, назначен постоянный прием топиромата по схеме, который позже был заменен ламотриджином в дозе 50 мг в утренние часы и 75 г в вечерние ввиду возникновения побочных эффектов. В настоящее время доза увеличена до 100 мг утром и вечером.
В возрасте 14 лет пациентка была проконсультирована гинекологом в связи с отсутствием менструации, направлена на ультразвуковое исследование (УЗИ) и магнитно-резонансную томографию (МРТ) органов малого таза (ОМТ). Заключение: гипоплазия матки.
Лабораторные исследования: фолликулостимулирующий гормон (ФСГ) – 11,55 МЕ/л, лютеинизирующий гормон (ЛГ) – 37,37 МЕ/л, тиреотропный гормон (ТТГ) – 0,865 мЕд/л, Т4 свободный – 12,49 пмоль/л.
В плановом порядке госпитализирована в отделение гинекологии РДКБ, выполнена кольпоэлонгация по Шерстневу с эстриолсодержащим кремом.
УЗИ ОМТ: матка представлена в виде мышечного тяжа размером 29 × 10 × 20 мм. М-эхо четко не визуализируется. Правый яичник – 24 × 18 × 20 мм с единичными мелкими фолликулами, максимально – до 6 мм в диаметре. Левый яичник четко не визуализируется: экранирован петлями кишечника. Заключение: гипоплазия матки.
Через девять месяцев повторно в плановом порядке госпитализирована в гинекологическое отделение РДКБ.
В ходе УЗИ ОМТ обнаружено округлое анэхогенное образование до 15 мм в диаметре, исходящее из медиального полюса левого яичника, интимно прилежащее к нему. Заключение: гипоплазия матки. Параовариальная киста слева небольших размеров под вопросом.
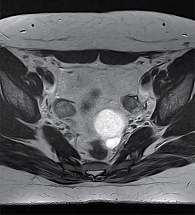
МРТ ОМТ: признаки развития матки, класс III (рис. 1). Кистозное образование левого яичника. Параректальная киста. По сравнению с предыдущим исследованием, проведенным три месяца назад, выявлены киста в левом яичнике (функциональная?), уменьшение в размерах параректальной кисты.
В стационаре выполнена кольпоэлонгация по Шерстневу с эстриолсодержащим кремом один раз в день.
В возрасте 16 лет пациентка поступила в гинекологическое отделение РДКБ повторно, планово для обследования и выбора тактики лечения.
Состояние девушки при поступлении удовлетворительное, сознание ясное. Физическое развитие среднее, дисгармоничное за счет избытка массы тела: рост – 162 см, масса тела – 87,5 кг, индекс массы тела – 33,34 кг/м2. Телосложение гиперстеническое. Кожные покровы и видимые слизистые оболочки чистые, нормальной окраски. Отеков нет. Периферические лимфатические узлы не увеличены. Над легкими ясный легочный звук, дыхание везикулярное, проводится во все отделы легких, хрипов нет. Сердечные тоны ясные, ритмичные. Печень и селезенка при пальпации не увеличены. Стул регулярный, мочеиспускание свободное, безболезненное.
Гинекологический осмотр: наружные половые органы сформированы правильно, клитор не увеличен, гимен бахромчатый, вход во влагалище по зонду – 2 см, секреторная функция: выделений нет. Формула полового развития: Ах3 Ма3 Pb3 Мe0.
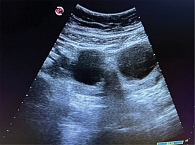
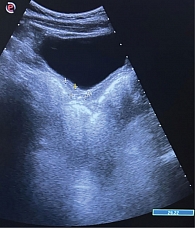
УЗИ ОМТ при поступлении: матка в типичном месте не визуализируется, М-эхо не визуализируется. В малом тазу в проекции правого яичника кистозное образование размером 55 × 32 × 39 мм, тонкостенное, аваскулярное. Левый яичник – 48 × 41 × 43 мм, визуализируется образование сетчатой структуры 39 × 37 мм (желтое тело). Свободная жидкость в малом тазу не выявлена. Заключение: аплазия матки. Двусторонние образования яичников. Ретенционные кисты под вопросом (рис. 2 и 3). Рекомендован контроль УЗИ ОМТ через 4–6 недель.
При стандартном лабораторном обследовании (клинический анализ крови, биохимический анализ крови, общий анализ крови) отклонений не выявлено. Анализ отделяемого из мочеполовых органов показал умеренное количество зрелого поверхностного эпителия, лейкоциты – 0–1 в поле зрения и большое количество мелкой палочковой микрофлоры. Показатели гормонального профиля (ТТГ, ЛГ, ФСГ, эстрадиол, пролактин) не выходят за пределы референсных значений.
Клинический пример 2
Пациентка Т., 16 лет, в связи с жалобами на периодические боли в животе поступила в гинекологическое отделение РДКБ.
Из анамнеза: ребенок от второй беременности, вторых родов, течение беременности благоприятное. Асфиксии новорожденных, физиологической желтухи не было. Наследственный анамнез: гипотиреоз у матери, сахарный диабет 2-го типа, рак молочной железы у бабушки по линии отца. Период адаптации благоприятный, раннее физическое развитие в соответствии с возрастом. Перенесенные операции: паховое грыжесечение слева в 2013 г. Состоит на учете у врачей-специалистов по месту жительства: нефролога (викарная гипертрофия левой почки, мультифолликулярная киста правой почки); эндокринолога (нетоксический одноузловой зоб); гинеколога, невролога (нервный тик).
В 13 лет на приеме у врача акушера-гинеколога впервые выявлена аплазия влагалища, проведена MPТ ОМТ, заключение: MP-признаки аплазии матки, шейки матки, проксимальной части влагалища, отсутствие визуализации правого яичника. Кариотип 46 ХХ. Трижды проходила стационарное лечение, выполнена кольпоэлонгация по Шерстневу.
С 11-летнего возраста наблюдается у эндокринолога: неоднородная консистенция щитовидной железы при пальпации, рекомендовано рациональное питание и препараты йода курсами. После проведенного лечения – эутиреоз по данным лабораторной диагностики.
В возрасте 13 лет обследовалась по поводу избыточной прибавки веса. УЗИ органов брюшной полости: диффузные изменения поджелудочной железы. УЗИ щитовидной железы: в правой доле образование неоднородной кистозно-солидной структуры с ровным четким, контуром размером до 13,3 × 9,5 мм со смешанным типом кровотока при цветовом допплеровском картировании (ЦДК), TI-RADS 3. Гормональный профиль: TТГ – 0,252 мкМЕ/мл, Т4 cвободный – 8,49 пмоль/л, антитела (АТ) к тиреопероксидазе (ТПО) отрицательные, кальцитонин – 1 пг/ил, инсулин – 40 мкЕд/мл. Через пять месяцев впервые обследована на базе НМИЦ эндокринологии.
УЗИ щитовидной железы: общий объем – 8,6 см3. Правая доля: узловое образование изоэхогенное с жидкостными включениями до 16 × 11 × 13 мм, фокальные изменения обеих долей TI-RADS 3.
Гормональный профиль: эутиреоз, АТ к ТПО н ТГ отрицательные, кальцитонин < l,0 МЕ/мЛ. По данным пункционной биопсии – Bethesda II.
Обследование в возрасте 15 лет: ТТГ – 0,4 мкМЕ/мл, Т4 свободный – 11,29 пмоль/л – эутиреоз, АТ к ТПО отсутствуют. ЛГ – 4,28 МЕ/л, ФСГ – 5,31 МЕ/л, пролактин – 246 мМе/л, эстрадиол – 98 пмол/л, тестостерон – 1,8 нмоль/л, дегидроэпиандростеронсульфат – 5,391 мкмоль/л, иммунорегуляторный индекс – 14,8 мЕд/л.
УЗИ щитовидной железы: объем – 9,4 мл3. В правой доле определяется образование размером 16,6 × 12,3 × 11 мм с четкими, ровными контурами, кистозно-солидной структуры, смешанной эхогенности с внутренним кровотоком при ЦДК. Лимфоузлы не изменены.
Была консультирована эндокринологом, заключение: правосторонний узловой зоб, фокальные изменения, эутиреоз. СМРКХ. Проведена пункционная биопсия узла щитовидной железы под контролем УЗИ, заключение цитологического исследования: доброкачественное образование щитовидной железы в соответствии с критериями системы классификации Bethesda – диагностическая категория II.
Поступила в хирургическое гинекологическое отделение РДКБ для проведения кольпоэлонгации по Шерстневу с основным диагнозом: СМРКХ; сопутствующее заболевание: нетоксический одноузловой зоб. Проведено УЗИ щитовидной железы с дуплексным исследованием сосудов, заключение: эхо-признаки узлового образования в проекции правой доли щитовидной железы. Рекомендована консультация онколога.
УЗИ ОМТ: матка в типичном месте не определяется. Правый яичник четко не визуализируется в связи с переполнением кишечника. Левый яичник – 31 × 19 × 26 мм с гиперэхогенным включением диаметром 7 мм. Свободная жидкость в малом тазу не выявлена. Заключение: аплазия матки. Гиперэхогенное включение в левом яичнике. Контроль УЗИ через 4–6 недель.
В возрасте 16 лет была госпитализирована в отделение гинекологии повторно в плановом порядке для обследования и лечения.
Состояние при поступлении удовлетворительное, сознание ясное. Физическое развитие среднее, дисгармоничное за счет избытка массы тела: рост – 167 см, масса тела – 84,5 кг, индекс массы тела – 30,3 кг/м2. Телосложение гиперстеническое. Кожные покровы и видимые слизистые оболочки чистые, нормальной окраски. Отеков нет. Периферические лимфатические узлы не увеличены. Над легкими ясный легочный звук, дыхание везикулярное, проводится во все отделы легких, хрипов нет. Сердечные тоны ясные, ритмичные. Печень и селезенка при пальпации не увеличены. Стул регулярный, мочеиспускание свободное, безболезненное.
Гинекологический осмотр: наружные половые органы сформированы правильно, клитор не увеличен, гимен бахромчатый, вход во влагалище не визуализируется. Двуручное исследование: матка в виде тяжа. Придатки с обеих сторон не определяются, область их безболезненна. Формула полового развития: Ах3 Ма3 Pb3 Мe0.
УЗИ ОМТ при поступлении: эхо-признаки аплазии матки. УЗИ молочной железы: патологии не выявлено.
В гормональном профиле отмечены повышенные значения тестостерона (2,49 нмоль/л), инсулина (36,53 мЕд/л) и 17-ОН прогестерона (5,22 нмоль/л).
Обсуждение
Представленные клинические случаи служат примером врожденной аномалии развития женской половой системы, в основе которой лежит агенезия мюллеровых протоков. Данная патология требует широкого диагностического поиска, поскольку в ряде случаев может сопровождаться другими гинекологическими и экстрагенитальными заболеваниями и врожденными пороками развития, требующими коррекции в раннем возрасте [12].
Для диагностики СМРКХ проводят гинекологический осмотр, общие клинические анализы, гормональный профиль, УЗИ, МРТ малого таза. В некоторых случаях показано выполнение урографии вследствие наличия дефектов мочевыводящих путей. Заболевание может быть подтверждено результатами кариотипирования.
На УЗ-картине при СМРКХ матка представлена в виде мышечного тяжа, при этом у 40% пациенток определяется эндометрий [8]. УЗИ проводится в зависимости от состояния с использованием трансвагинального, трансабдоминального, трансректального и, по данным иностранной литературы, трансперинеального доступа [9].
Лечение
Методы лечения подразделяются на консервативный (кольпоэлонгация) и оперативный (формирование влагалища с аутотрансплантацией тканей из тазовой брюшины, кожи вульвы и промежности, отрезка кишки или с использованием синтетических (аллопластических) материалов. Хирургические методы подразделяются на тяговые и трансплантационные. Эффективность хирургического лечения достигает 80–90%, что не превышает показатель эффективности нехирургического [4]. Поскольку СМРКХ является фактором абсолютного маточного бесплодия, назрела необходимость в разработке такого метода лечения, как трансплантация матки [12].
Согласно рекомендациям Американского колледжа акушерства и гинекологии, при выборе тактики лечения следует отдавать предпочтение нехирургическим методам [13]. Консервативный кольпопоэз проводится с помощью кольпоэлонгатора с использованием кремов со смягчающим, регенерирующим и противовоспалительным действием, которые наносятся на область влагалищной ямки один раз в сутки в течение 20 минут под контролем болевых ощущений. В дальнейшем в отсутствие выраженных болевых ощущений кольпоэлонгация выполняется два раза в сутки в течение 30–40 минут. Курс кольпоэлонгации включает 15–20 процедур. Для достижения глубины неовлагалища 10–12 см требуется от одного до трех курсов (прямая корреляция с выраженностью дисплазии соединительной ткани) с перерывом два-три месяца. Между курсами рекомендуется ежедневно обрабатывать зоны задней спайки малых половых губ и кожи сформированного неовлагалища кремом с эстриолом [4, 12].
Американский конгресс акушеров и гинекологов рекомендует реконструктивные хирургические методы лечения тем пациенткам, для которых неоперативный кольпопоэз оказался неэффективным в силу анатомических особенностей. Хирургическое создание влагалища или его коррекцию целесообразно предлагать психологически готовым к процедуре пациенткам, уже предпринявшим попытку полового акта или заявившим о готовности к нему [4, 12, 13]. Хирургический кольпопоэз включает в себя следующие методы: сигмоидальный, брюшинный с лапароскопической ассистенцией, хирургическая кольпоэлонгация с помощью механических тяговых устройств (методика Викьетти) и др. [4].
Сигмоидальный кольпопоэз резецированным отрезком сигмовидной кишки используется редко ввиду большого количества осложнений как во время операции, так и в раннем и позднем постоперационных периодах [4].
Одним из самых популярных видов хирургического вмешательства является лапароскопическая вагинопластика Викьетти, впервые описанная в 1965 г. Этот метод основан на прогрессивной пассивной тяге через наружную стенку таза на ретрогименальную ямку с использованием акрилового оливообразного шаблона, к которому прикрепляются две монофиламентные нити, введенные через преддверие влагалища в брюшную полость под контролем лапароскопии. Этот метод позволяет сохранить естественную ткань влагалища и избежать осложнений, таких как стеноз и чрезмерное образование слизи. По сравнению с другими хирургическими вмешательствами процедура Викьетти менее продолжительна [13].
Другой тип хирургии основан на создании неовагинального пространства между прямой кишкой и мочевым пузырем за счет трансплантата. Техника по McIndoe выполняется промежностным доступом: между уретрой и прямой кишкой создают полость и используют кожный трансплантат, обычно получаемый из области ягодиц. Предложены модификации McIndoe с различными типами трансплантатов, например с расщепленными кожными лоскутами и полнослойными кожными трансплантатами, амнионом, аутологичной тканью влагалища, культивированной in vitro, и искусственными трансплантатами [13].
Не следует забывать, что при лечении СМРКХ психологическая поддержка и психотерапия должны быть доступны как самой пациентке, так и ее семье. Обучение пациенток обязательно, поскольку и заболевание, и его лечение влияют на многие аспекты их жизни [12].
Бесплодие также является значимой проблемой. У пациенток с СМРКХ правильно функционируют яичники и гипоталамо-гипофизарно-яичниковая ось. Таким образом, с гормональной и физиологической точки зрения эти женщины способны к воспроизводству и могут иметь генетическое потомство, но не могут родить самостоятельно. Вариантом для таких пациенток является усыновление или суррогатное материнство, однако последнее время активно изучается возможность трансплантации матки [12].
Первые попытки трансплантации матки были описаны в 2013 г. в Турции, но прогрессирующий некроз матки в первые месяцы после трансплантации привел к ее удалению через три месяца.
Первая успешная трансплантация матки была описана в Швеции в 2014 г. Реципиентом стала 21-летняя пациентка с атипичной формой СМРКХ (агенезия почки). Донор – 61-летняя женщина с двумя естественными родами в анамнезе на 41-й неделе гестации. После трансплантации провели индукцию овуляции рекомбинантным хориогонадотропином человека. Под контролем УЗИ выполнены забор и оплодотворение яйцеклеток. Перенос одного эмбриона осуществился через год после трансплантации матки в естественном цикле. В сентябре 2014 г. на свет появился первый ребенок, рожденный после трансплантации матки путем экстракорпорального оплодотворения [14].
Трансплантация матки заключается в ее удалении вместе с сосудистыми пучками у донора и трансплантации в заранее подготовленную соответствующую анатомическую область реципиента. Перед процедурой пациентка получает соответствующую иммуносупрессивную терапию. Первая менструация у пациентки после трансплантации возникла через 43 дня и продолжалась четыре дня. Длительность менструального цикла составила 26–36 дней. М-эхо при УЗИ – 7,9–15,3 мм. При повторных УЗИ кровотока в маточных артериях нарушений не выявлено. До переноса эмбриона у пациентки наблюдалось три эпизода доброкачественного отторжения трансплантата, которые были успешно предотвращены за счет применения соответствующих доз глюкокортикостероидов [12, 14]. Данный случай продемонстрировал возможность лечения абсолютного маточного бесплодия (AUFI).
Заключение
Для лечения пациенток с СМРКХ необходим междисциплинарный подход. Использование приемлемых классификаций пороков развития половой системы, новых подходов к диагностике и лечению СМРКХ, изучение принципов его наследования и развития имеют решающее значение для грамотного ведения пациенток с данным пороком [4].
За последние годы разработано множество методов лечения больных с СМРКХ, однако единого алгоритма терапии не существует [13]. Данные современных научных исследований в совокупности с междисциплинарным подходом помогают расширить спектр имеющихся знаний и улучшить качество жизни пациенток в будущем.
Последнее десятилетие ознаменовалось достижением успехов в изучении СМРКХ, особенно в области генетики, нехирургического лечения и трансплантации матки как первого доступного метода лечения маточного фактора бесплодия. Это позволяет лучше понять этиологию, совершенствовать диагностику и лечение заболевания [1].
Конфликт интересов. Авторы заявляют об отсутствии конфликтов интересов.
Финансирование. Работа выполнена без спонсорской поддержки.
Ye.V. Sibirskaya, PhD, Prof., I.V. Karachentsova, PhD, P.O. Nikiforova, I.A. Melenchuk, A.S. Annakulieva, A.A. Kovaleva
Russian Children’s Clinical Hospital – a Branch of N.I. Pirogov Russian National Research Medical University
N.I. Pirogov Russian National Research Medical University
Russian University of Medicine
Contact person: Polina O. Nikiforova, pol_nikiforova@mail.ru
A systematic search and analysis of scientific publications was conducted using the PubMed, Embase, Cochrane Library and Google Scholar databases. The main attention is paid to studies related to the prevalence, diagnostic methods, clinical manifestations and approaches to the treatment of Mayer – Rokitansky – Küster – Hauser (MRKH) syndrome (aplasia of the uterus and vagina).
The article represents case series reports of MRKN syndrome, which presents etiological factors, various manifestations, demonstrates the importance of timely diagnosiы and an individual approach to treatment, remembering about the possibility of concomitant gynecological and extragenital pathologies.
We discuss the current researches and perspectives of further studying of MRKH syndrome such as genetic factors, non-surgical treatment – bloodless colpoiesis, absolute uterine infertility treatment by uterine transplantation, which allows timely verification of the syndrome and development of clinical care achieving a favorable result in the long term.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.