Эутиреоидный гигантский зоб у пациентки с нарушением ритма и проводимости сердца
- Аннотация
- Статья
- Ссылки
- English

Введение
Фибрилляция предсердий (ФП) – одна из наиболее часто встречающихся патологий сердечно-сосудистой системы (ССС). Так, в 2010 г. в мире насчитывалось более 20,9 млн пациентов с ФП. К 2030 г. только в Европейском союзе прогнозируется от 14 до 17 млн больных. Ежегодный прирост будет составлять от 120 тыс. до 215 тыс. случаев. Распространенность ФП в общей популяции может достичь 2%, среди лиц старше 60 лет – 6% [1]. В России на долю ФП приходится более 40% всех нарушений ритма сердца [2].
Среди основных причин патологии выделяют артериальную гипертензию (АГ), ишемическую болезнь сердца (ИБС) и заболевания щитовидной железы (ЩЖ).
Из патологий ЩЖ на первом месте стоит болезнь Грейвса (БГ), или Базедова болезнь: описана в 1835 г. Р.Дж. Грейвсом (Ирландия), в 1840 г. К.А. фон Базедовым (Германия) (мерзебургская триада включает экзофтальм, тахикардию, зоб). В настоящее время классическая мерзебургская триада встречается крайне редко.
У женщин заболевание отмечается в 10–20 раз чаще, чем у мужчин [3]. Такая статистика связана с особенностями женского организма, который больше подвержен гормональным колебаниям (менструации, беременность и климакс). Как правило, патология диагностируется при обращении за медицинской помощью по поводу нарушений сердечного ритма (тахикардии, ФП) [3].
В настоящее время развитие БГ связывают с гиперпродукцией тиреоидстимулирующих антител, специфичных к рецептору тиреотропного гормона (ТТГ), что приводит к увеличению железы, избыточной продукции тиреоидных гормонов (ТГ) и тиреотоксикозу (ТТ).
К патологиям ССС, сопровождающим ТТ, относятся систолическая АГ, суправентрикулярная аритмия, ФП, увеличение массы левого желудочка, нарушение диастолического наполнения, снижение толерантности к физическим нагрузкам с последующим исходом в кардиосклероз, дилатацию полостей сердца и развитием хронической сердечной недостаточности (ХСН) [4]. При избытке тиреоидных гормонов увеличивается количество бета-адренорецепторов в миокарде. Преимущественно предсердные, а не желудочковые нарушения ритма сердца при ТТ объясняются высокой чувствительностью предсердий к аритмогенному действию ТГ. Возможно, это связано с более высокой плотностью бета-адренорецепторов кардиомиоцитов, а также с различной автономной иннервацией предсердий и желудочков [4].
Анализ данных Датского национального регистра показал, что из 40 628 пациентов с ТТ 8,3% имели ФП. Кроме того, выявлена зависимость частоты развития патологии от вида циркулирующего гормона. Так, у 36% обследованных с ФП был увеличен уровень трийодтиронина (Т3), у 13% – тироксина (Т4), у 21% – обоих гормонов [5]. H.K. Nakazawa и соавт. установили, что у 62% из 163 пациентов с тиреотоксической ФП после достижения стойкого эутиреоза спонтанно восстановился синусовый ритм [6]. В большинстве работ показано, что шансы на восстановление синусового ритма снижаются у пожилых пациентов с сопутствующей органической патологией миокарда или ФП более четырех месяцев [7].
V. Fatourechi и соавт. [8], изучавшие связь между аутоиммунной природой БГ и активным аутоиммунным воспалительным процессом, являющимся причиной развития миокардита, получили противоположные результаты. Так, при проведении биопсии миокарда правого желудочка у пациентов с БГ лимфоидная инфильтрация ткани, характерная для миокардита, обнаружена лишь у 18% обследованных.
Распространенность пролапса митрального клапана (МК) при ТТ составляет 18–41%, тогда как в общей популяции – 6–20% [9]. При БГ возможны два механизма поражения клапанного аппарата сердца. Первый – в эндокарде увеличивается продукция гликозаминогликанов (так же, как в ретробульбарном пространстве при эндокринной офтальмопатии), что ведет к утолщению створок митрального клапана. Второй механизм – при ТТ снижается тонус папиллярных мышц сердца, что приводит к пролабированию створок МК в полость левого предсердия (ЛП) во время систолы желудочков [9].
Еще одна патология ЩЖ, ассоциированная с развитием ФП, – гипотиреоз. Данный клинический синдром обусловлен стойким снижением действия тиреоидных гормонов на ткани-мишени. Вследствие этого в миокарде развиваются такие нарушения, как фиброз, выпот в перикард, артериосклероз.
Очень часто первичный гипотиреоз является исходом хронического аутоиммунного тиреоидита (АИТ), или тиреоидита Хашимото (описан в 1912 г.). Для АИТ, протекающего в рамках гипотиреоза, характерны синусовая брадикардия или чередование брадикардии с пароксизмами тахисистолической формы ФП и/или трепетанием предсердий (ТП), что нередко ошибочно принимают за синдром слабости синусового узла при ИБС.
A.D. Marks и соавт. [10], изучавшие распространенность пролапса МК у пациентов с тиреоидитом Хашимото и в здоровой популяции, в основной группе диагностировали патологию в 41% случаев, в контрольной – в 8%.
Развивающийся при АИТ гипотиреоз удлиняет потенциал действия и интервал QT, что в свою очередь предрасполагает к желудочковым нарушениям ритма [11].
В пожилом возрасте гипотиреоз нередко сочетается с ИБС.
При гипотиреозе нарушается обмен гомоцистеина – продукта деметилирования метионина, что считается самостоятельным фактором риска развития атеросклероза [11]. К другим факторам риска относятся нарушение липидного обмена, в частности общего холестерина (ОХС) и липопротеинов низкой плотности (ЛПНП), гиперкоагуляция, диастолическая гипертензия, диастолическая дисфункция левого желудочка [12].
Исследование 1149 пожилых женщин в Нидерландах показало, что у пациенток с субклиническим гипотиреозом увеличиваются риск развития острого инфаркта миокарда и частота кальциноза аорты [13].
Разбор клинического случая
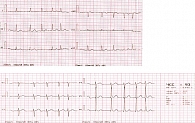
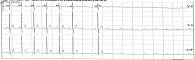
В кардиологическое отделение городской клинической больницы № 4 (ГКБ № 4) поступила пациентка У. 77 лет с пароксизмом ФП (рис. 1).
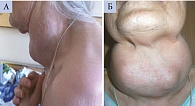
При осмотре обращал на себя внимание гигантский зоб (рис. 2), выявленный 55 лет назад. Она жаловалась на боль при глотании твердой пищи и постоянное ощущение сдавливания горла с нехваткой воздуха, особенно в горизонтальном положении, так как зоб сдавливал трахею и пищевод и мешал их нормальному функционированию.
Впервые зоб диагностирован в 22 года. Одним из факторов его развития мог быть йододефицит.
Йодный дефицит - наиболее частая причина увеличения ЩЖ. Зоб, выявляемый в регионах с дефицитом йода, получил название эндемический, в регионах с нормальным его потреблением – спорадический. В условиях йодного дефицита ЩЖ постоянно находится в состоянии гиперстимуляции, поскольку должна обеспечивать организм ТГ при недостаточном поступлении необходимого субстрата для их синтеза извне. Хроническая гиперстимуляция ЩЖ становится причиной функциональной автономии.
Вследствие гипертрофии тиреоцитов происходит диффузное увеличение ЩЖ – диффузный эутиреоидный зоб. Тиреоциты обладают разным пролиферативным потенциалом. Часть из них делится более активно, в результате формируются узловые образования. В таком случае принято говорить о многоузловом эутиреоидном зобе [14].
Пациентам назначают препараты йода в физиологических дозах (100–200 мкг/сут). Если в течение шести месяцев объем ЩЖ не уменьшается, обсуждается возможность проведения супрессивной терапии препаратами левотироксина (L-Т4).
Пациентка родилась в Ленинграде, в 20 лет переехала на постоянное место жительства в Самару. Результаты исследований йододефицита, проведенных в Санкт-Петербурге, свидетельствуют о недостаточности йода легкой степени [15]. В Самарской области по результатам мониторинга с 1999 по 2008 г. (119 275 измерений) ряд муниципальных районов и городских округов признаны территориями с тяжелым йододефицитом, а именно городской округ Жигулевск, Исаклинский и Сызранский районы [16]. В одном из них и проживала пациентка.
Недостаточное потребление йода отмечается у 100 млн россиян, в том числе у 32,8 млн детей, что представляет серьезную угрозу для их физического и умственного развития. Сложившаяся ситуация требует систематической профилактики йододефицита [17].
После выявления зоба, со слов пациентки, ей назначались препараты йода и другие лекарства (названия не помнит), которые она принимала, проживая в Самарской области. Однако ЩЖ постепенно увеличивалась в объеме. От предлагаемого оперативного лечения больная отказывалась, несмотря на затруднение при глотании твердой пищи, чувство нехватки воздуха, особенно в горизонтальном положении. Контроль состояния ограничивался ежегодным исследованием уровня гормонов крови и ультразвуковым исследованием ЩЖ.
Артериальная гипертензия – более 15 лет. Проводились нерегулярное измерение артериального давления (АД) и прием лозапа 25 мг в зависимости от самочувствия. На прием ингибиторов ангиотензинпревращающего фермента появлялся сухой кашель. Максимальные значения АД – 170/90 мм рт. ст., адаптирована к цифрам АД 120/70 мм рт. ст.
Пароксизмальная форма ФП впервые диагностирована около 10 лет назад. Антиаритмических препаратов пациентка не принимала, пароксизмы ФП фиксировались один раз в год. За последний год частота приступов ФП возросла – до двух – трех раз в месяц. Кроме того, пароксизмы ФП стали сопровождаться резкой общей слабостью и головокружением, по поводу чего неоднократно вызывалась бригада скорой медицинской помощи. Пароксизмы ФП купировались через один – три часа после внутривенного введения амиодарона. Во время последнего пароксизма ФП бригадой скорой медицинской помощи внутривенно капельно было введено 300 мг амиодарона.
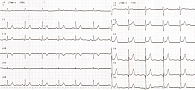
Из-за отсутствия эффекта пациентка была госпитализирована в ГКБ № 4. В приемном отделении на электрокардиограмме (ЭКГ) зарегистрирован синусовый ритм сердца, который восстановился через два часа после введения амиодарона бригадой скорой медицинской помощи (рис. 3).
Учитывая, что действие амиодарона начинается через 12–18 часов, можно сделать вывод, что у пациентки имело место спонтанное восстановление синусового ритма.
За четыре месяца до госпитализации в ГКБ № 4 пациентка уже находилась на стационарном лечении по поводу пароксизма ФП. В выписном эпикризе рекомендован комбинированный прием антиаритмических препаратов – аллапинина 25 мг перед сном (пациентка отмечала пароксизмы ФП преимущественно в ночные и утренние часы) и соталола 40 мг два раза в день (с учетом старческого возраста).
Повышение эффективности антиаритмической терапии ФП без снижения ее безопасности возможно при сочетании препаратов IС и III классов (аллапинин и соталол соответственно). Антиаритмические средства IС класса преимущественно расширяют комплекс QRS, III класса – удлиняют интервал QT. Поэтому не происходит избыточного, опасного в отношении желудочковой проаритмии увеличения каждого из этих параметров на ЭКГ. Исходно повышенные симпатические и/или парасимпатические воздействия на сердце – триггеры ФП ограничиваются [18].
Однако больная принимала только соталол – 40 мг утром.
Период полувыведения соталола составляет 10–20 часов, что объясняет пароксизмы ФП в вечерние и ночные часы в течение последнего года.
Лабораторные показатели не выходили за пределы референсных значений: гемоглобин – 121 г/л, лейкоциты – 4,49 × 109/л, скорость оседания эритроцитов (СОЭ) – 10 мм/ч, эритроциты – 4,26 × 1012/л, тромбоциты – 138 × 109/л, ОХС – 3,97 ммоль/л, ЛПНП – 2,1 ммоль/л, липопротеины высокой плотности (ЛПВП) – 1,6 ммоль/л, креатинин – 69 мкмоль/л, скорость клубочковой фильтрации (СКФ (CKD-EPI)) – 86 мл/мин/1,73м2, калий – 4,6 ммоль/л, общий белок – 66,8 г/л, мочевина – 6,2 ммоль/л, глюкоза – 5,3 ммоль/л, аспартатаминотрансфераза (АСТ) – 25 ЕД/л, аланинаминотрансфераза (АЛТ) – 12 ЕД/л, лактатдегидрогеназа (ЛДГ) – 148 ЕД/л.
Ультразвуковое исследование органов брюшной полости: патологии не выявлено. Эзофагогастродуоденоскопия: очаговый антрум-гастрит на фоне атрофии.
Эхокардиография: размер ЛП – до 3,5 см (норма 2,0–4,0 см), конечный диастолический размер (КДР) – 5,2 см (норма 3,7–5,7 см), конечный систолический размер (КСР) – 3,0 см (норма 2,3–3,7 см), фракция выброса (ФВ) – 60%, толщина межжелудочковой перегородки (ТМЖП) – 1,1 см (норма 0,6–1,1 см), толщина задней стенки левого желудочка (ТЗСЛЖ) – 0,9 см (норма 0,6–1,1 см). Митральный клапан уплотнен, противофаза есть. Пролапс МК второй степени, митральная регургитация второй и третьей степени, трикуспидальный клапан – регургитация первой степени, аортальный клапан – регургитация первой степени.
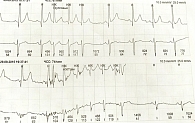
Суточное мониторирование ЭКГ (рис. 4) на фоне приема соталола 40 мг два раза в день и аллапинина 25 мг три раза в день: регистрировался синусовый ритм с минимальной частотой сердечных сокращений (ЧСС) 45 в минуту и максимальной – 88 в минуту, средняя ЧСС – 57 в минуту. Пауз более двух секунд не выявлено. Зарегистрированы восемь единичных мономорфных желудочковых экстрасистол, два коротких пароксизма ФП, которые самостоятельно купировались, 100 наджелудочковых экстрасистол. Динамики сегмента ST не выявлено.
Согласно рекомендациям Российского кардиологического общества за 2017 г. имеет место пароксизмальная форма ФП [1].
Ультразвуковое исследование ЩЖ: объем – 553,1 см3 (норма у женщин до 18 см3), региональный кровоток при цветовом допплеровском картировании (ЦДК) в долях резко усилен.
Учитывая участившиеся случаи пароксизмов ФП, усиление регионального кровотока при ЦДК ЩЖ, высказано предположение о наличии диффузного токсического зоба.
Выполнен анализ гормонов ЩЖ: ТТГ – 1,03 мМЕ/мл (норма 0,35–5,5 мМЕ/мл), свободного Т4 – 2,41 нг/дл (норма 0,89–1,76 нг/дл), свободного Т3 – 1,3 пг/мл (норма 2,3–4,2 пг/мл), анти-ТГ – 0,79 МЕ/мл (норма 0–51 МЕ/мл), антитела к тиреоидной пероксидазе (анти-ТПО) – 1,93 МЕ/мл (норма 0–60 МЕ/мл), тиреоглобулин – 1000 нг/мл (норма 0–78 нг/мл).
Результаты анализа свидетельствуют об эутиреозе и позволяют исключить гиперфункцию ЩЖ. Сделан вывод о наличии эутиреоидного зоба второй степени эндемического генеза.
Коронароангиография: гемодинамически значимых стенозов коронарных артерий не выявлено.
По эффективности в профилактике рецидивов ФП амиодарон превосходит пропафенон и соталол и может быть использован у больных с частыми ФП, возникающими несмотря на терапию другими антиаритмическими препаратами. В клинических рекомендациях в целях контроля ритма сердца при ФП указывается на нецелесообразность применения амиодарона у пациентов с сопутствующей тиреоидной патологией [1] – в одной таблетке (200 мг) содержится 74 мг йода. При метаболизме препарата из каждой таблетки высвобождается от 6 до 9 мг йода, что многократно превышает суточную потребность < 150 мкг. В связи с этим амиодарон может оказывать различные эффекты на функцию ЩЖ: с одной стороны, блокировать органификацию йода, что нарушает синтез ТГ (эффект Вольфа – Чайкова) и приводит к развитию гипотиреоза, с другой – стать причиной развития ТТ вследствие специфического тиреоидита, вызванного деструктивными процессами в ЩЖ, либо феномена «йод-Базедов» вследствие йод-индуцированной стимуляции синтеза и секреции ТГ. При этом общая частота развития гипотиреоза и ТТ при применении амиодарона у лиц с сопутствующей тиреоидной патологией составляет 49%, а у лиц без сопутствующей патологии ЩЖ – 25% [14]. Амиодарон уменьшает конверсию Т4 в Т3 в периферических тканях, у трети пациентов это сочетается с повышением уровня общего Т4 и свободного Т4 из-за уменьшения их клиренса (эутиреоидная гипертироксинемия). По другим данным, частота ТТ при лечении амиодароном достигает 10%, гипотиреоза – 20% [14]. Именно поэтому для долгосрочного поддержания синусового ритма и профилактики рецидивов ФП у больных с патологией ЩЖ рекомендован прием дронедарона, флекаинида, пропафенона или соталола [1]. Данные препараты показаны для профилактики рецидивирующей симптоматической формы ФП у пациентов с нормальной функцией ЛЖ и без патологической гипертрофии ЛЖ (IА).
Выбор терапии ФП у пациентки У. был ограничен препаратом III класса соталолом и 1С класса аллапинином.
При суточном мониторировании ЭКГ на фоне приема соталола 40 мг два раза в день и аллапинина 25 мг три раза в день зафиксировано два коротких пароксизма ФП. Таким образом, применение этих антиаритмических препаратов оказалось неэффективным. Увеличение дозы соталола было невозможно без имплантации двухкамерного электрокардиостимулятора (ЭКС) [19].
От имплантации ЭКС больная категорически отказалась.
Согласно клиническим рекомендациям [1] по лечению пациентов с ФП и активным заболеванием ЩЖ им требуется антитромботическая терапия с учетом шкалы CHA2DS2-VASc (IА). Шкала CHA2DS2-VASc учитывает наличие ХСН, АГ, сахарного диабета, сосудистых поражений, возраст и пол.
Согласно показателям шкалы CHA2DS2-VASc у больной риск инсульта составлял три балла. Это определяет необходимость назначения антикоагулянта (варфарина под строгим контролем международного нормализованного отношения (МНО) или одного из новых пероральных антикоагулянтов (НОАК)).
Пациентка была выписана из стационара на амбулаторное наблюдение. Она отказалась контролировать МНО в поликлинике или на дому. Назначено лечение: метопролола сукцинат (беталок ЗОК) 25 мг два раза в день, лозартан 25 мг один раз в день, ривароксабан (ксарелто) 20 мг один раз в день, так как СКФ (CKD-EPI) при выписке – 86 мл/мин/1,73м2. Выбор ривароксабана (ксарелто), а не дабигатрана и апиксабана обусловлен негативным отношением больной к приему лекарств: первый принимается один раз в день, два других – два раза в день.
После выписки из больницы пациентка в поликлинику не обратилась, врача на дом не вызвала.
Рекомендованную терапию больная принимала в течение полутора – двух месяцев и чувствовала себя удовлетворительно, поэтому сократила прием рекомендованных в стационаре препаратов. АД и пульс контролировала один-два раза в неделю по самочувствию.
Вновь возобновились приступы ФП, сопровождавшиеся перебоями в работе сердца, головокружениями и резкой слабостью. Скорая медицинская помощь оказывалась три-четыре раза в месяц, преимущественно в ночные часы. Для купирования пароксизмов ФП внутривенно вводился амиодарон. От предлагаемой госпитализации пациентка категорически отказывалась.
Для предупреждения приступов ФП самостоятельно начала принимать амиодарон 100 мг/сут четыре-пять раз в неделю. На фоне приема амиодарона больная перестала ощущать перебои в работе сердца, однако отметила, что при смене положения тела появляется головокружение с нарушением ориентации и падениями.
Через шесть месяцев после выписки из стационара пациентка обратилась в поликлинику по месту жительства, повод – ухудшение общего самочувствия в течение последних двух месяцев.
Во время осмотра кардиологом в поликлинике пульс – 42–54 удара в минуту, неритмичный, АД – 125/75 мм рт. ст., на ЭКГ зафиксирована ФП с ЧСС 43–57 в минуту. Риск развития инсульта, системной эмболии по шкале CHA2DS2-VASc составил три балла, индекс оценки выраженности симптомов ФП (EHRA – European Heart Rhythm Association) – два.
Поскольку больная отказалась от стационарного лечения, схема терапии была изменена. Отменен амиодарон, который пациентка принимала по своему усмотрению, для контроля ЧСС назначен метопролол короткого действия (эгилок) 12,5 мг два раза в день и увеличена доза аллапинина до 25 мг три раза в день. Рекомендовано продолжить прием лозартана 25 мг один раз в день, так как АД – 125/75 мм рт. ст., ривароксабана (ксарелто) 20 мг один раз в день, поскольку риск инсульта равен трем баллам, кровоточивости на принимаемой дозе препарата не зафиксировано.
Выполнены обследования: биохимический анализ крови с липидограммой, эхокардиография, суточное мониторирование ЭКГ, анализ гормонов ЩЖ. Рекомендован контроль цифр АД и пульса в домашних условиях.
Анализ гормонов ЩЖ: ТТГ – 1,87 мМЕ/мл, свободный Т4 – 2,12 нг/дл, свободный Т3 – 1,1 пг/мл, ОХС – 4,0 ммоль/л, ЛПНП – 2,4 ммоль/л, ЛПВП – 1,4 ммоль/л.
Эхокардиография: размер ЛП – 3,6 см, КДР – 5,1 см, КСР – 2,9 см, ФВ – 58%, ТМЖП – 1,0 см, ТЗСЛЖ – 0,9 см. Митральный клапан уплотнен, противофаза есть. Пролапс МК второй степени, митральная регургитация второй и третьей степени, трикуспидальный клапан – регургитация первой степени, аортальный клапан – регургитация первой степени.
При суточном мониторировании ЭКГ зарегистрирована синусовая брадиаритмия с минимальной ЧСС 23 в минуту в ночные часы, максимальная ЧСС – 62 в минуту при физической нагрузке, средняя – 43 в минуту. На фоне синусового ритма зафиксированы эпизоды атриовентрикулярной блокады второй степени второго типа (Мобиц – 2) с максимальной паузой 8,36 мс (рис. 5) преимущественно в ночные часы, преходящая синоатриальная блокада второй степени второго типа (Мобиц – 2) с проведением 2:1 (рис. 6), пять эпизодов брадиформы ФП с мономорфными желудочковыми экстрасистолами (110 за сутки). Во время нарушения ритма сердца пациентка ощущала головокружение, дурноту, резкую слабость, о чем сделана соответствующая пометка в дневнике.
Учитывая данные суточного мониторирования ЭКГ, выраженную клиническую симптоматику при брадиаритмии, больная была госпитализирована для постановки двухкамерного ЭКС в режиме VTI [19].
Заключение
Пациенты с эутиреоидным гигантским зобом в клинической практике встречаются крайне редко, так как эффективно лечатся медикаментозно или оперируются на ранних сроках заболевания. Описан клинический случай нарушения сердечного ритма и проводимости у пациентки с гигантским эутиреоидным зобом старческого возраста.
Одной из причин развития ФП являются заболевания щитовидной железы. Особенностью клинической картины стало возникновение пароксизмов ФП через 45 лет от начала заболевания, 11 лет синусовый ритм восстанавливался спонтанно. В течение последних двух лет у пациентки участились пароксизмы ФП, которые клинически не всегда проявлялись, синусовый ритм восстанавливался спонтанно. При ретроспективном анализе – пароксизмы ФП были проявлением клиники синдрома слабости синусового узла с последующим развитием атриовентрикулярной и преходящей синоатриальной блокады. При появлении клинической симптоматики (при перемене положения тела головокружения с нарушением ориентации, сопровождавшиеся эпизодами падения) в поликлинике выполнено суточное мониторирование ЭКГ и выявлены эпизоды атриовентрикулярной блокады второй степени второго типа (Мобиц – 2) с максимальной паузой 8,36 мс, преимущественно в ночные часы, преходящая синоатриальная блокада второй степени второго типа (Мобиц – 2) с проведением 2:1, пять эпизодов брадиформы ФП с мономорфными желудочковыми экстрасистолами (всего 110 за сутки), что стало причиной направления данной пациентки на установку электрокардиостимулятора.
Результаты гормонального исследования ЩЖ позволили сделать заключение о наличии эутиреоидного зоба второй степени эндемического генеза. Клинически выраженный и субклинический гипертиреоз и гипотиреоз сочетаются с сердечно-сосудистыми заболеваниями, нарушениями липидного обмена. У пациентки У. 78 лет с длительным анамнезом артериальной гипертензии (более 15 лет) и пароксизмальной формы ФП (11 лет) по результатам эхокардиографии в 2015 и 2016 гг. отсутствуют увеличение полостей сердца, гипертрофия ЛЖ, кальциноз аорты, что нетипично при таком сроке ФП и АГ. Неоднократно (дважды – стационарно в 2015 г. и амбулаторно в 2016 г.) фиксировался нормальный уровень липидов крови. По данным коронароангиографии гемодинамически значимых стенозов не выявлено.
Зоб ЩЖ – патология, описанная в трактатах древнего Египта, Индии и Древней Греции. Художники Средневековья часто изображали ангелов и демонов с зобом, а Мадонну – с характерным для зоба утолщением на шее. Это явление было настолько массовым, что считалось нормой. В XVIII в. ученые-медики связывали зоб со слабоумием, что соответствует действительности. Сегодня в мире около 20 млн человек имеют умственную отсталость вследствие дефицита йода. Оценить вклад легкого йодного дефицита в распространенность пограничного снижения интеллектуального развития достаточно сложно, однако в регионах умеренного и легкого йодного дефицита индекс интеллектуального развития (IQ) детей и подростков примерно на 10% ниже, чем в регионах с нормальным потреблением йода [14]. С этой позиции можно объяснить причину неоднократных отказов больной от приема лекарственных препаратов, что привело к увеличению зоба до таких размеров, в последующем отказ от оперативного лечения ЩЖ, в настоящее время – от предлагаемых госпитализаций.
S.V. Kakorin, M.D. Kharitonova, O.V. Sabitova
City Clinical Hospital № 4, Moscow
Pirogov Russian National Research Medical University
City Policlinic № 175, Moscow
Contact person: Sergey Valentinovich Kakorin, kakorin-s@yandex.ru
Patients with giant euthyroid goiter are extremely rare in clinical practice. One of the causes of atrial fibrillation (AF) is thyroid disease. Clinically pronounced and subclinical hyperthyroidism and hypothyroidism are combined with cardiovascular diseases, lipid metabolism disorders. A clinical case of a patient of senile age with a giant euthyroid goiter is presented. At 78 years old with a long history of hypertension (15 years) and paroxysmal form of AF (11 years) according to the results of Echo-CG in 2015, 2016. There is no enlargement of the heart cavities, hypertrophy of the left ventricle, calcification of the aorta, which is not typical for such a period of AF and AH, and a normal level of blood lipids is also detected. The paroxysms of AF became 45 years after the onset of the disease and the sinus rhythm was always restored spontaneously. Last 2 years, AF was a manifestation of the syndrome of weakness of sinus node with the subsequent development of atrioventricular and transient sinoatrial blockade. The tactics of treatment are considered.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.