Частота встречаемости и структура клинически значимых небольших кровотечений на фоне приема прямых оральных антикоагулянтов у пациентов 80 лет и старше с неклапанной фибрилляцией предсердий
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. В исследовании участвовали 367 пациентов в возрасте 80 лет и старше (медиана возраста – 84 [82; 88] года, 69,5% женщин, 30,5% мужчин) с неклапанной ФП на фоне приема ПОАК. Для оценки частоты встречаемости и структуры КЗНК проспективно проведен анализ медицинской документации (амбулаторные и стационарные карты). Использовались критерии кровотечений Международного общества по тромбозу и гемостазу (International Society on Thrombosis and Haemostasis, ISTH). Период наблюдения за пациентами составил 12 месяцев.
Результаты. Наиболее часто назначаемым ПОАК для профилактики тромбоэмболических осложнений у пациентов с ФП старше 80 лет был ривароксабан – 64,9%. Апиксабан принимали 25,9%, а дабигатрана этексилат – 9,3% пациентов. Частота встречаемости КЗНК на фоне приема всех ПОАК составила 53,1% (95%-ный доверительный интервал (ДИ) 47,9–58,4). При этом статистически значимых различий в отношении развития кровотечений между ПОАК не выявлено (p = 0,173). Плотность событий составила 42,8 случая (95% ДИ 38–48,1) на 100 пациенто-лет, также без статистической значимости различий между ПОАК. По структуре кровотечений на фоне приема всех ПОАК чаще отмечались гематурия (34,7%) и кровотечения из желудочно-кишечного тракта (14,4%). Вместе с тем отмечалась тенденция к более высокой частоте развития гематурии среди пациентов, принимавших дабигатрана этексилат, – 52,9% (p = 0,057). Кроме того, нередко регистрировались гематомы без ушиба (6,6%), носовые кровотечения (4,9%), кровоизлияния в глаз (3,8%).
Вывод. У пациентов старше 80 лет с неклапанной ФП, получавших ПОАК, более чем в половине случаев выявлены развившиеся КЗНК. Небольшие кровотечения, хотя и не представляют угрозы для жизни, оказывают существенное влияние на качество жизни пациентов и могут приводить к нарушению схемы терапии или полной отмене ПОАК. Учитывая крайне высокую частоту встречаемости кровотечений подобного типа у гериатрических пациентов, врачи должны проявлять особую бдительность в отношении профилактики КЗНК.
Материал и методы. В исследовании участвовали 367 пациентов в возрасте 80 лет и старше (медиана возраста – 84 [82; 88] года, 69,5% женщин, 30,5% мужчин) с неклапанной ФП на фоне приема ПОАК. Для оценки частоты встречаемости и структуры КЗНК проспективно проведен анализ медицинской документации (амбулаторные и стационарные карты). Использовались критерии кровотечений Международного общества по тромбозу и гемостазу (International Society on Thrombosis and Haemostasis, ISTH). Период наблюдения за пациентами составил 12 месяцев.
Результаты. Наиболее часто назначаемым ПОАК для профилактики тромбоэмболических осложнений у пациентов с ФП старше 80 лет был ривароксабан – 64,9%. Апиксабан принимали 25,9%, а дабигатрана этексилат – 9,3% пациентов. Частота встречаемости КЗНК на фоне приема всех ПОАК составила 53,1% (95%-ный доверительный интервал (ДИ) 47,9–58,4). При этом статистически значимых различий в отношении развития кровотечений между ПОАК не выявлено (p = 0,173). Плотность событий составила 42,8 случая (95% ДИ 38–48,1) на 100 пациенто-лет, также без статистической значимости различий между ПОАК. По структуре кровотечений на фоне приема всех ПОАК чаще отмечались гематурия (34,7%) и кровотечения из желудочно-кишечного тракта (14,4%). Вместе с тем отмечалась тенденция к более высокой частоте развития гематурии среди пациентов, принимавших дабигатрана этексилат, – 52,9% (p = 0,057). Кроме того, нередко регистрировались гематомы без ушиба (6,6%), носовые кровотечения (4,9%), кровоизлияния в глаз (3,8%).
Вывод. У пациентов старше 80 лет с неклапанной ФП, получавших ПОАК, более чем в половине случаев выявлены развившиеся КЗНК. Небольшие кровотечения, хотя и не представляют угрозы для жизни, оказывают существенное влияние на качество жизни пациентов и могут приводить к нарушению схемы терапии или полной отмене ПОАК. Учитывая крайне высокую частоту встречаемости кровотечений подобного типа у гериатрических пациентов, врачи должны проявлять особую бдительность в отношении профилактики КЗНК.

Введение
В современном мире с каждым годом все большую актуальность приобретает проблема стремительного старения населения. При этом за последние десятилетия продолжительность жизни значительно увеличилась. На данный момент в развитых странах возрастает доля лиц старше 80 лет [1]. Для пожилых людей характерно наличие возраст-ассоциированных заболеваний, в частности фибрилляции предсердий (ФП). Распространенность ФП среди взрослого населения составляет 2–4%, причем частота встречаемости увеличивается с возрастом – от менее 0,5% в возрасте 40–50 лет до 5–15% в возрасте 80 лет [2]. На фоне ФП повышается риск развития тромбоэмболических осложнений, для профилактики которых в настоящее время широко используются прямые оральные антикоагулянты (ПОАК) [2, 3]. ПОАК рекомендованы к использованию у пациентов старше 80 лет, поскольку показали безопасность по сравнению с варфарином в отношении развития крупных кровотечений [4]. Тем не менее в ряде рандомизированных клинических исследований (РКИ) выборка лиц старше 80 лет недостаточна по численности и нерепрезентативна, а данные, послужившие основой рекомендаций для этой возрастной группы, получены при анализе подгрупп, что несколько снижает их ценность [4]. Кроме того, в исследованиях в основном предоставляется информация о больших и фатальных кровотечениях, но клинически значимые небольшие кровотечения (КЗНК) также оказывают существенное влияние на пациента. Развитие КЗНК снижает качество жизни, нарушает приверженность терапии, приводит к необоснованно длительной отмене ПОАК как самим пациентом, так и врачом, что сопряжено с крайне высоким риском эмболических осложнений [5].
В исследованиях показано, что КЗНК могут быть связаны с риском смерти и/или серьезных сердечно-сосудистых осложнений, которые нельзя назвать незначительными [6–8]. Подобные кровотечения требуют медицинского вмешательства, назначения фармакологического лечения, а иногда и переливания крови [6]. Данные о распространенности КЗНК ограниченны. Согласно результатам последних исследований, их распространенность варьирует от 6,69 до 17,4% [8–11] и имеет прямую связь с возрастом пациентов: чем старше популяция, тем чаще эпизоды возникновения КЗНК [12, 13]. Нередко в исследованиях информация о частоте развития КЗНК представлена в совокупности с частотой других типов кровотечений, редко учитываются данные о структуре КЗНК [14–16].
На основании изложенного представляет интерес изучение частоты встречаемости и структуры КЗНК на фоне приема ПОАК у пациентов с ФП в наиболее уязвимой к лекарственной терапии старшей возрастной группе.
Цель – изучить частоту встречаемости и структуру КЗНК на фоне приема ПОАК у пациентов 80 лет и старше с неклапанной ФП в реальной клинической практике.
Материал и методы
В наблюдательном продольном проспективном исследовании реальной клинической практики участвовали пациенты 80 лет и старше с неклапанной ФП. Набор пациентов в исследование осуществлялся с января 2019 г. по декабрь 2022 г. Исследование было одобрено этическим комитетом Федерального государственного бюджетного учреждения дополнительного профессионального образования «Центральная государственная медицинская академия» Управления делами Президента РФ и проведено в соответствии с Хельсинкской декларацией с соблюдением правил надлежащей клинической практики. Устное и письменное информированное согласие получено от всех участников исследования.
Пациенты находились на лечении в многопрофильном стационаре г. Москвы и последовательно включались в исследование, если соответствовали критериям включения:
- пациенты обоего пола с неклапанной ФП;
- возраст на момент включения в исследование – 80 лет и старше;
- регулярный прием ПОАК в течение не менее года от момента включения в исследование;
- подписание добровольного информированного согласия на участие в исследовании.
Основные критерии невключения:
- возраст младше 80 лет;
- клинически значимые заболевания сердца (в том числе кардиогенный шок, недавно перенесенный (менее месяца назад) инфаркт миокарда с осложнениями, атриовентрикулярная блокада 3-й степени без искусственного водителя ритма, гипертрофическая кардиомиопатия, выраженный аортальный и митральный стеноз);
- выраженные заболевания печени (включая цирроз печени с асцитом);
- заместительная почечная терапия (программный гемодиализ, перитонеальный диализ, трансплантация почки в анамнезе);
- клинически значимое иммунологическое заболевание;
- неврологические заболевания (в частности, острое нарушение мозгового кровообращения и транзиторная ишемическая атака в анамнезе менее трех месяцев назад);
- хирургическая операция (за исключением стоматологических или косметических операций), травмы, переломы в течение предыдущих трех месяцев;
- клинически значимые изменения лабораторных показателей, свидетельствовавшие о недиагностированном заболевании и требовавшие дополнительного обследования;
- нарушение пациентом процедур плана обследования и лечения;
- отказ пациента от участия в исследовании и отзыв информированного согласия.
Оценивались основные популяционные параметры (половой и возрастной состав групп, индекс массы тела), риск развития ишемического инсульта по шкале CHA2DS2-VASc, риск развития кровотечения по шкале HAS-BLED, сопутствующая патология, индекс коморбидности Чарлсона (Charlson), результаты лабораторных исследований (креатинин венозной плазмы и расчетная скорость клубочковой фильтрации (СКФ) по формуле CKD-EPI и Кокрофту – Голту), количество принимаемых лекарственных средств.
Для оценки частоты встречаемости и структуры КЗНК на фоне приема ПОАК проспективно проводился анализ медицинской документации (амбулаторные и стационарные карты). В исследовании использовались критерии кровотечений Международного общества по тромбозу и гемостазу (International Society on Thrombosis and Haemostasis, ISTH) [5, 17]. Период наблюдения за пациентами составил 12 месяцев.
Статистический анализ полученных данных проводили с использованием среды для статистических вычислений R 4.3.3 (R Foundation for Statistical Computing, Вена, Австрия). Описательная статистика представлена в виде абсолютной и относительной частот для качественных переменных, среднего (± стандартное отклонение) и медианы (1-й и 3-й квартили) – для количественных переменных с симметричным распределением и медианы (1-й и 3-й квартили) – для количественных переменных с асимметричным распределением. Соответствие выборочного распределения количественных переменных нормальному распределению проверяли с помощью теста Шапиро – Уилка. Кроме того, оценивали коэффициент асимметрии (за критическое значение принимали абсолютное значение коэффициента > 1,96). Для сравнения групп в отношении категориальных показателей применяли критерий χ² Пирсона и точный тест Фишера (при минимальном ожидаемом количестве наблюдений в ячейках таблицы сопряженности < 5). Для сравнения двух групп в отношении количественных и порядковых показателей использовали тест Манна – Уитни, для сравнения трех и более групп в отношении количественных показателей – тест Краскела – Уоллиса и тест Данна в качестве метода для post-hoc-сравнений. Проведение множественных сравнений сопровождалось использованием поправки Холма. 95%-ный доверительный интервал (ДИ) для биномиальных пропорций оценивали модифицированным методом Уилсона. В качестве меры силы различий между группами в отношении бинарных исходов использовали относительный риск (ОР) с соответствующим 95% ДИ, в качестве меры силы различий между группами в отношении плотности событий – отношение плотности событий (incidence rate ratio, IRR) с соответствующим 95% ДИ.
Результаты
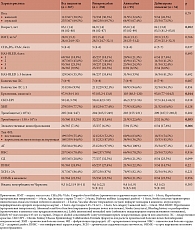
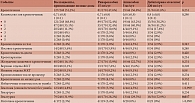
В исследовании участвовали 367 пациентов 80 лет и старше (медиана (Ме) возраста – 84 [82; 88] года, 69,5% женщин, 30,5% мужчин) с неклапанной ФП, находившихся на лечении в многопрофильном стационаре г. Москвы. Для профилактики тромбоэмболических осложнений все пациенты принимали ПОАК: ривароксабан, апиксабан и дабигатрана этексилат. Частота назначения ПОАК и их доз в исследуемой когорте пациентов представлена в табл. 1.
В зависимости от принимаемого ПОАК пациенты были разделены на группы ривароксабана, апиксабана и дабигатрана этексилата. Выявлена тенденция к меньшему возрасту среди пациентов, принимавших дабигатрана этексилат, и к большему возрасту среди пациентов, получавших апиксабан (p = 0,052). Пациенты, принимавшие дабигатрана этексилат, характеризовались статистически значимо более высокими значениями по шкале CHA2DS2-VASc по сравнению с пациентами, получавшими апиксабан (p = 0,031), и несколько более высокими значениями по сравнению с пациентами группы ривароксабана (p = 0,069). Пациенты, получавшие апиксабан, характеризовались более высокой концентрацией креатинина и более низкой СКФ по CKD-EPI по сравнению с пациентами, принимавшими ривароксабан (p = 0,033 и p = 0,057 соответственно) и дабигатрана этексилат (p = 0,033 и p = 0,031 соответственно). Кроме того, отмечалась тенденция к более высокой частоте тромбоцитопении среди пациентов, принимавших апиксабан (p = 0,055), и более высокой частоте злокачественных новообразований среди пациентов, получавших дабигатрана этексилат (p = 0,066). Исходная характеристика участников исследования представлена в табл. 2.
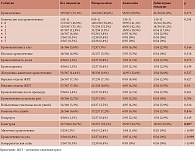
Частота развития кровотечений в исследуемой когорте составила 53,1% (95% ДИ 47,9–58,4), в группах ривароксабана – 49,6% (95% ДИ 43–56,1), апиксабана – 58,9% (95% ДИ 48,5–69,4), дабигатрана этексилата – 61,8% (95% ДИ 44–79,6). Статистически значимых отличий в отношении частоты осложнений в зависимости от применяемого препарата не выявлено (p = 0,173). ОР развития кровотечений на фоне применения дабигатрана этексилата составил 1,25 (95% ДИ 0,92–1,68) по отношению к ривароксабану (p = 0,153) и 1,05 (95% ДИ 0,76–1,44) по отношению к апиксабану (p = 0,776). ОР развития кровотечений при использовании апиксабана по отношению к ривароксабану составил 1,19 (95% ДИ 0,96–1,47; p = 0,111).
Плотность событий в исследуемой когорте составила 42,8 случая (95% ДИ 38–48,1) на 100 пациенто-лет, в группах ривароксабана – 40,1 случая (95% ДИ 34,4–46,4) на 100 пациенто-лет, апиксабана – 50,5 случая (95% ДИ 39,9–63) на 100 пациенто-лет, дабигатрана этексилата – 43,2 случая (95% ДИ 28,9–62) на 100 пациенто-лет. IRR развития кровотечений на фоне применения апиксабана составил 1,26 (95% ДИ 0,9–1,75) по отношению к ривароксабану (p = 0,174) и 1,17 (95% ДИ 0,71–1,91) по отношению к дабигатрана этексилату (p = 0,536), IRR развития кровотечений при использовании дабигатрана этексилата по отношению к ривароксабану составил 1,08 (95% ДИ 0,68–1,7; p = 0,752).
Наблюдалась тенденция к более высокой частоте развития гематурии среди пациентов, принимавших дабигатрана этексилат (p = 0,057). ОР развития гематурии в группе дабигатрана этексилата составил 1,65 (95% ДИ 1,13–2,4) по отношению к ривароксабану и 1,52 (95% ДИ 0,99–2,34) по отношению к апиксабану (табл. 3).
Сравнение полных доз
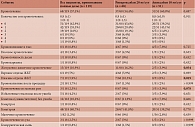
Частота развития кровотечений при использовании полных доз ривароксабана или апиксабана составила 57,1% (95% ДИ 47,8–66,5), среди принимавших ривароксабан 20 мг/сут – 54,4% (95% ДИ 41,8–67), получавших апиксабан 10 мг/сут – 60,8% (95% ДИ 46,4–75,2). Статистически значимых отличий по частоте осложнений в зависимости от применяемого препарата не зафиксировано (p = 0,487). ОР развития кровотечений на фоне применения апиксабана по отношению к ривароксабану составил 1,12 (95% ДИ 0,82–1,53).
Плотность событий при использовании полных доз ривароксабана или апиксабана составила 59,1 случая (95% ДИ 48,2–71,7) на 100 пациенто-лет, среди принимавших ривароксабан 20 мг/сут – 61,2 случая (95% ДИ 46,7–78,7) на 100 пациенто-лет, получавших апиксабан 10 мг/сут – 56,5 случая (95% ДИ 40,9–76) на 100 пациенто-лет. IRR развития кровотечений при использовании ривароксабана по отношению к апиксабану составил 1,08 (95% ДИ 0,64–1,82; p = 0,762).
Риск развития желудочно-кишечных кровотечений (ОР 4,12; 95% ДИ 0,93–18,3; p = 0,034), в частности кровотечений из нижних отделов желудочно-кишечного тракта (ЖКТ) (p = 0,019), был выше у пациентов, принимавших ривароксабан 20 мг/сут, по сравнению с пациентами, получавшими апиксабан 10 мг/сут. Отмечалась тенденция к более высокой частоте кровотечений из мелких ран при использовании полных доз апиксабана (p = 0,078) (табл. 4).
Сравнение редуцированных доз
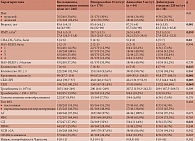
Пациенты, принимавшие апиксабан 5 мг/сут, были статистически значимо старше пациентов, получавших ривароксабан 15 мг/сут (p = 0,014) и дабигатрана этексилат (p = 0,001). Пациенты, принимавшие ривароксабан, были несколько старше пациентов, получавших дабигатрана этексилат (p = 0,054). Пациенты, принимавшие апиксабан, характеризовались тенденцией к более низкому индексу массы тела (ИМТ) по сравнению с пациентами получавшими ривароксабан и дабигатрана этексилат (p = 0,059). Пациенты, принимавшие дабигатрана этексилат, характеризовались статистически значимо более высокими баллами по шкале CHA2DS2-VASc по сравнению с пациентами, получавшими апиксабан 5 мг/сут (p = 0,015). Различия в отношении данного показателя при сравнении других групп не были статистически значимыми (p = 0,115). Пациентам, принимавшим дабигатрана этексилат, было назначено статистически значимо больше препаратов, чем пациентам, получавшим апиксабан 5 мг/сут (p = 0,019), и несколько больше, чем пациентам, принимавшим ривароксабан 15 мг/сут (p = 0,064). Пациенты, получавшие апиксабан 5 мг/сут, имели более высокую концентрацию креатинина и меньшую СКФ по CKD-EPI по сравнению с пациентами, принимавшими ривароксабан 15 мг/сут (p = 0,019 и p = 0,061 соответственно) и дабигатрана этексилат (p = 0,001 и p = 0,002 соответственно). Пациенты, принимавшие ривароксабан, характеризовались более высоким уровнем креатинина (p = 0,042) и более низкой СКФ (p = 0,061) по сравнению с лицами, получавшими дабигатрана этексилат. У пациентов, принимавших ривароксабан, статистически значимо чаще отмечался сахарный диабет по сравнению с пациентами, получавшими апиксабан в редуцированной дозе (p = 0,022) (табл. 5).
Частота развития кровотечений среди пациентов, принимавших редуцированные дозы, составила 51,2% (95% ДИ 44,8–57,6), среди получавших ривароксабан 15 мг/сут – 47,6% (95% ДИ 39,8–55,4), принимавших апиксабан 5 мг/сут – 56,8% (95% ДИ 41–72,6), дабигатрана этексилат 220 мг/сут – 61,8% (95% ДИ 44–79,6). Статистически значимых различий в отношении частоты осложнений в зависимости от применяемого препарата не выявлено (p = 0,231). ОР развития кровотечений при использовании дабигатрана этексилата составил 1,3 (95% ДИ 0,95–1,78) по отношению к ривароксабану (p = 0,107) и 1,09 (95% ДИ 0,74–1,59) по отношению к апиксабану (p = 0,666). ОР развития кровотечений при использовании апиксабана 5 мг/сут по отношению к ривароксабану 15 мг/сут составил 1,19 (95% ДИ 0,88–1,62; p = 0,262).
Плотность событий при назначении редуцированных доз препаратов составила 37 случаев (95% ДИ 31,9–42,8) на 100 пациенто-лет, среди пациентов, принимавших ривароксабан 15 мг/сут, – 34,1 случая (95% ДИ 28,2–40,9) на 100 пациенто-лет, апиксабан 5 мг/сут – 44,6 случая (95% ДИ 31,1–62,1) на 100 пациенто-лет, дабигатрана этексилат 220 мг/сут – 43,2 случая (95% ДИ 28,9–62) на 100 пациенто-лет. IRR развития кровотечений при использовании апиксабана 5 мг/сут составил 1,31 (95% ДИ 0,82–2,09) по отношению к ривароксабану 15 мг/сут (p = 0,262) и 1,03 (95% ДИ 0,58–1,85) по отношению к дабигатрана этексилату (p = 0,911), IRR развития кровотечений на фоне применения дабигатрана этексилата по отношению к ривароксабану 15 мг/сут составил 1,27 (95% ДИ 0,79–2,03; p = 0,33).
При сравнительном анализе установлено, что пациенты, принимавшие апиксабан 5 мг/сут, были статистически значимо старше пациентов, получавших ривароксабан 15 мг/сут (p = 0,014) и дабигатрана этексилат (p = 0,001). Пациенты, принимавшие ривароксабан, были несколько старше пациентов, получавших дабигатрана этексилат (p = 0,054). Пациенты, принимавшие апиксабан, характеризовались тенденцией к более низкому ИМТ по сравнению с пациентами, получавшими ривароксабан и дабигатрана этексилат (p = 0,059). Пациенты, принимавшие дабигатрана этексилат, характеризовались статистически значимо более высокими баллами по шкале CHA2DS2-VASc по сравнению с пациентами, получавшими апиксабан 5 мг/сут (p = 0,015). Различия в отношении данного показателя при сравнении других групп не были статистически значимыми (p = 0,115). Пациентам, принимавшим дабигатрана этексилат, было назначено статистически значимо больше препаратов по сравнению с пациентами, получавшими апиксабан 5 мг/сут (p = 0,019), и несколько больше по сравнению с пациентами, принимавшими ривароксабан 15 мг/сут (p = 0,064). Пациенты, получавшие апиксабан 5 мг/сут, имели более высокую концентрацию креатинина и меньшую СКФ по CKD-EPI, чем пациенты, принимавшие ривароксабан 15 мг/сут (p = 0,019 и p = 0,061 соответственно) и дабигатрана этексилат (p = 0,001 и p = 0,002 соответственно). Пациенты, принимавшие ривароксабан, характеризовались более высоким уровнем креатинина (p = 0,042) и более низкой СКФ (p = 0,061) по сравнению с лицами, получавшими дабигатрана этексилат. У пациентов, принимавших ривароксабан, статистически значимо чаще отмечали сахарный диабет по сравнению с пациентами, получавшими апиксабан в редуцированной дозе (p = 0,022).
Риск развития гематурии при использовании дабигатрана этексилата был статистически значимо выше, чем на фоне применения ривароксабана 15 мг/сут (ОР 1,87; 95% ДИ 1,25–2,81; p = 0,008), и несколько выше, чем в случае применения апиксабана 5 мг/сут (ОР 1,79; 95% ДИ 1,01–3,17; p = 0,061) (табл. 6).
Обсуждение
В проведенном нами исследовании наиболее часто назначаемым ПОАК для профилактики тромбоэмболических осложнений у пациентов с ФП старше 80 лет был ривароксабан – 64,9% . Апиксабан принимали 25,9%, а дабигатрана этексилат – 9,3% пациентов. Частота встречаемости КЗНК на фоне приема всех ПОАК составила 53,1% (95% ДИ 47,9–58,4), несмотря на то, что частота развития КЗНК в зависимости от применяемого ПОАК несколько варьировала, статистически значимых различий в отношении развития кровотечений между исследуемыми группами не выявлено (ривароксабан – 49,6% (95% ДИ 43–56,1), апиксабан – 58,9% (95% ДИ 48,5–69,4), дабигатрана этексилат – 61,8% (95% ДИ 44–79,6); p = 0,173). Более высокая частота развития КЗНК на фоне применения апиксабана по сравнению с ривароксабаном может быть обусловлена неоднородностью выборки. Так, пациенты, принимавшие апиксабан, чаще имели факторы риска кровотечений: назначение более возрастным пациентам (p = 0,052), пациентам с низкими показателями СКФ (p = 0,018), высоким уровнем креатинина (p=0,014) и тромбоцитопенией (p = 0,055). Это косвенно отражает сопоставимый профиль безопасности апискабана по сравнению с другими ПОАК в группе пациентов с наличием множества факторов риска кровотечений. Плотность событий составила 42,8 случая (95% ДИ 38–48,1) на 100 пациенто-лет, также без статистической значимости различий между ПОАК. По структуре кровотечений на фоне приема всех ПОАК наиболее часто отмечались гематурия (34,7%) и кровотечения из ЖКТ (14,4%). Вместе с тем наблюдалась тенденция к более высокой частоте развития гематурии среди пациентов, принимавших дабигатран, – 52,9% (p = 0,057). Нередко регистрировались гематомы без ушиба (6,6%), носовые кровотечения (4,9%), кровоизлияния в глаз (3,8%).
Полученные данные показывают, что в нашей популяции пациентов апиксабан используется в два раза реже, чем ривароксабан, несмотря на то, что его преимущества показаны в ряде фармакологических согласительных документов: критерии Бирса [18], критерии OAC-FORTA (Oral Anticoagulants Fit for the Aged, оральные антикоагулянты, подходящие для пожилых пациентов) [19–21]. Апиксабан также продемонстрировал безопасность в крупных метаанализах [10, 22]. Так, F. Ma и соавт. [22] провели метаанализ 19 РКИ с участием 85 826 пациентов и оценили риски КЗНК у пациентов с ФП. В качестве оценочного индекса использовали поверхность под кумулятивными ранжирующими кривыми (surface under the cumulative ranking curve, SUCRA), где большее значение SUCRA указывает на меньший риск кровотечения и большую безопасность. Согласно рейтинговой таблице, безопасность ПОАК распределилась следующим образом: апиксабан (SUCRA, 93,9), антагонисты витамина K (SUCRA, 47,7), дабигатран (SUCRA, 40,3), ривароксабан (SUCRA, 35,9), что свидетельствует о более высоком профиле безопасности апиксабана.
Другой метаанализ Y. Wang и соавт. [10] включал в себя анализ 35 наблюдательных исследований с участием 2 356 201 пациента. Исследователи сравнили риск развития кровотечений на фоне применения разных ПОАК и варфарина. Показано, что пациенты, получающие апиксабан, имеют более низкий риск больших кровотечений по сравнению с пациентами, принимающими варфарин (ОР 0,60; 95% ДИ 0,50–0,71; р < 0,001), в отличие от пациентов, принимающих ривароксабан, у которых риск аналогичен таковому на фоне приема варфарина (ОР 0,98; 95% ДИ 0,91–1,06; р = 0,60).
Наши результаты показали высокую частоту встречаемости КЗНК и высокую плотность событий, что согласуется с доступными данными литературы. Так, в исследовании ROCKET AF (Rivaroxaban Once Daily, Oral, Direct Factor Xa Inhibition Compared with Vitamin K Antagonism for Prevention of Stroke and Embolism Trial in Atrial Fibrillation) [9] приняли участие 14 264 пациента, которые рандомно были отобраны в группы ривароксабана или варфарина, а также разделены по возрасту. Согласно данным, КЗНК на фоне приема ПОАК были зарегистрированы у 10,4% пациентов младше 55 лет, что соответствует 6,93 случая на 100 пациенто-лет, у 12% пациентов в возрасте 55–64 лет (8,2 случая на 100 пациенто-лет), 14,3% в возрасте 65–74 лет (10,28 случая на 100 пациенто-лет), 17,3% пациентов 75–84 лет (13,77 случая на 100 пациенто-лет), 17,9% пациентов старше 85 лет (16,8 случая на 100 пациенто-лет). Прослеживается связь возраста пациента с частотой возникновения КЗНК: чем старше пациент, тем чаще возникают эпизоды кровотечений. Анализ также показал, что общая частота всех кровотечений (больших и КЗНК) выше у пациентов ≥ 75 лет, принимающих ривароксабан, по сравнению с пациентами этой же группы, получающими варфарин. В то же время у пациентов младше 75 лет различий не выявлено (р = 0,009).
В исследовании F. Catalani и соавт. [13] осуществлен проспективный анализ безопасности терапии ПОАК у 518 пациентов в возрасте ≥ 75 лет в течение года. У очень пожилых пациентов (Ме возраста – 88 [86; 90] лет) наблюдалась значительно более высокая частота развития КЗНК по сравнению с пациентами старческого возраста (Ме возраста – 79 [77; 82] лет) (13,24 против 6,69%, ОР 2,13; 95% ДИ 1,17–3,92).
В ретроспективном исследовании A. Abdullah и соавт. [11] изучили 114 медицинских карт пациентов с ФП (64 пациента получали ривароксабан, 80 – апиксабан) (Ме возраста – 69,5 [63; 74] года) из Малайзии. В общей сложности было зарегистрировано 17,4% КЗНК (17,2% на ривароксабане и 17,5% на апиксабане).
В крупном регистре GARFIELD-AF (Global Anticoagulant Registry in the FIELD – Atrial Fibrillation, антикоагулянты, применяемые при ФП) [23], где были обследованы 52 032 пациента в возрасте ≥ 18 лет с ФП (средний возраст – 71 год), частота КЗНК составила 1,10 (95% ДИ 1,01–1,20) на 100 пациенто-лет в течение года. Тем не менее полученный нами процент частоты встречаемости и плотность событий развития КЗНК в несколько раз выше, чем в исследованиях других авторов. Это может быть обусловлено высокой возрастной категорией исследуемой нами выборки пациентов (возраст старше 80 лет, средний возраст – 85,1 ± 4 года). Кроме того, при расчете плотности событий мы учитывали не только факт кровотечений за период наблюдения, но и количество зон КЗНК.
Полученные в нашем исследовании данные о структуре кровотечений также оказались сопоставимы с данными более ранних исследований [6, 11, 13, 23], в которых наиболее частая локализация КЗНК приходилась на область ЖКТ, мочеполовых путей, кожных покровов, области носа и глаз.
В крупном регистре GARFIELD-AF [23] наиболее частыми локализациями КЗНК были глаза, уши, нос и кожа (36,6%), а также ЖКТ (21,4%) и мочеполовой тракт (22,1%).
В исследовании F. Catalani и соавт. [13] КЗНК чаще возникали в ЖКТ – 47% и мочеполовом тракте – 32,6%.
В ретроспективном исследовании A. Abdullah и соавт. [11] среди КЗНК чаще встречалась гематурия (для ривароксабана – 9,4%, для апиксабана – 3,8%). Регистрировались также кровоточивость десен (ривароксабан – 1,6%, апиксабан – 5%) и гематомы (ривароксабан – 3,1%, апиксабан – 3,8%), по одному случаю кровохарканья на каждый ПОАК (1,6% для ривароксабана и 1,3% для апиксабана). Конъюнктивальное, носовое и ректальное кровотечение встречалось по одному разу на фоне приема апиксабана (1,3%). Зарегистрирован один случай острого гастрита с кровотечением на фоне приема ривароксабана (1,6%).
В проспективном наблюдательном многоцентровом когортном исследовании L. Franco и соавт. [6] наиболее частыми типами КЗНК были макроскопическая гематурия (17,6%), кожные или подкожные гематомы (17,6%), носовое кровотечение (15,6%), ректальное кровотечение (14,1%) и мышечные гематомы (11,2%). Реже встречались кровохарканье (4,9%), мелена и кровоизлияние в брюшную полость или малый таз (по 3,9%), кровавая рвота, анемия или гематоракс (по 2,3%,), десневое кровотечение и кровотечение из половых органов (по 1%). Зафиксирован один случай кровоизлияния в околоушную железу (0,5%).
Заключение
Основу лечения пациентов с ФП составляет антикоагулянтная терапия, но наряду с защитой от тромбоэмболии антикоагулянты несут в себе риск развития кровотечений, которые могут варьировать по степени тяжести. В современной клинической практике особое внимание уделяется большим и жизнеугрожающим кровотечениям, однако роль КЗНК, согласно последним исследованиям, также значительна. Подобные кровотечения приносят дискомфорт пациенту, что нередко приводит к нарушению схемы приема ПОАК и/или полной отмене терапии, тем самым увеличивая риск тромбоза. Данная проблема наиболее актуальна для пациентов гериатрического профиля, что связано с особенностями метаболизма антикоагулянтов. С возрастом у людей наблюдаются изменения в работе печени, почек, а также в составе крови, что приводит к различным изменениям фармакокинетики и фармакодинамики ПОАК. В нашем исследовании показано, что более чем у половины пациентов старше 80 лет с ФП на фоне приема ПОАК развиваются КЗНК.
Информация о высокой распространенности КЗНК позволит медицинским работникам быть более настороженными в отношении устранения факторов, влияющих на развитие подобных кровотечений.
Таким образом, с учетом значимости и высокой частоты встречаемости КЗНК целесообразно, чтобы будущие исследования в отношении безопасности ПОАК включали информацию не только о частоте возникновения КЗНК, но и о факторах риска их развития.
M.S. Chernyaeva, PhD, M.A. Rozhkova, A.P. Kondrakhin, PhD, A.A. Pogodina, I.N. Makhmudov, D.A. Alisultanov, L.A. Yegorova, PhD, O.M. Maslennikova, PhD, N.V. Lomakin, PhD, D.A. Sychev, PhD, Prof.
Central State Medical Academy of Department of President Affairs
Hospital for War Veterans № 2
A.I. Burnazyan Federal Medical Biophysical Center
N.I. Pirogov Russian National Research Medical University
Russian Medical Academy of Continuing Professional Education
Central Clinical Hospital with at Ambulant Сlinic
Contact person: Marina S. Chernyaeva, doctor@cherniaeva.ru
The purpose of this study was to study the incidence and structure of clinically relevant non-major bleeding (CRNMB) while taking direct oral anticoagulants (DOACs) in patients 80 years of age and older with non-valvular atrial fibrillation (AF) in real clinical practice.
Material and methods. The study included 367 patients with non-valvular AF, 80 years and older (median age 84 [82; 88] years, 69.5% women), while taking DOACs. To assess the incidence and structure of CRNMB, medical documentation (outpatient and inpatient records) was analyzed prospectively. The study used the International Society on Thrombosis and Haemostasis (ISTH) bleeding criteria. The observation period for patients was 12 months.
Results. The most frequently prescribed DOACs for the prevention of thromboembolic complications in patients with AF over 80 years of age was rivaroxaban – 64.9%, apixaban was taken – 25.9%, and dabigatran etexilate – 9.3%. The incidence of CRNMB while taking all DOACs was 53.1% (95% CI 47.9–58.4), while no statistically significant differences in the development of bleeding were detected between DOACs (p = 0.173). The event density was 42.8 cases (95% CI 38–48.1) per 100 patient-years, also without statistical significance of differences between DOACs. According to the structure of bleeding while taking all DOACs, hematuria (34.7%) and bleeding from the gastrointestinal tract (14.4%) were most often observed, however, there was a tendency to a higher incidence of hematuria among patients taking dabigatran etexilate – 52.9% (p = 0.057). Hematomas without bruising (6.6%), nosebleeds (4.9%), and hemorrhages in the eye (3.8%) were also often recorded.
Conclusion. In patients over 80 years of age with non-valvular AF treated with DOACs, developed CRNMB was detected in more than half of the cases. Although CRNMB does not pose a threat to life, it has a significant impact on the patient's quality of life and can lead to disruption of the treatment regimen or complete discontinuation of DOACs. Given the extremely high incidence of this type of bleeding in geriatric patients, clinicians need to be especially vigilant regarding the prevention of CRNMB.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.