Антибиотики и микробиота – вражда неизбежна? XVIII Российский конгресс «Инновационные технологии в педиатрии и детской хирургии». Сателлитный симпозиум компании «Фармамед»
- Аннотация
- Статья
- Ссылки




Антибиотики и их влияние на микробиом детей – взгляд клинициста
Открывая симпозиум, д.м.н., член-корреспондент Российской академии наук, профессор кафедры детских болезней Первого Московского государственного медицинского университета им. И.М. Сеченова, руководитель детского клинического отделения Центрального научно-исследовательского института эпидемиологии Александр Васильевич ГОРЕЛОВ отметил, что антибиотики являются эффективным инструментом в борьбе с тяжелыми бактериальными инфекциями. Но не следует забывать, что необходимым условием сохранения здоровья человека является бережное отношение к микробному разнообразию кишечника.
Инфекционные болезни всегда были определяющим фактором популяционного состава на планете Земля. Эпидемии чумы, оспы, холеры унесли миллионы жизней. Появление первого антибиотика пенициллина ознаменовало новую эпоху в истории медицины. Внедрение антибактериальных препаратов в повседневную медицинскую практику коренным образом изменило структуру заболеваемости в мире. Значительно снизились показатели смертности от наиболее тяжелых и широко распространенных инфекционных заболеваний. Вместе с тем активное внедрение методов антибиотикотерапии привело к росту бактериальной резистентности. В частности, не последнюю роль в этом сыграло широкое применение антибиотиков в сельском хозяйстве1. По данным Всемирной организации здравоохранения (ВОЗ) за 2010 г., использование антибиотиков в мировом аграрном секторе достигло 63 200 т. В ряде стран Европейского союза ведется жесткая политика, регулирующая применение антибиотиков в агропромышленности. Так, в Дании и Швеции наложен запрет на использование антибиотических стимуляторов в птицеводстве. Однако в некоторых странах их продолжают использовать в животноводстве. В Российской Федерации антибиотики применяют для лечения и профилактики заболеваний продуктивных животных, птиц, рыб, пчел. Кормовые антибиотики используют в скотоводстве, свиноводстве и птицеводстве.
Нерациональное использование антибиотиков приводит к возникновению антибиотикорезистентных штаммов бактерий и соответственно росту числа антибиотикорезистентных заболеваний.
По данным ВОЗ, в странах Европейского союза свыше 25 000 человек ежегодно умирают от инфекций, вызванных антибиотикорезистентными бактериями. Ключевыми причинами роста смертности от инфекций, устойчивых к антибиотикам, является широкое (в два раза больше, чем в медицине) применение антибиотиков в производстве продуктов питания; более 50% производимых в мире антибактериальных препаратов используют в сельском хозяйстве, аквакультуре, животноводстве.
В нашей стране главный проводник политики Роспотребнадзора в борьбе с устойчивостью к противомикробным препаратам в пищевой индустрии – Референс-центр по мониторингу остаточного количества антибиотиков и антибиотикорезистентности бактерий в продовольственном сырье и пищевых продуктах. По данным Референс-центра за 2018–2019 гг., зафиксирован наибольший удельный вес видов продукции (из выявленных) с превышением предельно допустимых уровней содержания антибиотиков:
- птица и продукты ее переработки – 9,3%;
- колбасные изделия – 5,8%;
- мясо и мясопродукты – 2,2%.
Наиболее часто выявляемыми противомикробными препаратами стали окситетрациклин, тетрациклин, доксициклин, энрофлоксацин, сульфадиазин и др. Согласно анализу резистентности изолятов, выделенных из образцов продуктов питания и внешней среды, фенотипические признаки антибиотикорезистентности выявлены у 62,7% изолятов. Проведена оценка фенотипических характеристик устойчивых к противомикробным препаратам изолятов микроорганизмов, выделенных в субъектах РФ из продовольственного сырья и продуктов. Так, установлена резистентность Salmonella spp. в 92,5% случаев к одному антибиотику или более: ципрофлоксацину, нитрофурантоину, хлорамфениколу, цефуроксиму аксетилу, ампициллину, триметоприму/сульфаметоксазолу, моксифлоксацину, тигециклину и др. По данным молекулярно-генетических исследований, проведенных методом полимеразной цепной реакции (ПЦР), в ряде случаев зафиксирована полирезистентность микроорганизмов.
Таким образом, за широким применением антибиотиков следует реальный рост антибиотикорезистентности. Как результат – возникновение суперинфекций, определяющих рост заболеваемости и смертности. По прогнозам экспертов ВОЗ, из-за устойчивости инфекций к антибиотикам число летальных исходов к 2050 г. достигнет 10 млн. Во избежание этого мировое сообщество должно придерживаться стратегии сдерживания распространения антимикробной резистентности.
Основное негативное воздействие антибиотиков направлено на микробиом. Причем речь идет не только о кратковременных эффектах, но и долгосрочном комплексном влиянии антимикробных препаратов на состав и состояние микробиома. Антибиотики прежде всего влияют на микрофлору и барьерную функцию слизистой оболочки кишечника. На фоне антибактериальной терапии (АБТ) может развиваться антибиотик-ассоциированный синдром, связанный с поражением желудочно-кишечного тракта (ЖКТ), полости рта (стоматит) и слизистых оболочек гениталий (вульвовагинит). Наиболее частое проявление синдрома в ЖКТ – антибиотик-ассоциированная диарея (ААД). Она развивается у 39% детей, получающих антибактериальные препараты.
У больных ААД выделяют различные возбудители, в том числе Clostridium difficile. Известно, что C. difficile продуцируют энтеро- и цитотоксины. В развитии ААД главную роль играют токсины А и B, которые способствуют снижению функции эпителиального барьера, стимулируют продукцию провоспалительных цитокинов (интерлейкин (ИЛ) 1, ИЛ-8 и др.) из рекрутируемых нейтрофилов. На фоне приема антибиотиков и угнетения нормальной микробиоты размножаются условно патогенные микроорганизмы, продуцирующие цито- и энтеротоксины (C. difficile, Staphylococcus aureus, Salmonella spp. и др.). В конечном итоге это приводит к развитию диареи или воспалению. Одним из самых тяжелых антибиотик-ассоциированных поражений кишечника является псевдомембранозный колит (ПМК), который развивается при избыточном росте и размножении C. difficile. В 30% случаев ПМК приводит к летальному исходу.
Профессор А.В. Горелов подчеркнул, что эффективным средством профилактики ААД у детей и взрослых являются пробиотические препараты. По данным Кохрейновского обзора (2011 г.), включающего 23 рандомизированных клинических исследования с участием 3432 детей в возрасте от двух месяцев до 17 лет, у пациентов, принимавших пробиотики, ААД развивалась на 54% реже, чем у пациентов контрольной группы. Исследователи пришли к выводу, что пробиотики эффективны в профилактике ААД2.
Назначение пробиотика одновременно с антибиотиком для профилактики C. difficile-ассоциированной диареи является эффективным и безопасным методом.
Пробиотики могут повышать эффективность АБТ, поскольку снижают риск развития обусловленных антибиотиками суперинфекций в кишечнике. Пробиотики секретируют антибактериальные вещества (молочная кислота, перекись водорода, бактериоцины), подавляя рост патогенных и условно патогенных микроорганизмов в кишечнике и разрушая биопленки, и повышают локальный и общий иммунный ответ.
Профессор А.В. Горелов привел данные собственного рандомизированного клинического исследования, в котором оценивали способность мультипробиотического препарата нивелировать риск развития желудочно-кишечных расстройств и нарушений микробиоценоза на фоне АБТ у детей в возрасте от года до трех лет и с трех до семи лет с острой респираторной инфекцией (ОРИ), а также его влияние на характер течения заболевания. Исследователи определяли частоту развития и выраженности проявлений ОРИ, желудочно-кишечных расстройств, а также динамику кишечного микробиоценоза с использованием секвенирования гена 16S pРНК у детей с ОРИ от года до семи лет, получавших АБТ по поводу бактериальных осложнений (отит, пневмония, тонзиллит, синусит), в группе пациентов, принимавших мультипробиотик с первого дня АБТ, и группе без него.
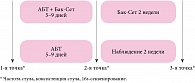
В исследовании приняли участие 148 детей, поступивших в стационар на 1–3-е сутки заболевания, с типичными симптомами ОРИ. Основную группу составили 54 ребенка в возрасте от года до трех лет и 65 детей – от трех до семи лет, контрольную – 29 условно здоровых детей в возрасте от года до семи лет, проходивших диспансерное наблюдение у педиатра. Дети обеих возрастных категорий основной группы на фоне антибиотикотерапии получали мультипробиотик Бак-Сет с первого дня АБТ (5–10 дней) и еще 14 дней по ее окончании. В группе сравнения детям назначали АБТ без пробиотиков.
Выполнялся анализ частоты дефекации, консистенции кала (оценка по Бристольской шкале) в трех точках: первый день проведения АБТ, день окончания АБТ (7 ± 2 дня от начала терапии), 14 дней после окончания АБТ (21 ± 2 дня от начала терапии). При отсутствии самостоятельного стула применяли свечи с глицерином. При каждом из заборов образец кала был охарактеризован по Бристольской шкале, а также ежедневно фиксировалось число актов дефекации с момента начала АБТ до момента выписки – в стационаре, а затем амбулаторно до 21 ± 2 дня от начала наблюдения (рис. 1).
До начала интерпретации данных основная и контрольная группы были сопоставимы по характеру стула. Как и ожидалось, в группе без Бак-Сета к моменту окончания АБТ диарея наблюдалась у 56% детей младшей возрастной группы и у 66% – старшей. В группе Бак-Сета наблюдалась всего у 7,4% детей младшей возрастной группы и у 20% – старшей.
При оценке кала по Бристольской шкале в группе сравнения показатель смещался в область умеренной диареи, тогда как в основной группе этого не наблюдалось. В процессе исследования ни у одного пациента основной группы не зафиксировано побочных реакций на фоне применения мультипробиотического препарата Бак-Сет (рис. 2 и 3).
В исследовании оценивали динамику кишечного микробиома на фоне антибиотикотерапии и по ее окончании самым современным способом – секвенированием гена 16S рРНК. Статистический анализ проводился путем попарного сравнения всех трех временных точек. Образцы кала, собранные на момент начала терапии, ее окончания и через 21 ± 2 дня от ее начала, были заморожены и исследованы методом секвенирования гена 16S рРНК. Ретроспективно в каждой группе сравнивали изменения микробного сообщества по изменению альфа- и бета-разнообразия в результате терапии, оценивали изменение относительной представленности бактериальных таксонов, изменение метаболических путей и модулей микробиоты.
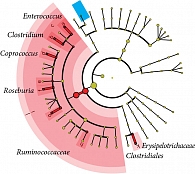
Глобального сдвига состава микробиоты под воздействием антибиотиков не зарегистрировано, но степень изменения общего состава микробиоты в группах различалась. В обеих группах имело место увеличение альфа-разнообразия после завершения антибактериальной терапии. Несмотря на то что при анализе бета-разнообразия ни в одной из сравниваемых групп значимых изменений общего состава микробиоты не установлено, для каждой группы были найдены таксономические единицы, доля которых значимо изменилась между любыми двумя временными точками. Прием антибиотиков ассоциировался с ростом представленности энтерококков, уменьшением числа бифидобактерий и ряда комменсальных клостридий. У детей, не принимавших Бак-Сет, после приема антибиотиков значительно увеличивалось число энтерококков по сравнению со здоровыми детьми и детьми, получавшими пробиотик. Кроме того, на момент окончания приема антибиотиков в группе Бак-Сет в отличие от контрольной группы содержание бифидобактерий поддерживалось на постоянном уровне. Различия между группами были статистически значимы.
Примечательно, что изменение микробиоты дисбиотического характера (рост доли оппортунистических энтерококков, снижение доли бифидобактерий и ряда комменсальных клостридий) в группе сравнения положительно коррелировало с клиническими проявлениями – изменением консистенции кала до уровня умеренной диареи. В основной группе не установлено значимых изменений по какому-либо таксону ни для одной пары временных точек и не зарегистрировано разжижения стула.
Проведенное исследование показало, что добавление препарата Бак-Сет к АБТ с первого ее дня уменьшает частоту развития ряда проявлений ОРИ, желудочно-кишечных расстройств и устраняет негативное влияние на микробиом. Данный факт установлен клинически и подтвержден инновационным методом секвенирования гена 16S pРНК образцов кала. Выявленные позитивные факты, а также отсутствие побочных реакций и хорошая переносимость препарата Бак-Сет Беби позволяют рассматривать его как препарат первого выбора в педиатрической практике, особенно у детей раннего возраста, получающих АБТ, для профилактики нарушений ЖКТ и микробиома.
Антибиотики и их влияние на микробиом кишечника у детей – взгляд врача лабораторной диагностики
Врач клинической лабораторной диагностики, исполнительный директор биомедицинского холдинга «Атлас» Александр Владимирович КАРАСЕВ подчеркнул, что с появлением новых молекулярно-генетических методов представления о микробиоте кишечника человека значительно расширились. Микробиота отличается многообразием форм и несет в себе генетическую информацию. Кишечная микробиота может включать 300–3000 видов бактерий. Число клеток бактерий на порядок превышает количество клеток человека, число генов в метагеноме примерно 106 (на два порядка больше, чем генов человека). Среди основных функций микроорганизмов в микробиоме кишечника – синтез полезных веществ, в том числе короткоцепочечных жирных кислот и витаминов, защита от патогенных микробов, регуляция иммунной и эндокринной систем, защита от воспалительных заболеваний.
Следует отметить, что в настоящее время интерес к изучению микробиома не ослабевает. В 2018 г. на данную тему было опубликовано свыше 4000 статей. С 2008 г. запущен глобальный проект «Микробиом человека» (Human microbiome project, НМР), цель которого охарактеризовать микробиоту человека и провести анализ ее роли в формировании здоровья и болезней. Европейский консорциум MetaHIT с 2010 г. занимается поиском ассоциаций микробиоты ЖКТ человека с состоянием здоровья и развитием заболеваний. Эти проекты объединены одной целью – оценкой взаимосвязей генома бактерий, состояния здоровья человека и развития заболеваний. Опубликованные данные показали, что количественный и качественный состав бактерий зависит от места обитания. Чем выше отдел ЖКТ, тем представленность бактерий меньше.
До недавнего времени считалось, что ребенок рождается полностью стерильным, а колонизация организма бактериями происходит позже. Однако результаты исследования мекония продемонстрировали наличие почти двух десятков бактерий в образцах здоровых доношенных новорожденных с вагинальным родоразрешением (энтеробактерии, бифидобактерии, энтерококки, бактероиды и др.)3.
На сегодняшний день молекулярно-генетические методы позволяют с высокой точностью идентифицировать микроорганизмы. К основным методам относятся ПЦР-диагностика, хроматографические методы анализа, секвенирование и метагеномика. Методом секвенирования определяют нуклеотидные последовательности маркерных генов (16S рРНК). Полногеномное секвенирование обеспечивает наиболее точную характеристику микроорганизмов. Фенотипирование in vitro, in vivo – метод, который применяется для оценки патогенности бактерий.
Культуромика – высокопроизводительное культивирование применяется в диагностике сепсиса. Метагеномика изучает набор генов всех микроорганизмов, полученных из образцов биологического материала или окружающей среды. Задачами метагеномики являются определение таксономического (филогенетического) положения микроорганизмов и функционального состояния микробиоты.
В настоящее время все больший интерес исследователей вызывают методы, основанные на функциональном анализе генома микробных сообществ, такие как метатранскриптомика, метаболомика, метапротеомика.
Долгое время считалось, что культуральные методы позволяют выделить конкретные микроорганизмы и определить их количество. Однако около 70% бактерий микробиоты не поддаются культивации на питательной среде. Из этого можно сделать вывод, что культивирование – косвенный метод.
Самым производительным на сегодняшний день считается метод определения нуклеотидной последовательности гипервариабельных участков генов 16S рРНК с помощью секвенирования. Ген 16S рРНК является уникальным и высококонсервативным участком нуклеотидной цепи всех бактерий. Поэтому секвенирование 16S рРНК признано новым золотым стандартом анализа состава микробиоты кишечника. Этот метод позволяет максимально полно анализировать состав микробиоты кишечника и более точно охватывает разнообразие биоты, чем полногеномные методы. С помощью 16S рРНК-секвенирования можно выявлять редкие виды бактерий.
Важным компонентом лабораторной диагностики является сохранение и транспортировка образца микробиоты. Основные составляющие преаналитического этапа лабораторной диагностики – сбор в стерильный контейнер и быстрая заморозка, холодовая цепь до лаборатории. Кроме того, применяются специальные контейнеры с консервантом, который позволяет прекратить любой рост или биохимические реакции в образце.
Некоторые бактерии в популяции не встречаются. И это является своеобразным маркером патогенности. Например, у обычных людей в микробиоте выделяется минимальное количество энтеробактерий. Их повышенная концентрация сигнализирует о патогенных свойствах.
Докладчик отметил, что для исследовательского анализа данных микробиоты кишечника человека создан специальный веб-ресурс Knomics-Biota, с помощью которого можно создавать и обмениваться аналитическими отчетами, загружать первичные данные и получать необходимую информацию4.
Основной характеристикой микробиоты является ее разнообразие. Чем больше видов бактерий присутствует в микробиоте, тем больше свойств у этих бактерий в комплексе. Защищая друг друга, они поддерживают защитные свойства организма. Для оценки разнообразия микробиологических сообществ применяют различные индексы. Например, с помощью индекса Chao определяют количество видов бактерий, присутствующих в одном образце. Человек, у которого данный индекс ниже нормы, склонен ко многим заболеваниям, в частности ААД.
Западную диету, снижающую разнообразие микробиоты кишечника, отличают наличие простых сахаров, недостаток волокон и низкое разнообразие пищи. В микробиоте людей, придерживающихся западной диеты, преобладают бактерии с факторами патогенности. Недостаток питания способствует вымиранию видов. В то же время недостаточное разнообразие микробиоты чаще приводит к развитию ААД. На фоне АБТ погибают минорные виды микроорганизмов, колонизация патогенов усиливается, иммунный ответ увеличивается и начинается системное воспаление5.
По данным исследования кишечной микробиоты с низким разнообразием, в восстановлении баланса состава микробиоты после антибиотик-ассоциированной энтеропатии большую роль играют бактерии, продуцирующие бутират – одну из короткоцепочечных жирных кислот. Бутират подавляет рост патогенов, влияет на различные биохимические реакции, способствует восстановлению нормальной микробиоты5.
Таким образом, правильная диета, нормализация качественного и количественного состава микробиоты с участием видов бактерий, образующих бутират, восстанавливают микробиоценоз кишечника.
Современные рекомендации при нарушениях микробиоты предусматривают прежде всего применение пробиотиков и пищевых волокон, которые являются естественной пищей для резидентной микрофлоры. Разнообразие питания – один из ключевых факторов, благоприятно воздействующих на микробиоту кишечника.
А.В. Карасев прокомментировал данные молекулярно-генетического анализа, полученные в ходе рандомизированного клинического исследования эффективности пробиотического препарата Бак-Сет на фоне антибактериальной терапии и по ее окончании у детей в возрасте от одного года до семи лет.
Пациенты были разделены на группы: в основной группе назначали антибиотик цефалоспоринового ряда для лечения бактериальной инфекции и Бак-Сет, в группе сравнения – только антибиотик. Образцы микробиоты кишечника брали в первые сутки от начала терапии, по ее окончании (на 5–10-е) и на 21–24-е сутки (через две недели после окончания применения препарата Бак-Сет).
На фоне применения антибиотика у детей одного-двух лет в группе сравнения наблюдались сильнейшее падение представленности класса бифидобактерий, комменсальных клостридий и рост патогенов рода энтерококков. В основной группе детей, получавших антибиотик вместе с мультипробиотиком Бак-Сет, бактериальное разнообразие сохранялось. У пациентов группы сравнения, не получавших пробиотик, отмечались существенное снижение разнообразия состава микробиоты и более медленное ее восстановление (рис. 4).
Из сказанного следует, что Бак-Сет позволяет сохранить разнообразие с течением времени даже на фоне АБТ.
Анализ основных изменений в микробиоте в таксонах также продемонстрировал значительно более быстрое увеличение численности положительных бактерий (Coprococcus, Blautia, Akkermansia) у детей, получавших Бак-Сет. Показано, что мультиштаммовый пробиотик Бак-Сет Беби нормализует метаболическую активность облигатной микробиоты у детей.
Как показал обзор множества публикаций, посвященных применению пробиотиков у детей после или во время АБТ, пробиотики предотвращают развитие ААД и нежелательные изменения микробиоты.
Результаты изучения состояния микробиоты в настоящем исследовании подтвердили предположение, что наиболее значимые ее нарушения происходят именно в период проведения АБТ, что делает целесообразными меры по защите микробиоты с первого дня АБТ.
В заключение А.В. Карасев подчеркнул, что входящие в состав мультипробиотиков штаммы проявляют высокую антагонистическую активность в отношении широкого спектра патогенных и условно патогенных микроорганизмов, поддерживают и восстанавливают собственную микробиоту кишечника6.
Заключение
Мультипробиотический комплекс Бак-Сет изготовлен на основе оригинальных штаммов микроорганизмов, включенных в Европейский реестр безопасности European Qualified Presumption of Safety. Бак-Сет Беби содержит семь штаммов микроорганизмов – Lactobacillus casei, L. rhamnosus, L. acidophilus, Bifidobacterium breve, B. infantis, B. longum, S. thermophilus, а также наиболее оптимальный для пищеварения детей раннего возраста пребиотик (фруктоолигосахариды из инулина), усиливающий действие пробиотических бактерий. Разрешен к применению у детей с рождения.
В состав Бак-Сет Форте входят 14 видов живых пробиотических бактерий в высоких концентрациях – L. casei, L. plantarum, L. rhamnosus, B. bifidum, B. breve, B. longum, L. acidophilus, L. lactis, S. thermophilus, B. infantis, L. bulgaricus, L. helveticus, L. salivarius, L. fermentum.
Широкий спектр функций пробиотических штаммов в составе препарата Бак-Сет позволяет использовать их для комплексной многоуровневой регуляции состояния микробиоты у детей и взрослых. Его отличают высокая клиническая эффективность и хорошая переносимость.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.