К ак отметила в начале своего выступления д. м. н., профессор О.М. ЛЕСНЯК, президент Российской ассоциации по остеопорозу, зав. кафедрой семейной медицины ФПК и ПП ГБОУ ВПО УГМА, распространенность остеопороза является важнейшим показателем состояния здоровья населения. На сегодняшний день 34 млн россиян имеют риск низкоэнергетических переломов. Ежегодно в России отмечаются 100 тысяч случаев перелома проксимального отдела бедра.
Безусловно, перелом шейки бедра – самый тяжелый остеопоротический перелом. Мировым стандартом оказания медицинской помощи при переломе шейки бедра является оперативное лечение в первые дни после травмы, включая эндопротезирование сустава, при этом летальность в течение года составляет 20%. «В России нет стандарта оказания помощи больным с переломом проксимального отдела бедра, поэтому показатели смертности варьируют в разных регионах России. Так, в некоторых городах Сибири летальность после перелома шейки бедра достигает 50%. В то же время, например, в Ярославле, где скорая медицинская помощь обязана госпитализировать в травматологический стационар всех пациентов с переломами, а хирурги должны прооперировать пациента с переломом проксимального отдела бедра, этот показатель составляет 15%. В среднем же летальность после перелома проксимального отдела бедра при консервативном лечении равняется 39,3%, при оперативном лечении – 16,7%. Именно поэтому в нашей стране столь актуальна профилактика остеопоротических переломов», – подчеркнула докладчик.
Большая часть территории России располагается выше 55-го градуса северной широты, короткая продолжительность светового дня является существенным фактором риска развития дефицита витамина D. Немногочисленные пока российские исследования свидетельствуют о том, что дефицит витамина D испытывают все группы населения, особенно пожилые люди. Золотым стандартом диагностики остеопороза считается рентгеновская денситометрия, позволяющая определить минеральную плотность костной ткани (МПК). К сожалению, денситометров в российских медицинских учреждениях не хватает. Более 50% из них установлены в Москве, а в городах Сибири и Дальнего Востока, например, работают лишь 16 аппаратов. К тому же данный метод диагностики не всегда позволяет выявить остеопороз. Так, согласно данным Роттердамского исследования, только 20,7% мужчин и 44,1% женщин с периферическими переломами имели Т-критерий ниже -2,5стандартного отклонения (SD), соответствующий диагнозу «остеопороз». Это свидетельствует о том, что в развитии перелома играют роль и дополнительные факторы, наиболее важным среди которых является возраст.
Недавно Всемирная организация здравоохранения (ВОЗ) разработала новый универсальный метод выявления групп высокого риска остеопоротических переломов – FRAX (fracture risk assessment tool). «ВОЗ опубликовала принципиально новый подход к прогнозированию риска переломов – расчет 10-летнего абсолютного риска переломов на основе клинических факторов риска в комбинации с оценкой и без оценки показателей МПК в области шейки бедра. В алгоритме метода учтены несколько доказанных клинических факторов риска, которые не связаны и не зависимы от МПК, поэтому в сумме они улучшают оценку прогноза риска. В первую очередь это возраст и индекс массы тела, затем наличие переломов в анамнезе, курение, прием глюкокортикостероидов, злоупотребление алкоголем, наличие ревматоидного артрита. Расчет проводится с помощью компьютерной программы на сайте www. shef.ac.uk/FRAX. Ресурс доступен любому врачу, имеющему выход в Интернет», – пояснила Ольга Михайловна.
На сайте указано, что модель FRAX адаптируется для каждой страны. Пока российская модель FRAX находится в стадии разработки, в настоящее время при расчете рекомендуется использовать финскую модель в русскоязычном варианте*. Безусловно, FRAX имеет свои ограничения. Например, метод неприменим у женщин в пременопаузе и у мужчин до 50 лет, он не учитывает другие известные факторы риска переломов (падения, биохимические маркеры, УЗ и др.), градации некоторых факторов риска (доза глюкокортикостероидов, интенсивность курения, количество перенесенных переломов и др.), зависит от адекватности эпидемиологической информации, модель разработана не для каждой страны и используется для определения риска только у нелеченых больных. Тем не менее применение FRAX для прогнозирования риска переломов позволяет более точно характеризовать степень риска и назначать лечение в зависимости от достижения определенного порога вмешательства.
Завершая свое выступление, профессор О.М. Лесняк подчеркнула, что Российская ассоциация по остеопорозу рекомендует на основании клинического диагноза назначать противоостеопоротическую терапию всем больным с переломами позвонков и проксимального отдела бедра, а также использовать FRAX для прогнозирования риска переломов у всех женщин в постменопаузе и у мужчин старше 50 лет.
* Прим. ред. С января 2012 г. доступна российская модель FRAX. Дополнительная информация – на сайте www.osteoporoz.ru
«Гормонально-ассоциированные заболевания репродуктивной системы: от новых научных концепций к тактике ведения» Оказывает более значимый эффект увеличения костеобразования, независимо от исходного уровня, по сравнению с алендронатом. Эти данные не умаляют эффективности бисфосфонатов для снижения частоты переломов, а доказывают значимый положительный эффект стронция ранелата на костеобразование и повышение прочности кости», – подчеркнула профессор Л.Я. Рожинская.
Согласно Клиническим рекомендациям по диагностике, профилактике и лечению остеопороза Российской ассоциации по остеопорозу (2009), стронция ранелат относится к препаратам первой линии терапии остеопороза. В заключение профессор Л.Я. Рожинская отметила, что основной целью терапии является снижение риска переломов, а для ее достижения необходимо подавлять избыточную резорбцию кости, стимулировать костеобразование, оптимизировать распределение костной ткани, увеличивать силу и прочность кости. И на сегодняшний день получены убедительные доказательства благоприятного влияния Бивалоса на микроархитектонику как кортикальной, так и трабекулярной кости, его способности стимулировать синтез новой, прочной костной ткани за счет уникального двойного механизма действия.
Профессор И.Е. ЗАЗЕРСКАЯ, зам. директора Института перинатологии и педиатрии ФГУ «ФЦСКЭ им. В.А. Алмазова», д. м. н., в своем докладе акцентировала внимание участников симпозиума на известных факторах риска развития остеопении и остеопороза у женщин репродуктивного возраста. «Вероятность развития остеопороза у женщины в раннем постменопаузальном периоде зависит, прежде всего, от того, как протекал первый тридцатилетний отрезок ее жизни, какой была костная масса, адекватно ли развивалось костное ремоделирование. Вторая причина развития остеопороза может заключаться в высокой скорости снижения минеральной плотности костной ткани. Наконец, следует учитывать все факторы, связанные с гипоэстрогенемией, которые препятствуют правильному формированию костной массы. По нашим данным, остеопения поясничного отдела позвоночника выявляется у 12% молодых женщин в возрасте 20–44 лет и 42% женщин в возрасте 45–49 лет», – пояснила Ирина Евгеньевна. Возможными причинами нарушений ремоделирования костной ткани в репродуктивном возрасте могут являться гипо- и гипергонадотропная недостаточность яичников, аменорея, связанная с физическими нагрузками, нервная анорексия, гиперпролактинемия.
По данным Ирины Евгеньевны Зазерской, 30% девочек-подростков с нарушением менструального цикла имеют остеопенический синдром. Вторичная аменорея в репродуктивном возрасте, особенно в период полового созревания, играет важную роль в развитии более тяжелой степени остеопороза в менопаузе. Гиперпролактинемия также ассоциируется со снижением минеральной плотности костной ткани, степень снижения МПК коррелирует с длительностью аменореи. Функциональная гиперпролактинемия не создает такого неблагоприятного воздействия на костный метаболизм, как гиперпролактинемия, обусловленная пролактиномой. Именно этот вид гиперпролактинемии неблагоприятно влияет на костный метаболизм, что на ранней стадии демонстрирует динамика маркеров костного обмена, в дальнейшем это приводит к снижению МПК и переломам. Независимо от уровней пролактина, нормальный менструальный цикл является основным прогностическим критерием сохранения МПК. Если у пациентки сохраняется регулярный менструальный цикл, то она не относится к группе риска по развитию остеопении и остеопороза.
Лечение ряда гинекологических состояний должно сопровождаться оценкой костного обмена. Существуют определенные трудности диагностики нарушений костного обмена у молодых женщин с нарушением менструального цикла (НМЦ). Денситометрия регистрирует уже произошедшие нарушения, но не отражает метаболических изменений в костной ткани. Стандартное и рутинное определение суточной экскреции кальция с мочой натощак по отношению к концентрации креатинина в этой же порции не отражает метаболических изменений, которые происходят непосредственно в костной ткани у девочек с нарушением менструального цикла. Этот метод не является маркером диагностики подобных нарушений.
«Мы провели исследование ряда биохимических маркеров у данной категории молодых женщин и увидели достоверные изменения в количественном определении бета-изомера С-терминального телопептида коллагена первого типа (β-СТТК). Исследование β-СТТК как маркера костной резорбции позволяет диагностировать остеопенический синдром, прогнозировать темпы костных потерь и мониторировать эффективность лечения у девочек-подростков с НМЦ. Менее значимо определение маркера костной резорбции у пациенток пубертатного возраста с нарушением менструального цикла и гиперандрогенией.
Цель лечения – достижение целевого уровня эстрадиола, оптимальным является уровень Е2 60–150 пг/мл», – подчеркнула профессор И.Е. Зазерская. Беременность не относится к достоверным факторам риска развития остеопороза, но с первых дней беременности происходит изменение костного обмена. Развивающийся плод накапливает кальций, 80% накопления приходится на III триместр беременности. Физиологическая беременность сопровождается снижением уровня паратиреоидного гормона, усиленной выработкой активной формы витамина D, протеина, связанного с паратгормоном, и кальцитонина. Снижение минеральной плотности костной ткани во время беременности может проявляться на фоне дефицита кальция.
Профессор И.Е. Зазерская представила результаты проведенного в своей клинике исследования, которое показало, что частота встречаемости остеопении позвоночника и предплечья на 4–6-й день послеродового периода была достоверно выше в подгруппе рожениц, принимавших 800 мг кальция в сутки (47% и 37%), чем в подгруппе женщин, получавших более 800 мг в сутки (19% и 11%). По словам докладчика, большинство авторов указывают на то, что лактация также является стрессовым фактором для костной ткани, поскольку для сохранения костной массы в послеродовом периоде требуется повышенный уровень кальция и витамина D. По данным ученых, имеет значение длительность лактации.
Завершая выступление, профессор И.Е. Зазерская констатировала: «Характер распределения МПК в послеродовом периоде такой же, как и у небеременных женщин репродуктивного возраста. Физиологическая беременность протекает на фоне повышенной потребности в кальции, но снижение МПК происходит только в случае недостаточного его потребления. Адекватной дозой потребления кальция при беременности можно считать 1000–1200 мг в сутки, в послеродовом периоде – более 1200 мг. Сохранение регулярного менструального цикла у молодых женщин репродуктивного возраста является основным прогностическим критерием сохранения МПК. Все факторы, связанные с гиперэстрогенемией, препятствуют формированию костной массы». - уточнила Светлана Владимировна.
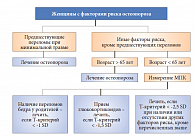
К наиболее значимым факторам риска остеопороза и переломов относятся: низкотравматичные переломы после 40 лет, наследственность, возраст старше 65 лет, дефицит эстрогенов, гипогонадизм, вредные привычки (курение, алкоголизм), низкий индекс массы тела (ИМТ), сопутствующие заболевания, прием лекарственных препаратов. При обращении за врачебной помощью женщин моложе 65 лет необходимо учитывать также вторичные причины остеопороза, наиболее частыми среди которых является дефицит или недостаточность витамина D. По мнению докладчика, не всем пациенткам следует назначать остеоденситометрию, а только женщинам в возрасте 65 лет и старше, женщинам в период постменопаузы, но моложе 65 лет, если у них выявлены факторы риска, имеются переломы в анамнезе и заболевания/состояния, приводящие к снижению костной массы.
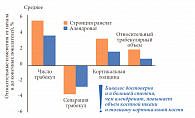
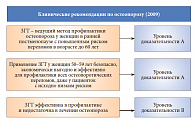
Профессор С.В. Юренева назвала основные подходы к ведению пациенток с остеопорозом – это оценка риска переломов, коррекция факторов риска остеопороза, исключение вторичных причин заболевания, оценка уровня витамина D (25-гидроксикальциферол) в крови и коррекция его недостаточности (< 20 нг/мл) или дефицита (< 10 нг/мл), выбор препарата для лечения остеопороза (рис. 4). Как известно, дефицит эстрогена приводит к избыточной костной резорбции (рис. 5). Большинство препаратов для лечения остеопороза – стронция ранелат, бисфосфонаты, кальцитонин, ЗГТ – подавляют резорбцию костной ткани. «Среди этих препаратов только стронция ранелат (Бивалос) обладает уникальным двойным механизмом действия – подавляя костную резорбцию, он одновременно стимулирует образование костной ткани, изменяя, таким образом, баланс ремоделирования в пользу формирования кости. На сегодняшний день имеется доказательная база эффективности стронция ранелата (Бивалоса) в лечении пациенток с постменопаузальным остеопорозом (ПО) в возрасте 50–65 лет»,– отметила профессор С.В. Юренева.
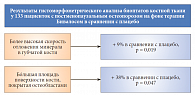
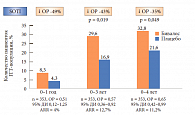
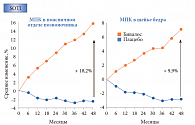
Препараты для лечения остеопороза в целом оценивают по их способности предотвращать два типа переломов: переломы позвонков и переломы шейки бедра. В исследовании клинической эффективности Бивалоса SOTI участвовали пациентки, средний возраст которых составлял 60 лет, большинство из них уже имели переломы позвонков, каждая пятая – периферический перелом или остеопороз шейки бедра. Пациентки, входившие в контрольную группу, в течение четырех лет получали терапию препаратом Бивалос. Согласно анализу данных, у пациенток в раннем периоде менопаузы, принимавших Бивалос, за 4 года достоверно снизился риск перелома позвонков на 35%, риск клинических переломов – на 52% (рис. 6). Кроме того, на фоне лечения Бивалосом в течение 4 лет отмечалось достоверное увеличение МПК поясничных позвонков на 18% и МПК шейки бедра на 10% (рис. 7).
Стронция ранелат обладает еще одним положительным эффектом – он стимулирует образование матрикса хряща у человека. В исследовании SOTI было доказано, что у здоровых женщин и у пациенток с остеоартрозом стронция ранелат (Бивалос) демонстрирует структурно-модифицирующий эффект, что проявляется увеличением синтеза коллагена 2 типа и протеогликана в отсутствие стимуляции хондрорезорбтивного процесса. «У пациенток на фоне лечения стронция ранелатом (Бивалосом) на протяжении трех лет мы видим достоверное снижение уровня маркера СТХ II, который характеризует распад в хрящевой ткани. На фоне лечения Бивалосом на треть уменьшалось количество пациенток с болями в спине. Качество жизни этих пациенток, получавших Бивалос в течение трех и четырех лет, было существенно выше качества жизни пациенток, получавших плацебо», – пояснила профессор С.В. Юренева.
Докладчик также остановилась на такой важной характеристике препарата, как переносимость, отметив, что в целом препарат хорошо переносится пациентами, а его наиболее частыми нежелательными эффектами были тошнота и диарея. Докладчик ознакомила участников симпозиума с результатами исследования переносимости стронция ранелата в реальной клинической практике («Комплаенс при терапии стронция ранелатом в реальной клинической практике, 2010»). В исследовании приняли участие 13 069 женщин с постменопаузальным остеопорозом, получавших лечение стронция ранелатом. Средний возраст составлял 68,9 лет, 42% пациенток имели один перелом позвонка в анамнезе. Результаты показали значительную приверженность участниц исследования к приему стронция ранелата: через 12 месяцев его продолжали принимать 80% пациенток, через 24 месяца – 70% пациенток. Бивалос удобен в применении: ежедневно принимается 1 саше, содержание которого разводится в воде. Препарат лучше принимать перед сном, но можно и в течение дня, не ранее чем через 2 часа после еды.
Подытоживая вышесказанное, профессор С.В. Юренева сформулировала следующие выводы: заместительная гормональная терапия – первая линия профилактики остеопороза, Бивалос – препарат первой линии терапии постменопаузального остеопороза с доказанной эффективностью у женщин в возрасте до 60 лет; Бивалос улучшает качество жизни пациенток; Бивалос хорошо переносится, что обеспечивает высокую приверженность пациенток лечению.
Заместительная гормональная терапия – первая линия профилактики остеопороза у женщин в постменопаузе, Бивалос – препарат первой линии терапии с доказанной эффективностью в лечении ПО у женщин в возрасте до 60 лет. Бивалос улучшает качество жизни пациенток. Препарат хорошо переносится, что обеспечивает высокую приверженность лечению.
Остеопороз является широко распространенным заболеванием среди женщин в постменопаузе. С возрастом цикл костного ремоделирования характеризуется более высокой скоростью костной резорбции по сравнению с процессом формирования кости, что приводит к потере костной массы. Прорывом в терапии остеопороза стало появление препарата Бивалос (стронция ранелат), который стимулирует образование костной ткани при одновременном подавлении костной резорбции. Бивалос подтвердил свою эффективность в снижении риска переломов позвонков и внепозвоночных переломов, включая переломы шейки бедра, у пациенток с постменопаузальным остеопорозом. Бивалос благоприятно влияет на микроархитектонику как кортикальной, так и трабекулярной кости, отличается хорошей переносимостью и существенно улучшает качество жизни пациенток. Эти преимущества обосновывают применение Бивалоса в качестве препарата первой линии для лечения женщин с постменопаузальным остеопорозом.