Проблема церебрально-костных взаимодействий в клинике неврологических заболеваний
- Аннотация
- Статья
- Ссылки
- English

Введение
Увеличение продолжительности жизни – одно из самых заметных и значимых достижений современного общества. Согласно данным Всемирной организации здравоохранения, в 2024 г. во всем мире ожидаемая продолжительность жизни при рождении достигла 73,3 года, что на 8,4 года больше, чем в 1995 г. При этом прогнозируется увеличение числа лиц в возрасте 60 лет и старше с 1,1 млрд в 2023 г. до 1,4 млрд к 2030 г. [1]. Этот демографический сдвиг имеет серьезные последствия для общественного здравоохранения. Персонализированный подход, направленный на профилактику потенциально инвалидизирующих заболеваний, способен внести значимый вклад в поддержание независимости от посторонней помощи и качества жизни пожилых людей, сохраняя их способность активно участвовать в жизни общества. Реализация стратегий укрепления здоровья на протяжении всей жизни и профилактики развития болезней может существенно снизить риск развития ряда неинфекционных и хронических заболеваний, а также функциональных нарушений, раннее выявление и лечение которых являются важными мерами, которые помогут минимизировать негативные последствия.
Одним из распространенных заболеваний, в наибольшей степени поражающим пожилых пациентов, является остеопороз (ОП), который характеризуется повышенным риском переломов из-за снижения массы и/или качества костной ткани. Им страдают более 35% пожилых женщин и 12% пожилых мужчин во всем мире [2].
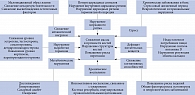
Основные внутренние и внешние факторы, повышающие риск развития ОП, включают механическую разгрузку (уменьшение физической активности), дефицит питательных веществ, гормональные эффекты, нарушение обмена веществ, снижение когнитивных функций, хроническое воспаление и нарушение циркадного ритма (рис. 1) [3]. Эти факторы, независимо от того, действуют они по отдельности или в сочетании, нарушают костное ремоделирование, что приводит к уменьшению массы и прочности кости и соответственно к повышению риска переломов [3].
Механизмы церебрально-костных взаимодействий
Скелетная система не является изолированным образованием. Она связана с соседними и удаленно расположенными тканями, которые взаимодействуют через эндокринную, иммунную, сердечно-сосудистую, мышечную и нервную системы.
Новой областью знаний является нейронная регуляция метаболизма костей и ось «мозг – кость», раскрывающая сложную двунаправленную связь между центральной нервной системой (ЦНС) и костной тканью. Взгляд на нервную систему (НС) и скелет как на морфологические структуры с отдельными функциями был изменен на основании результатов исследований, продемонстрировавших роль нейрональной регуляции костного ремоделирования и гомеостаза [4, 5]. Это новое направление обозначило тесно переплетенную двунаправленную связь между головным мозгом и костью, изменяя традиционное представление о скелете как об исключительно опорной системе, аккумулирующей кальций [6]. Иннервация скелета описывалась и ранее, однако только в недавних исследованиях показано, что метаболизм костной ткани строго регулируется НС [7].
Взаимодействие ЦНС с костной тканью представляет собой сложный и многогранный процесс, в котором участвуют различные сигнальные пути, нейроэндокринные факторы и молекулярные медиаторы. Эти элементы обеспечивают тесную связь между головным мозгом и метаболическими процессами в костной ткани. Нервная система оказывает значительное влияние на ремоделирование костной ткани через различные нервные пути, включая симпатическую нервную систему, нейропептиды, вырабатываемые гипоталамусом, и нейромедиаторы. В свою очередь факторы, вырабатываемые костной тканью, оказывают влияние на работу мозга и поведенческую сферу. Изучение церебрально-костных взаимодействий не только улучшает понимание сложных коммуникаций между, казалось бы, мало связанными физиологическими системами организма, но и открывает новые перспективы в решении проблемы скелетных и неврологических расстройств.
В 1868 г. французский невролог Ж.-М. Шарко подробно описал патологию суставов с прогрессирующей дегенерацией костей и мягких тканей у пациентов с tabes dorsalis, осложнением нелеченого сифилиса, приводящим к дегенерации сенсорных нервов в задних столбах спинного мозга [8]. Ж.-М. Шарко предположил, что нервы в костях имеют трофическую природу. Повреждение нервов может нарушить подачу факторов роста к костям и суставам, приводя к их разрушению. Таким образом, Ж.-М. Шарко заложил основу нейротрофической теории здоровья костей.
Активное изучение вклада ЦНС в регуляцию ремоделирования костей и гомеостаза началось чуть более 20 лет назад с оценки связи уровня лептина со значениями трабекулярного костного индекса [9]. Обнаружено, что коммуникации НС и кости играют определяющую роль в регуляции энергии и костном метаболизме. Вслед за этим ключевым открытием был проведен каскад исследований, посвященных проблеме церебрально-костных коммуникаций.
Церебрально-костный интерфейс охватывает множество сигнальных взаимодействий, нейроэндокринных факторов и молекулярных медиаторов, которые организуют перекрестные коммуникации между НС и костным метаболизмом. Помимо лептина эти пути включают серотонин, адипонектин, нейропептид Y, мускариновые рецепторы, никотиновые рецепторы, β-адренорецепторы и иннервацию кости [5, 10]. Центральная нервная система осуществляет значительный контроль над ремоделированием костей через периферическую нервную систему, включая симпатический [11, 12] и парасимпатический отделы, а также гипоталамические нейропептиды [13, 14] и нейротрансмиттеры [15]. В свою очередь остеогенные факторы, такие как остеокальцин [16, 17] и фактор роста фибробластов 23 (FGF23) [18, 19], влияют на функции мозга, проникая через гематоэнцефалический барьер и модулируя когнитивные процессы, память и настроение.
Гипоталамус, представляющий собой ключевой регулятор гомеостатических процессов в ЦНС, играет фундаментальную роль в контроле метаболизма костной ткани на центральном уровне. Несколько нейропептидов, вырабатываемых гипоталамусом, такие как нейропептид Y, кокаин-амфетамин-регулируемый транскрипт, нейромедин U и пептид, высвобождающий гормон роста, принимают участие в регуляции ремоделирования костной ткани, воздействуя на этот процесс как прямо, так и косвенно [3, 20–23].
Помимо нейропептидов в регуляции обмена веществ в костной ткани участвуют несколько нейромедиаторов, которые действуют как через центральные, так и через периферические механизмы. К этим нейромедиаторам относятся серотонин, дофамин, глутамат и γ-аминомасляная кислота [24].
Периферическая НС активно вовлечена в церебрально-костные взаимодействия. Интероцепция регулирует физиологическую активность внутренних органов и поддерживает метаболический гомеостаз организма [25]. Скелетная интероцепция поддерживает постоянное ремоделирование костей и метаболический гомеостаз скелета. Способность к локальному высвобождению нейропептидов свидетельствует в пользу трофической роли сенсорных нервов в кости. Действительно, трофические сигналы и болевая чувствительность, а также регуляция кровотока являются неотъемлемыми компонентами нервной регуляции костей [26].
Симпатическая НС играет ключевую роль в регуляции центрального контроля ремоделирования костей. Симпатические нервные волокна напрямую контактируют с остеобластами и остеокластами. Норадреналин, основной нейромедиатор симпатической НС, связывается с β2-адренергическими рецепторами (β2-АР), экспрессируемыми на остеобластах, инициируя каскад сигнальных событий, которые приводят к подавлению остеогенеза и формирования костей и стимуляции костной резорбции [12]. Обнаруженные на остеобластах и остеокластах β-АР играют решающую роль в симпатической регуляции костного метаболизма [11]. Активация β2-АР на остеобластах приводит к снижению их пролиферации и дифференциации, одновременно повышая регуляцию экспрессии лиганда рецепторного активатора ядерного фактора-κB (RANKL) [27]. В свою очередь RANKL стимулирует дифференцировку и активность остеокластов, тем самым способствуя костной резорбции. Влияние симпатической НС на костную ткань демонстрируют клинические и экспериментальные данные, что подтверждает остеопротективное действие β-адреноблокаторов – значительно снижается риск остеопороза и переломов, в том числе указывается на предотвращение развития остеонекроза челюсти, вызванного приемом бисфосфонатов, за счет стимуляции остеогенеза [28, 29].
Парасимпатическая НС также участвует в регуляции ремоделирования костей, уравновешивая катаболические эффекты симпатической НС [30]. Холинергические нервные волокна в непосредственной близости от костных клеток экспрессируют нейротрансмиттер ацетилхолин, который оказывает анаболическое воздействие на скелет, связываясь с никотиновыми ацетилхолиновыми рецепторами, экспрессируемыми на остеобластах, и способствуя их пролиферации и дифференцировке [31]. В исследованиях in vivo продемонстрировано, что стимуляция блуждающего нерва приводит к увеличению костной массы у мышей [32].
Костно-церебральный вектор коммуникации обеспечивают остеокины, которые проникают через гематоэнцефалический барьер и участвуют в регуляции различных аспектов функционирования ЦНС, включая когнитивные процессы, память и настроение, оказывают значимое воздействие на церебральные функции [33]. Среди ключевых факторов, выделяемых костью и участвующих в регуляции работы мозга, можно выделить остеокальцин и FGF23. Остеокальцин, остеогенный гормон, необходим для активации реакции на острый стресс посредством ингибирования парасимпатической НС [34]. В частности, остеокальцин может проникать через гематоэнцефалический барьер, усиливать синтез серотонина, дофамина и норадреналина, подавлять секрецию γ-аминомасляной кислоты и связываться с нейронами ствола, среднего мозга и гиппокампа [35]. Остеокальцин может функционировать как гормон, регулирующий метаболизм глюкозы и энергии, а также влияющий на работу мозга и поведение [15]. Определение остеокальцина и FGF23 как факторов, вырабатываемых костями и влияющих на ЦНС, имело важное значение для понимания сложных взаимодействий скелетной и нервной систем и позволило сделать вывод, что кость не просто мишень для нервной регуляции, а активный эндокринный орган, который может модулировать работу мозга и поведение. Необходимы дальнейшие исследования для уточнения механизмов, лежащих в основе влияния остеокинов на мозг, определения терапевтического потенциала воздействия на эти сигнальные пути при патологии ЦНС [36].
Основной функцией FGF23 является поддержание гомеостаза фосфатов. Однако в недавних исследованиях показано, что FGF23 также может влиять на работу мозга и поведение, проникая через гематоэнцефалический барьер и связываясь с рецепторами FGF, экспрессируемыми в различных областях головного мозга, включая гиппокамп, кору головного мозга и гипоталамус. Продемонстрировано, что FGF23 ухудшает синаптическую пластичность в гиппокампе и когнитивные функции за счет снижения экспрессии нейротрофического фактора мозга и других синаптических белков [37]. Фактор роста фибробластов 23 также участвует в регуляции нейровоспаления и окислительного стресса в мозге. Повышенный уровень FGF23 связан с повышенной экспрессией провоспалительных цитокинов и активных форм кислорода в гиппокампе и коре головного мозга, что может вносить вклад в патогенез когнитивных нарушений [38]. Это позволяет предположить, что остеокальцин и FGF23 потенциально могут служить биомаркерами, указывающими на вероятность снижения когнитивных функций и появления нейропсихиатрических расстройств.
Костные морфогенетические белки представляют собой важнейшие факторы роста, которые играют ключевую роль в развитии костной ткани и поддержании ее метаболизма. В последние годы все больше исследований подтверждают, что эти белки и их сигнальные пути тесно связаны с различными неврологическими заболеваниями [39] в контексте нейродегенеративных расстройств, таких как болезнь Альцгеймера и болезнь Паркинсона, а также в контексте восстановления после ишемических и геморрагических инсультов [40, 41].
Таким образом, ось «мозг – кость» важна для скелетного метаболизма, церебральной функции, сенсорной иннервации и эндокринных взаимодействий между этими органами. Значительные клинические данные по многим категориям неврологических заболеваний указывают на то, что изменения в НС связаны с нарушениями физиологии кости, что приводит к снижению минеральной плотности костной ткани (МПКТ), изменению микроархитектоники кости, снижению прочности кости и в конечном итоге к развитию остеопении/остеопороза и повышенному риску переломов. Неслучайно в последнее время немалое внимание уделяется изучению связи ОП с различными неврологическими расстройствами.
Связь остеопороза с неврологическими расстройствами
Когнитивные нарушения и ОП зачастую сопутствуют друг другу. Результаты исследований позволяют предположить наличие причинно-следственной связи между этими состояниями [42]. Согласно данным метаанализа, проведенного в 2022 г. и включившего восемь крупномасштабных исследований (суммарно 136 222 участника), пациенты с ОП подвержены повышенному риску когнитивных нарушений, лечение ОП может предотвратить или отсрочить снижение когнитивных функций у лиц из группы риска [43].
Болезнь Альцгеймера приводит к одним из самых тяжелых когнитивных расстройств. Данная патология связана с накоплением β-амилоида (Aβ). Показано, что Aβ может усиливать активацию остеокластов, индуцированную RANKL, что в свою очередь приводит к увеличению резорбции кости [44]. Кроме того, остеокальцин, один из маркеров костеобразования, может не только отражать уровень трансформации костей у пациентов с ОП, но и указывать на степень когнитивных нарушений. Потеря эффектов остеокальцина способна привести к нарушениям пространственного обучения и памяти [45]. Сформировалось представление об общих факторах риска, которые способны привести к когнитивным нарушениям и ОП: старение, депрессия, снижение социальной активности, изменение уровня половых гормонов, дефицит кальция и витамина D, изменение эффектов цитокинов [43, 46].
Кроме того, паратиреоидный гормон может представлять собой клинически важную связь между когнитивной функцией и здоровьем костей в качестве регулятора метаболизма кальция и фосфатов. Установлено, что данный гормон способен преодолевать гематоэнцефалический барьер. Гиперпаратиреоз ассоциирован не только с потерей костной массы за счет активации остеокластов, но и с развитием физической слабости, а также когнитивных нарушений [47]. Описаны случаи возникновения церебральных нарушений у пациентов с гипопаратиреозом, что требует дополнительного внимания к состоянию фосфорно-кальциевого обмена у лиц с различными неврологическими расстройствами [48].
Особую важность представляет изучение влияния ОП на развитие и течение сосудистой патологии головного мозга. Низкая МПКТ может быть связана с церебральной микроангиопатией, а также указывать на более тяжелое клиническое течение цереброваскулярной патологии и высокий риск развития сосудистой деменции [49, 50].
Обнаружена связь между состоянием костной ткани и ишемическим инсультом. Низкая МПКТ может не только указывать на риск развития нарушений мозгового кровообращения (НМК), но и влиять на отдаленные последствия ишемического инсульта [51, 52]. Кроме того, есть основания полагать, что низкая МПКТ может быть связана с ухудшением когнитивных функций как в острый период НМК, так и в период восстановления после инсульта [53].
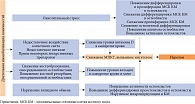
В свою очередь инсульт является фактором риска развития ОП, падений и переломов. Пациенты, недавно перенесшие инсульт, редко проходят обследование и получают лечение по поводу ОП, что может повышать вероятность переломов [54, 55]. Риск переломов у лиц, перенесших инсульт, в четыре раза выше. У 3–6% пациентов, перенесших НМК, переломы случаются в течение одного года после инсульта [56]. Характер потери костной массы, наблюдаемый у пациентов с инсультом, отличается от такового у лиц с постменопаузальным ОП. Потеря костной массы может ограничиваться парализованной стороной и быть более выраженной в верхних конечностях. У пациентов с НМК существует много причин развития ОП, включая ограничение физической активности и снижение нагрузки из-за паралича, недостаточность питания из-за расстройств пищевого поведения, прием различных лекарств и снижение витамина D из-за нехватки солнечного света (риc. 2) [57].
Ускоренная потеря МПКТ [58] может привести к переломам у выживших после инсульта, а ограничение нагрузки на пораженную конечность – к потере костной массы. У больных, перенесших НМК, большинство переломов происходит на гемиплегичной стороне тела, поскольку на поврежденной стороне МПКТ на 4,6–14,0% ниже, чем на неповрежденной [59]. Социальная депривация, недоедание, уменьшение воздействия солнца и последующий дефицит витамина D ускоряют потерю костной массы у выживших после инсульта [60]. Потеря костной массы начинается сразу после НМК, продолжается в течение трех-четырех месяцев после инсульта и далее более медленными темпами в течение года [61]. Кроме того, у пациентов, перенесших инсульт, могут иметь место различные неврологические дефициты, которые способны привести к снижению физической активности и использования парализованной конечности, что также может обусловливать потерю костной массы. Патогенез постинсультного ОП не вполне ясен [62]. Речь идет о потенциально сложной причинно-следственной связи между сосудистой патологией головного мозга и ОП.
Не существует конкретных рекомендаций по скринингу ОП у больных, перенесших НМК, несмотря на доказательства того, что после инсульта риск переломов повышен из-за хрупкости кости. Старение населения и все возрастающее бремя инсульта подчеркивают необходимость разработки рекомендаций по скринингу ОП и инструментов для оценки риска развития такового, специфичных для пациентов, перенесших НМК [57].
Неврологические заболевания, ассоциированные с расстройствами движения и сопровождающиеся снижением физической активности, вносят дополнительный вклад в изменение костной структуры. Поскольку малоподвижный образ жизни не обеспечивает достаточной нагрузки для поддержания костной и мышечной массы, риск переломов повышается [63]. Кроме того, психологические факторы, такие как отсутствие мотивации, социальная изоляция и страх падения, еще больше могут препятствовать физической активности [64]. Стресс также связан с более низкой МПКТ и повышенным риском переломов [65]. Во время длительного стресса активируется ось «гипоталамус – гипофиз – надпочечники», что приводит к повышению содержания кортизола и, следовательно, нарушению баланса в ремоделировании костей [66].
Болезнь Паркинсона (БП) является самым быстрорастущим по частоте встречаемости неврологическим расстройством. Определяющими его признаками являются тремор, мышечная ригидность, брадикинезия и постуральная неустойчивость, которые в сочетании с немоторными симптомами, такими как когнитивные нарушения и ортостатическая гипотензия, увеличивают риск падений. Наряду с низкой минеральной плотностью костей при БП высок риск переломов.
Сочетание тремора, ригидности и брадикинезии с немоторными симптомами, которые также широко распространены и неоднородны, включая ортостатическую гипотензию, когнитивные нарушения, мышечную слабость/саркопению и нарушение питания, оказывает значительное влияние на качество жизни пациентов с БП и лиц, осуществляющих уход за ними. Сочетание моторных и немоторных симптомов обусловливает высокий риск падений [67]. При этом примерно у 60% пациентов с БП случается как минимум одно падение в год [68]. Наряду с ОП повышенный риск падений обусловливает высокий уровень переломов при БП. Скрининг и стратегии терапии ОП должны быть включены в руководящие принципы лечения БП. Предоставление конкретных рекомендаций, связанных со здоровьем костей, в национальных руководящих принципах по остеопорозу должно быть приоритетом, учитывая высокую нагрузку переломов у пациентов [69]. Рекомендации по оценке состояния костной системы представлены на рис. 3 [69].
Лечение остеопороза у пациентов с неврологическими расстройствами
Наличие неврологических расстройств вносит дополнительную сложность и формирует потенциальные барьеры при назначении антиостеопоротических препаратов из-за распространенных двигательных нарушений и немоторных симптомов, таких как дисфагия, замедленная моторика кишечника, мальабсорбция и когнитивные нарушения, в дополнение к сложной схеме приема лекарственных препаратов. Профилактика низкотравматических переломов является доминирующей стратегией в антиостеопоротической терапии [70].
Пероральные бисфосфонаты, которые подавляют резорбцию костей, как правило, являются первой линией лечения. Однако пероральный прием бисфосфонатов может быть трудновыполнимым из-за дисфагии и строгого графика лечения (рано утром натощак с дальнейшим поддержанием вертикального положения во время голодания в течение 30 минут и более после приема препарата). Подобные ограничения делают терапию пероральными бисфосфонатами мало применимой у большой категории пациентов с неврологическими заболеваниями самого разного генеза.
Наиболее эффективным препаратом из группы бисфосфонатов считается золедроновая кислота (по 5 мг внутривенно капельно один раз в 12 месяцев), показанием к назначению которой является постменопаузальный остеопороз, остеопороз у мужчин и глюкокортикостероидный остеопороз. Внутривенное введение золедроновой кислоты обычно проводится в течение трех лет, что сопровождается существенным снижением риска переломов, в частности относительным снижением риска переломов непозвоночных костей на 40% и позвоночных костей на 75% [71]. Однако если на фоне лечения ОП отмечается отсутствие желаемого прироста минеральной плотности кости или развивается низкоэнергетический перелом, то оно может быть продлено. В этом отношении показательны результаты многоцентрового рандомизированного двойного слепого плацебо-контролируемого клинического исследования HORIZON-RFT у пациентов, перенесших оперативное лечение по поводу перелома шейки бедренной кости. Риск развития новых переломов бедра снизился на 35%, вероятность смерти от всех причин сократилась на 28% в группе пациентов, получавших золедроновую кислоту, по сравнению с группой плацебо [72].
Назначение золедроновой кислоты имеет преимущества не только с позиции динамики МПКТ. Оно может быть клинически обоснованным у пациентов с нарушением глотания, когнитивными нарушениями и расстройствами движений. Хотя профилактика переломов настоятельно рекомендуется, она остается сложной проблемой у пациентов с деменцией. Несколько вмешательств, направленных на снижение риска переломов, доказали свою эффективность. Рекомендуется прием добавок витамина D, особенно тем, у кого отмечается недостаточный его уровень в плазме и в анамнезе имели место падения. Ежегодные инфузии золедроновой кислоты рассматриваются в качестве решения проблем, связанных с плохой приверженностью к лечению пероральными препаратами, одновременно с этим они демонстрируют экономическую эффективность и уменьшают административную нагрузку на медицинский персонал [73]. В настоящее время эффективность золедроновой кислоты при БП оценивается в продолжающемся исследовании TOPAZ [74].
В современной стратегии развития медицинской и фармацевтической промышленности важное место отводится замене зарубежных препаратов отечественными.
В 2020 г. в рамках импортозамещения в клиническую практику был введен отечественный препарат золедроновой кислоты Остеостатикс®. При оценке безопасности и переносимости нового отечественного генерического препарата золедроновой кислоты (Остеостатикс®) в условиях реальной клинической практики у больных ОП частота нежелательных реакций не превышала таковую при использовании оригинального препарата золедроновой кислоты [75].
Вопросы плейотропного влияния терапии ОП требуют отдельного рассмотрения. Воспаление и отек мозга часто ухудшают функциональный прогноз у пациентов с инсультом. В связи с этим особый интерес представляют исследования, в которых установлено, что введение золедроновой кислоты после инсульта значительно подавляет церебральное воспаление, ослабляя ишемическое нейрональное повреждение [76].
Возрастное снижение когнитивных способностей может усиливаться из-за побочных эффектов лекарств. Сообщалось, что у пожилых женщин и мужчин с ОП когнитивные функции оставались стабильными через 12 месяцев после первого приема золедроновой кислоты [77]. Следует отметить удобный режим дозирования препарата (один раз в год), что важно с учетом данных о низкой приверженности к лечению больных с сосудистой патологией головного мозга [78]. У пациентов с широким спектром неврологических нарушений золедроновая кислота является препаратом выбора.
Заключение
На сегодняшний день получено множество научных доказательств тесной связи между ОП и различными неврологическими заболеваниями, которые могут сопровождаться иммобилизацией, влиять на когнитивные способности, увеличивать риск переломов. Терапия ОП у лиц с неврологическими расстройствами имеет ряд особенностей, которые необходимо учитывать в клинической практике. Продолжение исследований в этой области представляется особенно актуальным, поскольку эти состояния существенно влияют на качество жизни и уровень функциональной независимости пациентов. Рассмотрение церебрально-костных взаимодействий открывает новые горизонты в разработке персонализированных стратегий ранней диагностики и профилактического лечения как ОП, так и ряда заболеваний головного мозга.
K.V. Antonova, MD, PhD, T.S. Shishkina
FSBSI ‘Research Center of Neurology’
Contact person: Ksenia V. Antonova, kseniya.antonova@mail.ru
The concept of cerebral-bone interactions is presented, and modern knowledge about the mechanisms that implement such a complex relationship is summarized. The processes of neuronal regulation of bone remodeling and homeostasis, as well as the influence of osteogenic factors on brain function are considered. The article analyzes osteoporosis in patients with common neurological conditions, such as cerebrovascular diseases, Alzheimer's disease, and Parkinson's disease. It also discusses bone loss after immobilization and the therapy of osteoporosis to prevent pathological fractures and increase bone mineral density in neurological patients.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


