Ботулинотерапия в лечении гипертрофических рубцов
- Аннотация
- Статья
- Ссылки
- English
Цель – рассмотреть патогенез гипертрофических рубцов, исследовать механизм ботулинического токсина в терапии гипертрофических рубцов.
Результаты клинических примеров показывают, что внутриочаговые инъекции ботулотоксина безопасны и эффективны и в комбинации с другими методами лечения приводят к уменьшению субъективных ощущений и выраженности рубцов.
Заключение. Ботулинотерапия в комбинации с другими методами является альтернативным методом лечения гипертрофических рубцов. При лечении ботулотоксином отмечается улучшение внешнего вида рубцов как по субъективным, так и по объективным оценкам.
Цель – рассмотреть патогенез гипертрофических рубцов, исследовать механизм ботулинического токсина в терапии гипертрофических рубцов.
Результаты клинических примеров показывают, что внутриочаговые инъекции ботулотоксина безопасны и эффективны и в комбинации с другими методами лечения приводят к уменьшению субъективных ощущений и выраженности рубцов.
Заключение. Ботулинотерапия в комбинации с другими методами является альтернативным методом лечения гипертрофических рубцов. При лечении ботулотоксином отмечается улучшение внешнего вида рубцов как по субъективным, так и по объективным оценкам.
Одной из актуальных проблем современной эстетической медицины являются рубцы – вторичные морфологические элементы, формирующиеся в виде компенсаторной реакции после нарушения целостности поверхности кожи в результате травмы или глубокого воспалительного процесса.
По структуре рубцы классифицируются следующим образом: атрофические рубцы «минус ткань» – обычно очень тонкие, напоминающие папиросную бумагу и имеющие складчатую прозрачную поверхность, сквозь которую просвечивают сосуды; нормотрофические – тонкие, бледные, не выступающие над поверхностью кожи, не растущие; гипертрофические и келоидные «плюс ткань» – плотные, выступающие над уровнем окружающей кожи образования с умеренно или слабо бугристой блестящей поверхностью, иногда покрытые шелушащимся эпидермисом.
Рубцовые деформации существенно снижают качество жизни и могут приводить к анатомо-функциональным нарушениям и развитию нервно-психических расстройств.
Патогенез развития гипертрофических рубцов
Патогенез рубцевания основан на трех фазах заживления ран:
- воспаления (сосудистые реакции, экссудация, отек, инфильтрация, выпадение фибрина с ограничением зоны повреждения – четыре-пять суток);
- регенерации и пролиферации В (продукция коллагена, новообразование сосудов, развитие грануляционной ткани – с первых суток до двух – четырех недель);
- эпителизации и реорганизации (начинается одновременно со второй стадией и длится до года).
Гипертрофические рубцы формируются в результате аномально высокого уровня трансэпидермальной потери воды, что стимулирует повышенную выработку цитокинов кератиноцитами. Цитокины, в свою очередь, активируют синтез дермальных фибробластов и чрезмерную выработку коллагена, в результате образуются рубцы «плюс ткань».
Факторы развития гипертрофических рубцов
Механизмы образования гипертрофических рубцов до конца не изучены, однако многие исследования показали, что воспаление участвует в модулировании синтеза коллагена, а интенсивность воспаления положительно коррелирует с окончательными размерами рубца. В патогенезе воспаления участвуют клетки, медиаторы воспаления и общие сигнальные пути. Как клетки ткани кожи, так и иммунные клетки снабжены рецепторами распознавания для обнаружения молекулярных паттернов, связанных с патогенами, и молекулярных паттернов, связанных с повреждением. Основными клетками, участвующими в воспалении, являются макрофаги, Т-лимфоциты, нейтрофилы, тучные клетки.
Макрофаги подвергаются M1- (классической) или M2- (альтернативной) активации. Избыток макрофагов, активированных по М2-пути, коррелирует с аномальным образованием рубца, что способствует превращению фибробластов в миофибробласты, секретируя трансформирующий фактор роста бета (TGF-β) и тромбоцитарный фактор роста CC (PDGF-CC), оба из которых влияют на отложение коллагена и образование рубцов.
Т-лимфоциты играют сложную роль в формировании рубцов из-за разнообразия и разнонаправленности их подтипов. Многие модели фиброза основаны на отложении ретикулярного фибрина вследствие того, что интерлейкин (ИЛ) 4 и ИЛ-13, секретируемые клетками Th2, способствуют синтезу и метаболизму коллагена.
Влияние на формирование рубцов нейтрофилов изучается, но в некоторых исследованиях доказано, что структуры NET, которые синтезируются нейтрофилами, способствуют экспрессии факторов роста соединительной ткани и коллагеновых волокон.
Во многих случаях цитокины/хемокины являются важными медиаторами воспалительных клеток для выполнения своей роли. На ранних стадиях заживления ран воспалительные факторы, такие как ИЛ-6, ИЛ-8, ИЛ-18, хемокиноподобный фактор 1, простагландин, продуцируемый циклооксигеназой, обычно проявляют провоспалительную активность и организованы для активации защитных механизмов. Напротив, цитокины с противовоспалительным эффектом (например, ИЛ-10) преобладают на поздних стадиях, способствуя пролиферации и ремоделированию клеток тканей. Дисбаланс цитокинов на любом этапе заживления раны может привести к аберрантному образованию рубца.
При связывании со своими родственными лигандами рецепторы цитокинов изменяют свою конфигурацию и запускают сигнальные пути, такие как ядерный фактор каппа B, STAT3, фокальная киназа адгезии. Таким образом, воспаление играет ключевую роль в образовании гипертрофических рубцов.
В последние годы было доказано, что нейрогенное воспаление (NI) способствует образованию гипертрофических рубцов. NI относится к воспалительному процессу вследствие острого повреждения, характеризующегося высвобождением нейропептидов, особенно субстанции P (SP), из сенсорных нервов. В процессе заживления рубца механическая сила, создаваемая сокращением раны, может стимулировать механочувствительные ноцицепторы на сенсорных волокнах, чтобы вызвать секрецию SP и пептида, связанного с геном кальцитонина (CGRP), из окончаний периферических нервов, тем самым повышая экспрессию TGF-β и NGF в различных клетках, включая фибробласты кожи. Сверхэкспрессия TGF-β в рубцовой ткани индуцирует экспрессию α-SMA, что способствует сокращению раны миофибробластами, поэтому периферические нервные окончания секретируют больше SP и CGRP с формированием непрерывной микросреды обратной связи для локального воспаления.
Лечение гипертрофических рубцов
Современные способы лечения гипертрофических рубцов можно разделить на оперативные методы – иссечение и консервативные – использование силиконовых гелей и пластин, ферментных препаратов, топическая терапия, аппаратные и инъекционные методики, в том числе внутриочаговое введение глюкокортикостероидов, Лонгидазы. На данный момент для достижения наилучшего эффекта используют различные комбинации этих методов.
Ботулинотерапия гипертрофических рубцов – введение с помощью микроинъекций препаратов на основе нейротоксина белковой природы (ботулотоксина), блокирующих нервно-мышечную передачу. Протеиновый комплекс, получаемый из бактерий Clostridium botulinum, состоит из нейротоксина типа А и некоторых других белков. В физиологических условиях данный комплекс распадается и высвобождается чистый нейротоксин. Введенный в подкожные мышцы или даже подкожно ботулинический токсин обеспечивает эффект пролонгированной миорелаксации, вследствие чего происходит расслабление чрезмерного натяжения тканей.
Ботулинический токсин типа А (БТ-А) – наиболее широко используемый препарат в эстетической медицине. Считается, что препарат блокирует пресинаптическое высвобождение ацетилхолина вследствие протеолитического расщепления белка семейства SNARE SNAP-25. Однако в последние годы исследования показали, что БТ-А также может блокировать передачу сигналов нехолинергических нейротрансмиттеров и подавлять поглощение трофических молекул, необходимых для синтеза SP и CGRP, что приводит к ингибированию NI.
Методика введения ботулотоксина
Ботулотоксин вводится вокруг рубца и непосредственно в ткани с формированием внутрикожных и подкожных папул. Токсин разводится в соотношении 1:1. Препарат вводится в пораженную область с интервалом 0,3–1 см через шприц калибра 30 объемом 1 мл. Количество точек введения зависит от размера рубца. Введение повторяют с периодичностью один раз в два – четыре месяца.
Клинический пример 1
Пациентка А., 45 лет, послеоперационный рубец более пяти лет. Субъективно: зуд в области рубца, болезненность при касании, эстетический дефект. Объективно: по Ванкуверской шкале оценки рубцов (VSS) – 8 баллов.
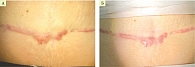
Пациентке был введен ботулотоксин по вышеуказанной методике. Через две недели был использован VBeam-лазер. Субъективно – полное исчезновение зуда и чувствительности в зоне рубца. Отмечена положительная динамика в виде изменения внешнего вида: цвет рубца стал светлее, при пальпации – мягче и податливее, по VSS – 6 баллов (рис. 1 А, Б).
Клинический пример 2
Пациентка Б., 38 лет, послеоперационный рубец более трех лет. Субъективно: эстетический дефект. Объективно: по VSS – 6 баллов; по шкале оценки рубцов Стоуни Брук (SBSES) – 2 балла.
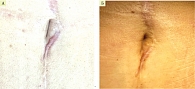
После введения ботулотоксина по вышеуказанной схеме рубец стал мягче и меньше по высоте (рис. 2 А, Б).
Выводы
- Введение БТ-А является эффективным способом лечения гипертрофических рубцов в комбинации с другими методами.
- При лечении БТ-А отмечается улучшение не только внешнего вида рубцов, но и субъективных ощущений пациента.
- Необходимы дальнейшие исследования для определения наиболее эффективных протоколов лечения с использованием внутриочаговых инъекций БТ-А у пациентов с гипертрофическими рубцами.
Авторы заявляют об отсутствии конфликта интересов.
E.D. Verbovaya
Central State Medical Academy of Department of Presidential Affairs, Moscow
Contact person: Elena D. Verbovaya, verbovaya.lena@gmail.com
The article discusses the pathophysiology, trigger factors for the development of hypertrophic scars, features of botulinum therapy in this disease, presents clinical examples of the use of botulinum therapy in the treatment of hypertrophic scars.
Purpose – to consider the pathogenesis of hypertrophic scars, to investigate the mechanism of botulinum toxin in the treatment of hypertrophic scars.
The results of clinical examples show that intralesional injections of botulinum toxin are safe and effective and, in combination with other methods of treatment, lead to a decrease in subjective sensations and the severity of scarring.
Conclusions. Botulinum therapy in combination with other methods is an alternative method for the treatment of hypertrophic scars. When treated with botulinum toxin, there is an improvement not only in the appearance of scars, both according to subjective and objective assessments.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.