Актуальные вопросы терапии послеоперационных гипертрофических рубцов
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. В данном исследовании была изучена эффективность терапии с помощью ботулинического токсина типа А (БТ-А) у пациенток после эстетической операции на молочной железе. Под нашим наблюдением находилось 22 пациентки, средний возраст – 42,3 ± 4,7 года. Для оценки эффективности использовали шкалы SBSES, POSAS.
Результаты. По данным динамики исследуемых показателей шкалы SBSES снижение составило 65,3%, показатель шкалы POSAS (пациент) снизился на 49,4%, POSAS (исследователь) – на 41,7%.
Заключение. Полученные результаты клинического наблюдения и анкетирования позволяют сделать вывод о достаточно высокой эффективности терапии с помощью БТ-А в ранние сроки после операций с целью терапии и профилактики формирования гипертрофических рубцов.
Материал и методы. В данном исследовании была изучена эффективность терапии с помощью ботулинического токсина типа А (БТ-А) у пациенток после эстетической операции на молочной железе. Под нашим наблюдением находилось 22 пациентки, средний возраст – 42,3 ± 4,7 года. Для оценки эффективности использовали шкалы SBSES, POSAS.
Результаты. По данным динамики исследуемых показателей шкалы SBSES снижение составило 65,3%, показатель шкалы POSAS (пациент) снизился на 49,4%, POSAS (исследователь) – на 41,7%.
Заключение. Полученные результаты клинического наблюдения и анкетирования позволяют сделать вывод о достаточно высокой эффективности терапии с помощью БТ-А в ранние сроки после операций с целью терапии и профилактики формирования гипертрофических рубцов.
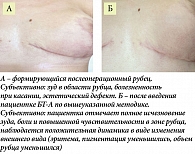
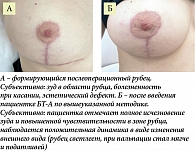
Ежегодно в развитых странах около 100 млн человек обращаются за врачебной помощью в связи с патологическими рубцами [1]. Оперативные вмешательства являются одной из основных причин формирования гипертрофических рубцов (ГР), при этом после эстетических операций их формирование может значительно снизить качество жизни пациентов и общую удовлетворенность проведенной пластической операцией [2].
Репарация в области хирургического разреза происходит аналогично классическому заживлению ран и включает следующие процессы: воспаление, пролиферация и ремоделирование. Воспалительный процесс начинается непосредственно после травмы и длится два-три дня, на клеточном уровне характеризуется хемотаксисом нейтрофилов, дифференцировкой моноцитов в макрофаги, что сопровождается формированием тромбоцитарной пробки и фибринового матрикса [2]. На этом фоне через два-три дня после повреждения ткани запускаются процессы пролиферации, которые продолжаются три – шесть недель. Этот период характеризуется высокой клеточной пролиферацией и миграцией, что приводит к формированию грануляционной ткани. В дальнейшем фибробласты дифференцируются в миофибробласты, связанные с макрофагами, и синтезируется внеклеточный матрикс (ECM), в основном в форме коллагена [3]. В состав ECM также входят эластин, гиалуроновая кислота и протеогликаны [4]. После закрытия раны начинается процесс ремоделирования, сопровождающийся преобразованием незрелых продуктов заживления в зрелую форму [2]. В большинстве случаев именно пролонгация или нарушение процессов в фазе ремоделирования приводят к формированию патологических рубцов. Признанным фактором риска образования гипертрофических рубцов является сосудистый компонент, напрямую связанный с иннервацией [5]. В фибробластах патологических рубцов обнаруживается повышенная экспрессия рецепторов к трансформирующему фактору роста β (TGF-β), особенно TGF-β1, TGF-β2, тромбоцитарного происхождения фактору роста (PDGF), инсулиноподобному фактору роста (IGF-1), эпидермальному фактору роста (EGF) и сосудистому эндотелиальному фактору роста (VEGF) [6, 7]. Эти данные о патогенезе патологических рубцов, особенно в случаях их прогнозируемого формирования (хирургические вмешательства), делают обоснованным разработку терапевтических методов, направленных на сосудистый компонент и иннервацию в очагах формирования ГР.
Актуальные клинические рекомендации регламентируют терапевтическую тактику в зависимости от длительности патологического процесса. Так, в ранние сроки показана компрессионная терапия, гелевые пластины, терапия давлением. В более поздние сроки проводится лечение с использованием глюкокортикостероидов, Букки-терапии, фототехнологий и других аппаратных методов [8–10]. При неэффективности данных методов рассматривается вопрос об использовании 5-фторурацила и других супрессивных методов, как правило, в комбинациях [2]. В последнее время значительно расширяются показания для проведения ботулинотерапии, так как именно процессы иннервации лежат в основе многих патологических состояний, в том числе и при формировании ГР.
Ботулинотерапия – введение с помощью микроинъекций препаратов на основе нейротоксина белковой природы (ботулотоксина). Препараты ботулотоксина — лекарственные препараты, блокирующие нервно-мышечную передачу. Их получают из бактерий Clostridium botulinum, получаемый продукт состоит из нейротоксина типа А и некоторых других белков. В физиологических условиях данный комплекс распадается и высвобождается чистый нейротоксин. Введенный в подкожные мышцы или даже подкожно ботулинический токсин обеспечивает эффект пролонгированной миорелаксации, за счет чего происходит расслабление чрезмерного натяжения тканей. Ботулинический токсин типа А (БТ-А) стал наиболее широко используемым препаратом в эстетической медицине. Считается, что препарат блокирует пресинаптическое высвобождение ацетилхолина (АХ) путем протеолитического расщепления белка семейства SNARE SNAP-25. Однако в последние годы исследования показали, что BTX-A также может блокировать передачу сигналов нехолинергических нейротрансмиттеров и подавлять поглощение трофических молекул, необходимых для синтеза SP и CGRP, что приводит к ингибированию NI. В исследованиях было показано, что БТ-А влияет на пролиферацию, миграцию, дифференцировку и апоптоз фибробластов [11], а также на уровень экспрессии TGF-β и VEGF в дозозависимом режиме [12, 13]. Немаловажным вкладом в механизмы действия БТ-А при ГР можно считать влияние на экспрессию α-актина гладких мышц и миозина II в фибробластах [14], выработку коллагена I и III [15]. В эксперименте in vitro было показано, что применение БТ-А способствовало формированию более тонких коллагеновых рубцов, а показатели воспаления, эластичности и пигментации практически соответствовали норме [16]. Однако клинические данные носят достаточно противоречивый характер: от отличных результатов до формирования ложноположительных результатов [17–24].
Материал и методы
Под нашим наблюдением находились 22 пациентки, средний возраст – 42,3 ± 4,7 года. Все пациентки были после проведения маммопластики без имплантации. Всем пациенткам проводили введение БТ-А в сроки через две недели после снятия швов и последующее введение через четыре недели, таким образом, курс состоял из двух введений с интервалом четыре недели. Контрольные точки были выбраны следующие: до терапии (четыре недели после оперативного вмешательства) и дважды после терапии (перед вторым введением БТ-А и через четыре недели после него или 12 недель после оперативного вмешательства).
Методика введения ботулотоксина:
- БТ-А вводят вокруг рубца и непосредственно в ткани с формированием внутрикожных и подкожных папул;
- БТ-А разводят в соотношени 1 : 1;
- препарат вводят в пораженную область с интервалом 0,3–1 см через шприц калибра 30 объемом 1 мл;
- количество точек введения зависит от размера рубца.
Для оценки эффективности введения БТ-А использовали шкалу Stony Brook Scar Evaluation Scale (SBSES), включающую в себя оценку ряда параметров по двоичной системе (0 или 1 балл), общая оценка составляет от 0 (наихудший вид) до 5 (отличный вид). Также была применена шкала двойной оценки – The Patient and Observer Scar Assessment Scale (POSAS), в соответствии с которой сам пациент оценивал вид рубца (от 1 до 10 баллов) с учетом таких признаков, как болезненность/зуд, цвет, плотность, толщина, рельеф, возвышение над окружающими тканями, и исследователь (от 1 до 10 баллов) с учетом следующих параметров: васкуляризация, пигментация, толщина, рельеф поверхности, эластичность, площадь рубца (относительно исходной раны).
Статистический анализ проводили с использованием программы StatTech v. 4.0.6 (разработчик – ООО «Статтех», Россия).
Результаты
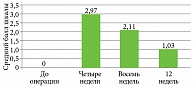
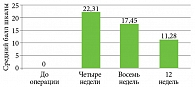
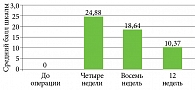
Исходно в сроки четыре недели после оперативного вмешательства показатель шкалы SBSES составил 2,97 ± 0,25 балла (p < 0,05). Значение шкалы POSAS (пациент) составило 22,31 ± 2,57 балла (p < 0,05), POSAS (исследователь) – 24,88 ± 1,26 балла (p < 0,05).
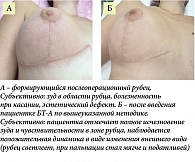
При оценке рубцов через 12 недель после оперативного вмешательства у всех пациенток наблюдался положительный эффект в виде значительного уменьшения покраснения, плотности, толщины рубца, а также купирования боли, зуда и дискомфорта. По данным исследователей, также наблюдался положительный эффект в отношении васкуляризации, пигментации, толщины, рельефа поверхности, эластичности, площади рубца.
В сроки через 12 недель после оперативного вмешательства показатель шкалы SBSES составил 1,03 ± 0,11 балла (p < 0,05) (рис. 1 А, Б), значение шкалы POSAS (пациент) составило 11,28 ± 1,63 балла (p < 0,05) (рис. 2 А, Б), POSAS (исследователь) – 10,37 ± 1,28 (p < 0,05) (рис. 3 А, Б).
Клинические примеры терапии гипертрофических рубцов представлены на фото.
Заключение
Патологические рубцы являются достаточно частой причиной обращения в специализированные клиники. Оперативные вмешательства являются одной из основных причин формирования гипертрофических рубцов, при этом после эстетических операций их формирование может значительно снизить качество жизни пациентов и общую удовлетворенность проведенной пластической операцией.
В данном исследовании была изучена эффективность терапии с помощью БТ-А у пациенток после эстетической операции на молочной железе. По данным динамики исследуемых показатель шкалы SBSES снизился на 65,3%, показатель шкалы POSAS (пациент) – на 49,4%, POSAS (исследователь) – на 41,7%. Полученные результаты клинического наблюдения и анкетирования позволяют сделать вывод о достаточно высокой эффективности терапии с помощью БТ-А в ранние сроки после операций с целью терапии и профилактики формирования гипертрофических рубцов.
Конфликт интересов отсутствует.
E.D. Verbovaya, L.S. Kholupova, PhD, M.S. Kruglova
Central State Medical Academy of Department of Presidential Affairs, Moscow
I.M. Sechenov First Moscow State Medical University
Contact person: Elena D. Verbovaya, verbovaya.lena@gmail.com
Every year in developed countries about 100 million people seek medical help due to pathological scars. Surgical interventions are one of the main causes of hypertrophic scars (HS), while after aesthetic surgeries their formation cansignificantly reduce the quality of life of patients and overall satisfaction with the plastic surgery.
Material and methods. In this study, the effectiveness of BT-A therapy was studied in patients after aesthetic breast surgery. We observed 22 patients, the average age was 42.3 ± 4.7 years. To assess the effectiveness, the SBSES and POSAS scales were used.
Results. According to the dynamics of the studied SBSES scale indicators, the decrease was 65.3%, the POSAS scale indicator (patient) decreased by 49.4%, and the POSAS (researcher) scale – by 41.7%.
Conclusions. The obtained results of clinical observation and questionnaires allow us to conclude that therapy with BT-A is quite effective in the early stages after operations for the purpose of therapy and prevention of hypertrophic scar formation.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.