Патогенетическая терапия диабетической полиневропатии альфа-липоевой кислотой с точки зрения доказательной медицины
- Аннотация
- Статья
- Ссылки
- English


Сахарный диабет (СД) приводит к развитию широкого спектра поражений периферических нервов: дистальной симметричной сенсорно-моторной полиневропатии, торакоабдоминальной радикулопатии, проксимальной моторной невропатии, тоннельным невропатиям, мононевропатии, острой невропатии тонких волокон (атипичной диабетической полиневропатии – ДПН). Наиболее частый вариант поражения периферической нервной системы – ДПН, которая развивается у 50% больных СД [1] и может возникать уже при нарушении толерантности к глюкозе и метаболическом синдроме [2].
Существует несколько определений ДПН, но с практической точки зрения для установления факта ДПН важно наличие типичных жалоб (боли, жжения, онемения, парестезий) и неврологического дефицита при отсутствии иных причин развития полиневропатии (около 10% случаев ДПН не связано с гипергликемией и зависит от других этиологических факторов). В связи с этим у больных СД с подозрением на полиневропатию целесообразно установить, особенно если имеет место нетипичный фенотип ДПН, уровни витамина В12, фолиевой кислоты, тиреоидных гормонов, провести поиск парапротеинов в плазме крови, исследовать биохимические показатели. Характерный фенотип ДПН подразумевает дистальность и симметричность симптоматики, поражение в первую очередь ног, преобладание нарушений чувствительности, а не двигательной сферы, превалирование изменений поверхностной чувствительности над изменениями глубокой чувствительности, медленное прогрессирование заболевания.
Естественное течение ДПН отражают ее стадии:
- ДПН-1 – отсутствие жалоб и неврологических признаков, но наличие изменений по данным электромиографии (ЭМГ):
- ДПН-1а – изменения, выявленные на ЭМГ в отсутствие жалоб и неврологических признаков;
- ДПН-1b – незначительный неврологический дефицит;
- ДПН-2 – жалобы, неврологический дефицит, изменения на ЭМГ:
- ДПН-2а – двигательные нарушения отсутствуют;
- ДПН-2b – больной не может или затрудняется стоять и ходить на пятках;
- ДПН-3 – нарушение трудовой и социальной адаптации из-за различных проявлений ДПН (боли, диабетической стопы и т.д.) [3].
Диагностика
ЭМГ – основной метод диагностики ДПН. При ДПН должны обнаруживаться изменения по крайней мере в двух нервах нижних конечностей, один из которых икроножный. ЭМГ тестирует состояние толстых нервных волокон, поэтому при острой ДПН изменений тонких волокон на ЭМГ может не быть [4].
Самое раннее вовлечение в патологический процесс периферических нервов позволяет обнаружить инвазивная техника биопсии кожи стоп (панч-биопсия) с исследованием плотности тонких нервных волокон в эпидермисе [5, 6] или неинвазивная техника изучения состояния тонких нервов роговицы с помощью конфокальной микроскопии [7, 8]. Для тестирования состояния тонких нервных волокон, отвечающих за проведение болевой и температурной чувствительности, используется метод психофизиологии – количественное сенсорное тестирование, при котором оценивают ответы пациента на предъявляемые болевые и температурные стимулы [3, 9]. Достоинство этих методов заключается в том, что они позволяют выявлять субклинические изменения и своевременно назначать лечение. Среди их недостатков – необходимость наличия специального оборудования и квалифицированных специалистов для интерпретации результатов, высокая стоимость биопсии и конфокальной микроскопии [10].
Факторы риска
К основным факторам риска развития ДПН относят длительность СД [11, 12], выраженность и вариабельность гипергликемии, особенно при СД первого типа [13], возраст и рост больных, избыточную массу тела, артериальную гипертензию, дислипидемию, окислительный стресс и системное субклиническое воспаление, низкий уровень витамина D, курение, употребление алкоголя, генетические факторы [14, 15]. Хороший контроль гликемии наряду со своевременной интенсивной терапией СД считается первоочередной задачей лечения пациентов с СД и ДПН. Вместе с тем показано, что риск развития ДПН на фоне интенсивной терапии существенно снижается только при СД первого типа [16]. При СД второго типа не обнаружено существенной корреляции между достижением целевого уровня гликемии и развитием/прогрессированием ДПН [1, 17]. Следовательно, достижения хорошего контроля гликемии и изменения образа жизни явно недостаточно, что обусловливает актуальность специфического лечения поздних осложнений СД, в том числе ДПН.
Лечение
Выбор терапии ДПН определяется современными представлениями о механизмах формирования патологии периферических нервов. К нарушению структуры и функции периферической нервной системы приводят два основных механизма. Первый механизм – молекулярные и биохимические изменения в периферических нервах (активация полиолового пути, образование повышенного количества продуктов избыточного гликирования белков, активация протеинкиназы С, накопление продуктов нарушенной утилизации глюкозы в цитоплазме клеток, снижение активности транскетолазы из-за нехватки тиамина и др.). Это связано с развитием при СД окислительного стресса и разрушающим действием свободного радикала супероксида на митохондриальную ДНК [18]. Второй механизм – нарушение нормального кровообращения в периферических нервах из-за патологии эндоневральных (микроциркуляторных) сосудов. Известно, что изменения сосудов микроциркуляторного русла возникают раньше, чем образуется патология периферических нервных волокон, и имеется корреляция между состоянием эндоневральных сосудов и числом нервных волокон в периферическом нерве [19, 20].
Существуют определенные требования к медикаментозным средствам для лечения ДПН, сформулированные в 1998 г. Управлением по контролю качества пищевых продуктов и медикаментов США:
- действие на патогенетические механизмы;
- уменьшение симптомов невропатии;
- улучшение функции нерва;
- уменьшение риска гибели нервных волокон;
- отсутствие значительных побочных эффектов.
В патогенетическом и симптоматическом лечении ДПН используется целый ряд препаратов. Симптоматическое лечение, особенно болевого синдрома при ДПН, четко регламентируется, поэтому важнее определиться с методами патогенетического лечения [3]. Среди препаратов патогенетической терапии ДПН в литературе рассматриваются альфа-липоевая (тиоктовая) кислота (АЛК), бенфотиамин, ацетил-L-карнитин, Актовегин, ингибиторы альдозоредуктазы [21, 22]. Практические врачи должны понимать, что выбор того или иного препарата осуществляется в соответствии с уровнем доказательности рекомендаций (табл. 1).
Среди разнообразных препаратов, обладающих антиоксидантным эффектом, наиболее изученной с подтвержденным в экспериментальных и клинических исследованиях действием является АЛК. В медицинской литературе опубликовано много обзоров, посвященных ее использованию при ДПН [23, 24]. На фармацевтическом рынке России представлены многочисленные препараты АЛК различных фирм, в том числе отечественных.
АЛК – мощный липофильный антиоксидант, что определяет возможность ее терапевтического использования. Вводимая в организм, АЛК восстанавливается в основном из R(+)-изоформы до дигидролипоевой кислоты, которая и обеспечивает основные терапевтические эффекты, в частности за счет нейтрализации основного свободного радикала – супероксида. Сама дигидролипоевая кислота не используется в качестве лекарственного препарата, так как при хранении легко окисляется.
Экспериментальные исследования показали, что АЛК уменьшает выраженность окислительного стресса, усиливает активность антиоксидантных ферментов, улучшает эндоневральный кровоток и увеличивает скорость распространения возбуждения по нерву [25, 26]. В клинических исследованиях с применением АЛК у больных СД наблюдались улучшение состояния системы микроциркуляции и эндотелийзависимых реакций сосудистой стенки, уменьшение перикисного окисления липидов и активации фактора транскрипции ядерного фактора κB, нормализация содержания оксида азота и стресс-белков [27, 28]. По результатам экспериментальных и клинических исследований механизма действия АЛК был сделан вывод о том, что АЛК действует на патогенетические механизмы формирования и прогрессирования ДПН.
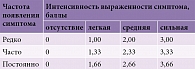
Первое рандомизированное контролируемое клиническое исследование эффективности внутривенного введения АЛК (ALADIN) проведено в Германии [29] с участием 328 амбулаторных пациентов с СД второго типа. Больные были разделены на четыре группы: получение АЛК в дозе 100, 600 или 1200 мг или плацебо (14 инфузий в течение трех недель). Результаты лечения оценивались по Общей шкале неврологических симптомов (Total Symptom Score – TSS) (табл. 2), которая позволяет определять интенсивность и частоту основных симптомов ДПН: стреляющую боль, жжение, онемение и парестезии. Через три недели в группах, получавших АЛК в дозах 600 и 1200 мг, сумма баллов по шкале TSS была достоверно (р < 0,002) ниже, чем в группе, получавшей АЛК 100 мг или плацебо. Таким образом, была показана дозозависимая эффективность АЛК, а оптимальной была признана доза 600 мг.
Позже в Германии проведено исследование ALADIN III, в котором больные СД второго типа и ДПН-1 в течение трех недель получали АЛК 600 мг внутривенно. Затем одна группа продолжила принимать АЛК 600 мг три раза в день перорально (n = 167), а вторая получала в том же режиме плацебо (n = 174) в течение шести месяцев [30]. Исследование подтвердило уменьшение позитивной невропатической симптоматики и неврологического дефицита у больных СД второго типа с ДПН при внутривенном введении АЛК.
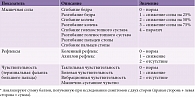
Рандомизированное клиническое исследование SYDNEY проводилось в России с той же целью, что и исследование ALADIN в Германии [31]. 120 больных СД первого и второго типа с симптомной ДПН были разделены на две группы в зависимости от получаемого лечения: АЛК внутривенно в дозе 600 мг/сут или плацебо в течение трех недель. Пациентов обследовали с помощью тестирования по TSS (ежедневно) и Шкале невропатических нарушений в нижних конечностях (Neuropathy Impairment Score of the Lower Limbs – NIS-LL) (табл. 3) до и после лечения. Подтверждена достоверная эффективность АЛК при внутривенном введении в отношении позитивной и негативной невропатической симптоматики.
Эффективность амбулаторного трехнедельного курса внутривенного введения АЛК больным СД (n = 241) в сравнении с плацебо (n = 236) по данным тестирования по шкалам TSS и Шкале неврологического дефицита (Neuropathy Impairment Score – NIS) в 33 диабетологических центрах США, Канады и Европы показана также в исследовании NATHAN 2 [32].
Стандартный метод и сроки введения АЛК в четырех исследованиях (ALADIN, ALADIN III, SYDNEY, NATHAN 2) позволили провести метаанализ их результатов. Всего оценивались данные 716 больных ДПН, принимавших АЛК, и 542 больных, получавших плацебо [33]. Эффективность применения АЛК (по шкале TSS) была статистически достоверно выше таковой плацебо (p < 0,05). Метаанализ динамики симптомов по NIS проводился только для трех исследований, поскольку в исследовании ALADIN эта шкала не использовалась. Результаты метаанализа свидетельствуют, что при ДПН внутривенное введение АЛК в течение трех недель (14–15 инфузий) безопасно и приводит к значительному улучшению в отношении позитивной невропатической симптоматики и неврологического дефицита.
В рандомизированном клиническом исследовании ORPIL с участием больных СД второго типа с ДПН изучали эффективность трехнедельного приема таблеток АЛК по 600 мг три раза в день – суммарная суточная доза 1800 мг (n = 12) по сравнению с плацебо (n = 12). Сумма баллов по шкале TSS достоверно уменьшилась только на фоне приема АЛК (p = 0,021), как и сумма баллов по Шкале неврологических расстройств (Neuropathy Disability Score) (p = 0,025).
В рандомизированном клиническом исследовании DEKAN с участием больных СД второго типа с нарушением вариабельности сердечного ритма использовали для лечения либо АЛК в таблетках по 200 мг четыре раза в день – суточная доза 800 мг (n = 39), либо плацебо (n = 34) в течение четырех месяцев. Выявлено достоверное увеличение вариабельности сердечного ритма в группе АЛК по сравнению с группой плацебо (p < 0,05) [30].
Целесообразность длительного приема АЛК в таблетках с целью лечения и замедления прогрессирования ДПН изучалась в исследовании ALADIN II [34]. В течение двух лет АЛК в таблетках получали две группы больных СД первого и второго типа: одна группа (n = 18) по 600 мг два раза в день, вторая (n = 27) по 600 мг один раз в день. Третья группа (n = 20) получала плацебо. Скорость распространения возбуждения по чувствительному нерву (nervus suralis) возросла у пациентов обеих групп, принимавших таблетки АЛК, по сравнению с группой плацебо. Амплитуда потенциала действия nervus suralis достоверно увеличилась только в группе больных, получавших 600 мг АЛК (p < 0,05), а скорость распространения возбуждения по двигательному нерву nervus tibialis достоверно возросла по сравнению с плацебо только в группе больных, получавших 1200 мг АЛК.
В мультицентровом рандомизированном клиническом исследовании SYDNEY 2 принимал участие 181 пациент из России и Израиля. После получения в течение одной недели плацебо пациенты были распределены на получение АЛК один раз в день в дозах 600 мг (n = 45), 1200 мг (n = 47) и 1800 мг (n = 46) или плацебо (n = 43) в течение пяти недель (оценивалась стабильность по шкале TSS) [35]. Проведен анализ динамики по шкалам TSS, NIS и Шкале невропатических симптомов и их изменений (Neuropathy Symptoms and Changes). Общая сумма баллов по шкале TSS в первой группе уменьшилась на 4,9 балла (51%), во второй группе – на 4,5 балла (48%) и в третьей группе – на 4,7 балла (52%). В группе плацебо сумма баллов снизилась на 2,9 балла (32%), что достоверно меньше (р < 0,05) по отношению ко всем группам лечения. Полученные данные свидетельствуют, что улучшение при приеме таблеток АЛК не зависит от дозы и доза 600 мг АЛК в день оптимальна с точки зрения соотношения «риск – улучшение».
В 2010 г. группа ведущих экспертов по ДПН пересмотрела все клинические аспекты ДПН: определение, стадии, диагностику, лечение и т.д. [3]. Обсудив вопрос о патогенетической терапии ДПН, эксперты отметили, что АЛК – единственное патогенетическое средство лечения ДПН с доказанной в девяти рандомизированных контролируемых исследованиях эффективностью (уровень доказательности А).
В обзоре 2013 г. A.J. Boulton и соавт. отметили, что некоторые варианты патогенетического лечения продемонстрировали значительное клиническое улучшение по показателям симптомов невропатии. АЛК, бенфотиамин и Актовегин лицензированы и применяются для лечения симптомной ДПН в нескольких странах Европы, а ингибитор альдозоредуктазы эпалрестат разрешен к применению в Японии и Индии [22]. Нужно отметить, что в настоящий момент бенфотиамин, ацетил-L-карнитин и ингибиторы альдозоредуктазы имеют уровень доказательности В. АЛК в качестве антиоксидантного средства используется при ДПН более 40 лет [22]. Метаанализ с участием 1258 пациентов показал, что внутривенное введение АЛК в течение трех недель значительно уменьшает симптомы невропатии и неврологический дефицит [33]. Прием АЛК в таблетках в течение пяти недель также эффективен.
Следует отметить способность АЛК уменьшать болевой синдром при ДПН, который в наибольшей степени нарушает качество жизни больных. В метаанализах, проведенных голландскими специалистами, показано, что АЛК в виде внутривенных капельных инфузий и таблеток достоверно ослабляет болевые феномены при ДПН [36, 37]. Доказано, что обезболивающий эффект АЛК связан с воздействием на кальциевые каналы и уменьшением возбудимости ноцицептивных нейронов [38]. Согласно точке зрения, основанной на данных литературы и собственных наблюдениях, если интенсивность боли не превышает 3 баллов по Визуальной аналоговой шкале, АЛК эффективно устраняет боль самостоятельно без добавления специфических блокаторов боли [39]. Установлено, что применение АЛК достоверно снижает потребность в обезболивающих препаратах [40].
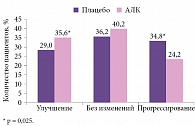
Казалось, что эффективность АЛК не вызывает сомнений. Однако R. Pop-Busui и соавт., представляя позицию Американской диабетической ассоциации (2017), указали на отсутствие методов лечения, которые эффективно воздействуют на естественное течение ДПН или обратное развитие уже установленной ДПН, несмотря на достигнутый в последнее время прогресс в понимании патогенеза диабетической невропатии. По их мнению, необходимо проведение дополнительных клинических испытаний, для того чтобы получить убедительные доказательства патогенетической эффективности каких-либо методов лечения ДПН [41]. Что имеется в виду? Фармакологическое лечение может оказывать болезнь-модифицирующий и симптом-модифицирующий эффект. В первом случае фармакологическое лечение не только купирует симптомы, но и модифицирует, смягчает или тормозит прогрессирование заболевания, а во втором – только уменьшает выраженность симптомов. Заключение об отсутствии болезнь-модифицирующего действия у всей группы препаратов для патогенетической терапии ДПН было сделано на основании только одного исследования – NATHAN 1 [42]. В этом исследовании 422 больных СД первого и второго типа с ДПН разделили на две группы: одна (n = 215) получала ежедневно в течение четырех лет таблетированную форму АЛК 600 мг, а другая (n = 207) – плацебо. Основным критерием оценки эффективности лечения была выбрана шкала NIS-LL и семь тестов (порог вибрационной чувствительности, амплитуда М-ответа, латенция и скорость распространения возбуждения при стимуляции малоберцового нерва, латенция при стимуляции большеберцового нерва, амплитуда S-ответа икроножного нерва, вариабельность сердечного ритма). Через четыре года были получены данные о достоверном уменьшении неврологического дефицита (чувствительность, рефлексы, сила мышц) на фоне лечения АЛК по сравнению с плацебо (рисунок). В отношении электрофизиологических тестов достоверной разницы между группой лечения и группой плацебо выявлено не было, но в группе плацебо не произошло ожидаемого ухудшения показателей. Возможно, в какой-то мере на это повлияло уменьшение гликогемоглобина на 0,6% в группе плацебо, но аналогичное снижение уровня гликогемоглобина наблюдалось и в группе лечения АЛК.
Однако дизайн исследования вызывает несколько вопросов. Во-первых, в исследование включали больных СД первого и второго типа, несмотря на то что при СД первого типа ДПН прогрессирует отчетливее. Во-вторых, в исследовании приняли участие больные с ДПН-1 (субклинической стадией) и ДПН-2а. При этом, вероятно, пациентов с ДПН-1 было много, о чем свидетельствует низкий средний балл по шкале TSS в обеих группах (2,4 в группе лечения и 2,6 в группе плацебо). Например, в исследовании SYDNEY, куда включали больных с ДПН-2а и ДПН-2b, средний балл превышал 9. Скорее всего, ДПН-1 прогрессирует медленнее, чем ДПН-2. В-третьих, исследование проведено в 36 клинических центрах в США, Канаде и Европе, а опыт показывает, что более достоверные данные получают при участии небольшого числа центров. Осталось неясным, почему в этом исследовании при наблюдавшемся по данным шкал NIS и NIS-LL клиническом эффекте не было различий в результатах нейрофизиологического обследования. Все это не позволяет однозначно судить о наличии или отсутствии влияния АЛК на естественное течение ДПН.
Можно согласиться с тем, что необходимо проведение дополнительных исследований, оценивающих болезнь-модифицирующее действие АЛК при ДПН. Однако прежде всего следует определиться с ожиданиями от АЛК: должна ли она улучшать все показатели после длительного лечения или замедлять прогрессирование заболевания. Отталкиваясь от этого решения, следует установить клинические, нейрофизиологические, биохимические, морфологические критерии, которые позволят оценить действие АЛК. Предлагаются различные способы решения этого вопроса: от оценки показателей воспаления до уточнения состояния тонких волокон при конфокальной микроскопии [43, 44]. Высказывается мнение о целесообразности замены клинических шкал TSS, NIS и NIS-LL на Мичиганский опросник для скрининга невропатии (Michigan Neuropathy Screening Instruments), модифицированную Торонтскую шкалу клинической невропатии (modified Toronto Clinical Neuropathy Scale) и Ютскую шкалу для выявления ранних невропатий (Utah Early Neuropathy Scale). Кроме того, предлагается проведение панч-биопсии с оценкой состояния тонких волокон в дистальных отделах ног [41]. С нашей точки зрения, замена шкал совершенно неоправданна и не решает проблему. Применение панч-биопсии резко ограничит число клинических центров, в которых можно проводить исследование. Кроме того, прогрессирование ДПН определяется не состоянием тонких волокон, которые вовлекаются в патологический процесс раньше всего, а прогрессированием страдания толстых волокон. По нашему мнению, важно включать в исследование больных с одним типом СД, а также больных с ДПН-1 или ДПН-2а, отдельно выделяя пациентов с ДПН-2b, не включать больных с гликогемоглобином более 7,5%. Следует отметить необходимость соблюдения техники ЭМГ-обследования. Опытным ЭМГ-специалистам хорошо известно, что даже незначительные изменения позиции стимулирующих и отводящих электродов могут серьезно влиять на получаемые данные. Все это должно заранее обсуждаться, поскольку сказывается на результатах исследования.
Заключение
На сегодняшний день АЛК – основной препарат для лечения ДПН, который дает хорошие результаты в клинической практике. По данным многочисленных рандомизированных клинических исследований и метаанализов, использование АЛК внутривенно (14–15 инфузий) и перорально (600 мг в течение 1,5–2 месяцев) у больных СД с ДПН приводит к достоверному уменьшению спонтанных сенсорных феноменов (по TSS) и неврологического дефицита (по NIS-LL), что можно считать симптом-модифицирующим действием. При внутривенном введении АЛК (14–15 инфузий) продолжительность эффекта составляет не менее полугода (табл. 4) [45]. Имеются определенные свидетельства болезнь-модифицирующего эффекта АЛК при ДПН. В частности в исследовании ALADIN II оценивалось использование длительного приема таблеток АЛК с целью лечения и замедления прогрессирования ДПН.
АЛК должна применяться курсами в течение двух – шести месяцев. Длительный прием АЛК (годами) станет возможным только после проведения дополнительных многолетних исследований с использованием согласованных экспертами клинических, биохимических, нейрофизиологических и морфологических критериев.
I.A. Strokov, PhD, L.T. Akhmedzhanova, PhD, A.S. Fokina, A.N. Barinov, PhD
I.M. Sechenov First Moscow State Medical University
Contact person: Igor Alekseyevich Strokov, strigoral@mail.ru
The article describes the pathogenic mechanisms, risk factors, methods of diagnosis and treatment of diabetic polyneuropathy – one of the most widespread complications of diabetes. The evidence base of clinical application of injectable and tablet forms of alpha-lipoic acid as a means of pathogenetic therapy in diabetic polyneuropathy is analyzed.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.