Диабетическая полиневропатия и деменция в практике врача-невролога. Научно-практическая конференция «Весенние неврологические чтения в Москве и Санкт-Петербурге». Сателлитный симпозиум компании «Канонфарма продакшн»
- Аннотация
- Статья
- Ссылки


Многоликая диабетическая полиневропатия
Диабетическая полиневропатия (ДПН) относится к наиболее распространенным осложнениям сахарного диабета (СД). Как отметил Павел Рудольфович КАМЧАТНОВ, д.м.н., профессор кафедры неврологии, нейрохирургии и медицинской генетики лечебного факультета Российского национального исследовательского медицинского университета им. Н.И. Пирогова, именно периферическая нервная система при СД становится своеобразным органом-мишенью. Между тем многообразие клинических форм ДПН, сочетание демиелинизирующего и аксонального поражения, комбинация метаболического, иммуноопосредованного, трофического и других факторов затрудняют определение этиологической принадлежности заболевания и выбор тактики лечения.
Первостепенное значение в патогенезе ДПН имеет накопление конечных продуктов гликирования. Важную роль играет окислительный стресс. Определенную лепту в патогенез невропатии при СД вносят нарушения микроциркуляции, дефицит необходимых для нормального метаболизма веществ, а также аутоиммунный компонент, инфильтрация нервного ствола лейкоцитами, гемосидерином и др. Риск развития заболевания может быть обусловлен генетической предрасположенностью: на сегодняшний день установлена группа потенциальных генов, мутации которых связаны с повышением риска развития полиневропатии.
Шванновские клетки (ШК) чувствительны к нарушениям углеводного обмена. Инсулинорезистентность приводит к нарушению липидного обмена в ШК, а резкие колебания концентрации глюкозы в крови изменяют функцию и структуру ШК.
По данным A.R. Hackett и соавт.1, морфологически изменение чувствительности к инсулину и гипергликемия способствуют истончению миелиновой оболочки нерва и нарушению проводимости по нервным волокнам. Раннее истончение миелиновой оболочки показано в эксперименте на генетической модели диабетической невропатии седалищного нерва у грызунов. Поражение двигательных, чувствительных, блуждающих нервных волокон различных отделов нервной системы во многом объясняет разнообразие клинических форм ДПН.
Сегодня не вызывает сомнений тот факт, что инфекция COVID-19 у больных СД усугубляет развитие и течение полиневропатии2. Дело в том, что на фоне коронавирусной инфекции усиливается активность воспалительного процесса за счет синтеза цитокинов, баланс смещается в сторону провоспалительных цитокинов. Как следствие – ускорение темпов развития полиневропатического синдрома.
Как уже отмечалось, клинические проявления ДПН разнообразны. Поражение тонких чувствительных волокон характеризуется ощущением жжения, развитием парестезии, гиперестезии на фоне снижения болевой, температурной и висцеральной чувствительности. Поражение толстых сенсорных волокон сопровождается снижением вибрационной и глубокой чувствительности, угнетением сухожильных и периостальных рефлексов. При поражении вегетативной нервной системы наблюдаются дистальный ангидроз, гиперкератоз, акроцианоз, периферические отеки, остеоартропатия.
В соответствии с концепцией Эвинга, при СД 2-го типа в первую очередь страдают миелинизированные парасимпатические и чувствительные волокна. Нарушение функции парасимпатических нервов при вегетативной полиневропатии сопровождается дисфункцией кишечника и желчного пузыря, локальными трофическими нарушениями, эректильной дисфункцией и нейрогенным мочевым пузырем.
Ведущими симптомами вегетативной ДПН считаются нарушение регуляции сосудистого тонуса и расстройство регуляции сердечного ритма. Установлено, что скорость прогрессирования кардиальной автономной невропатии опережает формирование поздних сосудистых осложнений СД. 50% пациентов с кардиальной автономной невропатией умирают в течение двух с половиной лет после ее диагностики, в 20–25% случаев причиной внезапной смерти становится первое и последнее клиническое проявление заболевания.
Сердечно-сосудистая дисфункция при вегетативной полиневропатии у больных СД может проявляться ортостатической гипертензией или гипотензией, нарушением суточного ритма артериального давления, синдромом постуральной тахикардии, безболезненной ишемией миокарда, снижением вариабельности сердечного ритма и др.
Лечение пациентов с ДПН предусматривает комплексный подход, предполагающий не только интенсивный контроль уровня гликемии, но и назначение патогенетической терапии, направленной на восстановление пораженных нервов, а также симптоматической терапии, способствующей уменьшению выраженности болевого синдрома. Однако нормализация гликемии при СД не всегда предупреждает развитие ДПН, а симптоматическая терапия (амитриптилин, прегабалин, габапентин, дулоксетин, венлафаксин) в ряде случаев неэффективна в купировании болевого синдрома. Очевидно, что патогенетическая терапия, предусматривающая использование антиоксидантов, занимает важное место в схеме лечения пациентов с ДПН.
Одним из наиболее эффективных патогенетических препаратов признана тиоктовая (альфа-липоевая) кислота. Тиоктовая кислота, обладающая антиоксидантными свойствами, способствует нейтрализации действия окислительного стресса, снижению выраженности повреждения липидных мембран свободными радикалами. Тиоктовая кислота предупреждает повреждение ШК при гипергликемии, сохраняя тем самым оболочку периферического нейрона, обеспечивающую качество и скорость проведения сигнала. По сути речь идет о прицельном воздействии на орган-мишень и поддержании качества обмена информацией между нейронами. Не случайно тиоктовая (альфа-липоевая) кислота включена в большинство современных европейских руководств по ведению пациентов с ДПН.
В исследовании J.C. Won и соавт.3 пациенты с болевой ДПН в течение 12 недель получали альфа-липоевую кислоту 600 мг/сут. Показано, что обеспечение эффективной дозы препарата на протяжении трехмесячного курса позволяет добиться достоверного уменьшения интенсивности болевого синдрома и хорошего терапевтического результата.
Эффективность терапии тиоктовой кислотой у больных ДПН подтверждена в ряде исследований (ALADIN I, II, III, DEKAN, ORPIL, SYDNEY). Применение тиоктовой кислоты в разных дозах и разные сроки лечения обеспечивало эффективное снижение интенсивности болевого синдрома и улучшение чувствительности. Переносимость препарата была хорошей.
Среди дженериков тиоктовой кислоты особого внимания заслуживает препарат Тиолепта, биоэквивалентный референтному препарату немецкого производства и даже несколько превосходящий последний по скорости достижения максимальных концентраций.
Результаты исследования «Этика» продемонстрировали высокую эффективность и безопасность препарата Тиолепта при ДПН4. Тиолепта достоверно уменьшает невропатическую симптоматику, причем эффект сохраняется в течение трех месяцев после прекращения приема препарата. Тиолепта хорошо переносится пациентами и имеет высокую степень безопасности.
В исследовании Е.Р. Баранцевича и соавт. 2016 г. применение препарата Тиолепта способствовало более значимому увеличению скорости проведения нервного импульса по чувствительному и двигательному нервному волокну.
Препарат Тиолепта выпускается в форме раствора для инфузий, концентрата для приготовления раствора для инфузий и таблеток. Активным веществом препарата в форме концентрата для приготовления раствора для инфузий является меглюминовая соль тиоктовой кислоты. Использование меглюминовой соли тиоктовой кислоты ассоциируется:
- с минимальной нагрузкой на сердечно-сосудистую систему при условии достаточно быстрого введения препарата с помощью перфузора (не менее 12 минут);
- сокращением затрат на приготовление внутривенных инфузий;
- удовлетворением потребности в лекарственном веществе 600 мг;
- развитием минимального количества побочных реакций по сравнению с другими солями тиоктовой кислоты.
После курса внутривенного введения препарата больного ДПН переводят на пероральный прием Тиолепты 600 мг/сут однократно в течение двух-трех месяцев. Длительная терапия препаратом Тиолепта рекомендована больным ДПН с поражением периферических нервов иного генеза.
Когнитивные и психоэмоциональные расстройства.
Взаимосвязь и взаимодополнение.
Современные тенденции диагностики и терапии.
Неожиданные факторы риска и увлекательные факторы профилактики
Согласно патогенетической классификации деменций, представленной Виталием Владимировичем КОВАЛЬЧУКОМ, заслуженным врачом РФ, д.м.н., профессором, председателем Общества реабилитологов Санкт-Петербурга, руководителем Центра медицинской реабилитации Городской больницы № 38 им. Н.А. Семашко, профессором Кембриджского университета, выделяют сосудистую, нейродегенеративную (болезнь Альцгеймера, болезнь Пика, деменция с тельцами Леви, лобно-височная дегенерация) и смешанную деменцию. Причем в генезе любой деменции или когнитивного расстройства в разной степени присутствует сосудистый компонент.
Самой частой причиной нейродегенеративной деменции считается болезнь Альцгеймера. Как известно, существуют три гипотезы этиологии болезни Альцгеймера: холинергическая (снижение синтеза ацетилхолина), амилоидная (накопление в тканях головного мозга бета-амилоида) и гипотеза тау-белка. В основе гипотезы тау-белка лежат отклонения в его структуре. Избыточное фосфорилирование тау-белка приводит к связыванию нитей белка друг с другом, образованию нейрофибриллярных клубков и разрушению транспортной системы нейронов.
Определенные сложности могут возникнуть при диагностике кортикобазальной дегенерации (КБД), являющейся спорадическим дегенеративным заболеванием центральной нервной системы, затрагивающим преимущественно лобно-теменную кору и черную субстанцию. Заболевание характеризуется постепенным и непрерывным прогрессированием. Клинически КБД проявляется асимметричным акинетико-ригидным синдромом, насильственными движениями, апраксией, дизартрией, дисфагией, надъядерным параличом взора, лобной симптоматикой. Позже могут отмечаться интеллектуально-мнестические расстройства.
Для постановки диагноза КБД необходимо наличие трех из шести признаков:
- L-ДОФА-резистентный акинетико-ригидный синдром;
- феномен чужой конечности;
- апраксия или нарушение сложных видов глубокой чувствительности;
- фокальная дистония в конечности;
- миоклония;
- грубый постуральный или кинетический тремор.
Особого внимания заслуживает синдром чужой конечности – сложный психосенсорный феномен, когда субъективные ощущения отчуждения конечности сочетаются с объективной автономной двигательной активностью. В результате так называемая чужая рука осуществляет разнообразные, синкинетические движения или движения, противоречащие действиям здоровой руки. Опасность заключается в целенаправленных действиях, поскольку рука может нанести непоправимый вред себе или хозяину.
К развитию когнитивных расстройств может привести и болезнь Крейтцфельдта – Якоба, или синдром Стила – Ричардсона – Ольшевского. Для данного заболевания характерно наличие триады симптомов в виде супрануклеарной офтальмоплегии, псевдобульбарного паралича и акинетико-ригидного синдрома. Нейровизуализация – один из наиболее важных методов, с помощью которого можно осуществлять дифференцированную диагностику нейродегенеративных заболеваний.
Основным отличием сосудистой деменции от деменции, вызванной нейродегенеративным процессом, является неравномерность поражения высших мозговых функций. Различают мультиинфарктную деменцию и деменцию вследствие единичного инфаркта. Мультиинфарктная деменция характеризуется острым началом и ступенчатым прогрессированием. Деменции вследствие инфаркта в стратегически важной зоне соответствует стабильное течение без нарастания когнитивного дефекта.
Выделяют несколько клинических вариантов сосудистой деменции. Наиболее типичным считается дисмнестический, или амнестический (близкий по проявлениям к корсаковскому синдрому), с преобладанием грубого снижения памяти на текущие события, дезориентацией в пространстве и времени, конфабуляцией, в меньшей степени – со снижением памяти на прошлые события. Для псевдопаралитического варианта характерны преобладание благодушно-эйфорического настроения, существенное снижение самокритики, гиперсексуальность, особенно у женщин среднего и пожилого возраста с коронавирусной инфекцией. В то же время при псевдопаралитическом варианте сосудистой деменции нарушения памяти выражены незначительно. Реже встречается асемический вариант (асемия – расстройство понимания условных знаков) с превалированием локальных корковых нарушений, прежде всего афазии, и ярко выраженным апато-абулическим синдромом.
К факторам риска когнитивных расстройств относят возраст старше 75 лет (хотя все чаще встречаются пациенты 40–50 лет с выраженными когнитивными расстройствами после перенесенного инсульта или коронавирусной инфекции), женский пол, черепно-мозговую травму, деменцию и/или синдром Дауна в семейном анамнезе, депрессивные расстройства, сахарный диабет, сосудистые заболевания (СЗ) головного мозга (ГМ).
Адекватная своевременная терапия, равно как и профилактика СЗ ГМ, способна предупредить развитие когнитивной дисфункции. Медикаментозная терапия и профилактика СЗ ГМ и осложнений осуществляется по принципу «АБС»: антигипертензивные средства, блокаторы тромбообразования и статины. Гипотензивная терапия эффективна в целях первичной и вторичной профилактики инсульта. Однако резко и чрезмерно снижать артериальное давление при СЗ ГМ не следует, поскольку можно спровоцировать ишемический инсульт у больных, имеющих к этому предпосылки.
Установлено, что при выраженном атеросклерозе сосудов ГМ при резком повышении артериального давления риск внутримозгового кровоизлияния значительно меньше, чем при свободной проходимости крупных мозговых сосудов. Поэтому активную гипотензивную терапию необходимо проводить тем пациентам, у которых отсутствуют признаки тромбокклюзирующего поражения.
Профессор В.В. Ковальчук акцентировал внимание коллег на психоэмоциональных расстройствах – невротических и депрессивных расстройствах, вегетативных и панических нарушениях. Среди невротических расстройств выделяют неврастению, невроз навязчивых состояний, истерию (диссоциативные расстройства, истерическое расстройство личности, тревожная депрессия, соматоформные расстройства).
Группа навязчивых состояний достаточно обширна и включает в себя навязчивые представления (звуковые, тактильные, вкусовые, зрительные), навязчивые мысли (навязчивые сомнения, опасения, воспоминания, кощунственные мысли и мудрствования), навязчивые страхи (пана-, нео-, никто-, ското-, бронто-, селенофобия и др.).
Среди навязчивых страхов выделяют страх ситуаций, например женитьбы (гамофобия), страх болезней (кардио-, канцеро-, лиссофобия и др.), животных (зоофобия), предметов и образов (агио-, цикло-, библио-, киберфобия и др.), людей (антропо-, социо-, погоно-, генофобия и др.). Существует страх чисел в целом (нумерофобия), 8 (октофобия) и 13 (трискадекафобия) в частности, страх замкнутых пространств (клаустрофобия) и открытых мест (агорафобия).
В группу навязчивых состояний также входят навязчивые действия. Они могут быть как отвлеченные и социально неопасные (артитромания), так и образные с тягостным содержанием и даже социально опасные (сексуальная пиромания при пирофилии).
Как известно, триада основных симптомов депрессии у взрослых состоит из подавленного настроения, не зависящего от обстоятельств, в течение длительного периода времени, ангедонии – потери интереса или удовольствия от ранее приятной деятельности, выраженной утомляемости, упадка сил. В настоящее время ангедонию рассматривают не только как один из критериев депрессии, но и как маркер ее тяжести.
В ряду профилактических факторов деменции особое место отводится циннамальдегиду, полифенолу (красное вино) и активации глимфатической системы. Циннамальдегид эффективно воздействует на тау-белок, препятствуя прогрессированию когнитивных расстройств. Он содержится в корице. Достаточной терапевтической дозой считается 1/4–1/2 чайной ложки корицы в день. Красное вино (ресвератрол) обладает специфическими защитными свойствами в отношении нервных клеток и способствует значительному повышению выживаемости клеток ГМ при инсульте. Наибольшая концентрация ресвератрола содержится в бордосском, бургундском (Пино Нуар) и винах из долины Вальполичелла.
Нарушение деятельности глимфатической системы приводит к нарушению выведения бета-амилоида и тау-белков. Сон – главное условие улучшения деятельности глимфатической системы ГМ. Во время сна глимфатическая система работает в два раза активнее, чем в период бодрствования. Наиболее эффективная поза во время сна – на боку.
«Таким образом, полноценный сон на боку, четверть чайной ложки корицы в сутки и пара бокалов ресвератрола могут оказать достойную профилактику когнитивных расстройств», – констатировал профессор В.В. Ковальчук.
К сожалению, в рутинной практике специалистам часто приходится прибегать не к профилактике, а к терапии когнитивных расстройств. Препаратами первого выбора при деменции считаются ингибиторы холинэстеразы и стимуляторы глутаматергической системы, оказывающие потенциал-зависимое и неконкурентное ингибирование NMDA-рецепторов и обладающие высокой биоэквивалетностью оригинальному лекарственному средству. К таким препаратам относится Мемантин Канон. Его применяют один раз в сутки по следующей схеме: первая неделя – 5 мг/сут, вторая неделя – 10 мг/сут, третья – 15 мг/сут, с четвертой недели и далее – 20 мг/сут.
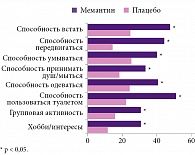
Мемантин Канон полностью биоэквивалентен референтному препарату. На фоне применения препарата Мемантин Канон в отличие от плацебо достоверно увеличивается повседневная активность пациентов (рис. 1)5.
В целом подход к лечению деменции и депрессии должен быть комплексным. Поскольку нейродегенерация лежит в основе многих неврологических и психиатрических заболеваний, а традиционные препараты не способны препятствовать ей, необходима новая терапевтическая стратегия, направленная на торможение нейродегенеративных процессов. С этой целью можно использовать нейроцитопротекторы, которые действительно эффективны при когнитивных расстройствах и отвечают главным требованиям. Нейроцитопротектор с вазоактивным компонентом соответствует трем основным условиям, предъявляемым к идеальному нейроцитопротектору, и трем условиям, предъявляемым к идеальному вазоактивному препарату. Именно таким вазоактивным препаратом является Винпотропил, который уменьшает сосудистое сопротивление, увеличивает потребление кислорода и глюкозы нервной тканью, способствует трансформации процесса распада на энергетически более экономный путь (аэробный).
Винпотропил сочетает в себе свойства нейроэнергокорректора и нейропротектора. Повышение лизосомальной активности нервной ткани, ускорение распада продуктов анаэробного гликолиза при приеме Винпотропила приводят к восстановлению процессов клеточной саморегуляции, стимуляция окислительного процесса – к стабилизации нейрональных мембран, нейрометаболическое и энергетическое обеспечение межнейрональной рецепции – к стимуляции синаптических процессов.
Нейроцитопротектор должен влиять на кальциевый сигнальный путь и активацию волокон голубого пятна (locus coeruleus). Почему так важна активация волокон голубого пятна? Дело в том, что locus coeruleus образует связи со всеми структурами мозга, отвечающими за когнитивные и психоэмоциональные реакции. Эффективная комбинация винпоцетина и пирацетама (Винпотропил) активирует locus coeruleus, влияет на кальциевые сигнальные пути и регулирует дофаминергические рецепторы, что крайне важно при когнитивных расстройствах. Препарат достоверно улучшает и восстанавливает память и внимание.
Эффективность, переносимость и безопасность Винпотропила подтверждены в ряде клинических исследований.
Винпотропил по праву можно назвать усиленным ноотропом. Выпускается в удобной форме – в виде делимой таблетки (10 мг винпоцетина и 800 мг пирацетама), а также в форме капсул (5 мг винпоцетина и 400 мг пирацетама). Винпотропил производится в соответствии со стандартом GMP.
Схема применения: Винпотропил в форме капсул 5/400 № 30 и 60 – по одной-две капсулы перорально (перед едой) два-три раза в день, поддерживающая терапия – по одной капсуле три раза в день; Винпотропил в форме таблеток 10/800 № 60 – по одной таблетке (независимо от приема пищи) два-три раза в день. Длительность курса – от двух-трех недель до 2–6 месяцев.
Обеспечение правильной нейропластичности является необходимым условием успешной терапии и реабилитации пациентов с нейрональными и нейрососудистыми нарушениями. Прежде всего это касается влияния на восстановление и формирование адекватных ключевых межнейрональных взаимодействий с помощью уменьшения общей численной плотности десмосомоподобных синапсов (неспециализированные, неконтролируемые контакты).
Нейроцитопротекция должна способствовать обеспечению структурных компонентов клеточных мембран. Доказано, что холитилин – незаменимый предшественник фосфатидилхолина (лецитина) – обеспечивает восстановление и синтез de novo фосфолипидов клеточных мембран, синтез ацетилхолина и дофамина6.
Следует помнить, что дефицит ацетилхолина при СЗ ГМ приводит к деструкции мембран для поддержания холинергической трансмиссии. Поэтому активация синтеза ацетилхолина является значимым требованием, предъявляемым к нейроцитопротектору. Таким свойством обладает препарат Холитилин, полностью биоэквивалентный референтному препарату.
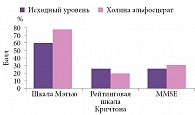
Показаниями к применению препарата Холитилин являются психоорганический синдром на фоне дегенеративных заболеваний и инволюционных процессов ГМ, первичные и вторичные когнитивные нарушения, нарушение поведения и аффективной сферы в пожилом возрасте, мультиинфарктная деменция. Применение холина альфосцерата у больных с неврологическим дефицитом ассоциируется с его выраженным регрессом, достоверным уменьшением функционального ограничения повседневной деятельности, улучшением когнитивных функций (рис. 2). Холитилин в форме раствора для внутримышечного или внутривенного введения назначают по 1000 мг/сут в течение 15–20 дней. Холитилин в форме капсул 400 мг применяют по схеме: одна капсула три раза в сутки в течение шести месяцев (продолжительность лечения определяет врач).
Еще одним незаменимым предшественником фосфатидилхолина является препарат Цересил Канон, способствующий коррекции метаболических и белоксинтетических процессов в сосудистой стенке и клетках, прежде всего в мембранах. Цересил Канон, содержащий японскую субстанцию, выпускается в ампулах и в виде раствора для приема внутрь. Цересил Канон назначают по одной ампуле (1000 мг) каждые 12 часов внутривенно капельно, внутримышечно с первых суток после ишемического инсульта или черепно-мозговой травмы. С пятого дня терапии применяют препарат в форме раствора для приема внутрь по 500–2000 мг один-два раза в день. Курс лечения – не менее шести недель.
Профессор В.В. Ковальчук акцентировал внимание коллег на синергизме действий компонентов комбинации – препаратов Винпотропил и МексиВ 6 при совместном применении.
Следует отметить, что МексиВ 6 содержит эффективную комбинацию этилметилгидроксипиридина сукцината с пиридоксином. Он по праву считается препаратом выбора при СЗ ГМ и возникновении симптомов астении и тревожности. Препарат назначают по одной таблетке три раза в сутки. Начальная доза – одна-две таблетки один-два раза в сутки с постепенным повышением дозы. Максимальная суточная доза – шесть таблеток. Курс лечения – 2–8 недель.
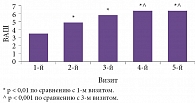
Под руководством профессора А.Н. Боголеповой было проведено исследование эффективности совместного применения МексиВ 6 и Винпотропила 10/800 у пациентов с хронической ишемией головного мозга 1–2-й стадии7. В первый месяц лечения пациенты получали МексиВ 6 по одной таблетке три раза в день, во второй месяц – комбинированную терапию препаратом МексиВ 6 по одной таблетке три раза в день и препаратом Винпотропил 10/800 по одной таблетке три раза в день. 93% пациентов отмечали улучшение самочувствия через две недели терапии препаратом МексиВ 6, 100% пациентов – спустя месяц лечения (рис. 3). В целом результаты исследования продемонстрировали, что комбинация препаратов МексиВ 6 и Винпотропил обеспечивает более эффективную терапию СЗ ГМ, более значимые клинические результаты. Комбинация рекомендована к назначению с ранних стадий развития патологического процесса.
Завершая выступление, профессор В.В. Ковальчук представил оптимальную схему терапии пациентов с СЗ ГМ (хроническая ишемия головного мозга, инсульт): на первом этапе в течение одного-двух месяцев проводится курсовое лечение препаратами Цересил Канон и Холитилин с целью максимизации эффекта и минимизации риска инвалидизации, на втором этапе с помощью препаратов МексиВ 6 и Винпотропил в течение длительного периода времени (6–12 месяцев) осуществляется основная и поддерживающая терапия.
Заключение
Результаты исследований показывают эффективность и безопасность тиоктовой кислоты в комплексном лечении больных ДПН. Приведенные экспертами данные также свидетельствуют о важной роли стимуляторов глутаматергической системы и нейроцитопротекторов в лечении пациентов с деменцией, когнитивными расстройствами, сосудистыми заболеваниями головного мозга.
Таким образом, «Канонфарма продакшн» предоставляет практическим врачам не только широкий выбор эффективных, безопасных и доступных лекарственных средств (Тиолепта, Мемантин Канон, Винпотропил, МексиВ 6, Холитилин, Цересил Канон), но и возможность осуществлять персонифицированный подход к лечению пациентов с когнитивными и психоэмоциональными нарушениями.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.