Диагностические маркеры тяжести перинатального поражения нервной системы у детей
- Аннотация
- Статья
- Ссылки


Изучение последствий перинатальных поражений нервной системы (ППНС) у детей представляет собой одну из самых актуальных задач педиатрии и неврологии, поскольку данные состояния оказывают существенное влияние не только на уровень летальности новорожденных и детей раннего возраста, но и на частоту нарушений их нервно-психического и физического развития.
Материалы и методы
С целью выявления предикторов, определяющих тяжесть поражения нервной системы, было проведено комплексное обследование 398 детей в возрасте от 2 до 16 месяцев с ППНС с катамнезом наблюдения более 10 лет. Дизайн обследования включал клиническую оценку соматического и неврологического статуса, нейросонографию, магнитно-резонансную томографию (МРТ) головного мозга, глобальную и стимуляционную электромиографию (ЭМГ и ЭНМГ), компьютерную электроэнцефалографию (ЭЭГ), тестирование на компьютерном комплексе для психофизиологических исследований «Психомат». Лабораторные обследования позволили определить уровень нейроспецифических маркеров поражения нервной системы – антител к фактору роста нервов (ФРН), активности нейтрофильной эластазы, антител к основному белку миелина, L1-протеазного ингибитора. Наблюдаемые пациенты консультировались офтальмологом, дефектологом, при необходимости ортопедом. Комплексное обследование 136 из 398 пациентов позволило выделить маркеры тяжести поражения нервной системы перинатального генеза. В период проведения обследований воспалительных заболеваний у пациентов не выявлено.
Результаты исследования
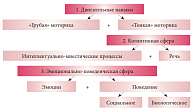
Оценка неврологического статуса проводилась количественным методом, в соответствии с которым каждая из обследуемых сфер: двигательная, эмоциональная, поведенческая (биологическое и социальное поведение) и когнитивная –
была оценена по шкале от 0 до
6 баллов, где 0 баллов означало отсутствие нарушений, а 6 баллов –
их максимальную выраженность (рис. 1, табл. 1). По результатам оценки наблюдаемые дети были разделены на следующие группы: контрольную – с оценкой 0 баллов (норма), первую (0,5–3 балла)
и вторую (3,5–6 баллов).
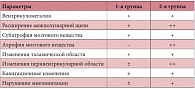
Клинический осмотр пациентов первой группы выявил задержку в становлении навыков моторной, психоречевой и эмоционально-поведенческой сферы разной степени выраженности, тогда как неврологический статус детей второй группы отражал грубое отставание в развитии во всех исследуемых сферах. По данным нейровизуализации у пациентов первой группы выявлялись следующие изменения: у 63% детей обнаруживалось расширение межполушарной щели, из них у 58% – с проявлениями резидуальной вентрикуломегалии.
У 53% отмечалась незначительная субатрофия мозгового вещества, у 26% – кавитационные изменения, у 16% – изменения перивентрикулярной области, у 47% – таламической области и у 16% – нарушение миелинизации (табл. 2).
У пациентов второй группы в 2 раза чаще, чем у детей в первой группе, выявлялись изменения перивентрикулярной области (35,3%) и нарушения миелинизации (38%). По другим нарушениям значительной разницы между пациентами первой и второй группы не отмечено, что подтвердило практическое наблюдение, в ходе которого фиксировались случаи несоответствия клинической и морфологической картины.
При проведении глобальной и стимуляционной миографии у пациентов обеих групп были зарегистрированы изменения, характерные для надсегментарного типа нарушения моторной интеграции (табл. 3). По сравнению с контрольной группой отмечалось достоверное укорочение времени дистальной латенции и нарастание амплитуды М-ответа:
в первой группе – до 11,3 ± 0,6 мВ,
а во второй – 12,03 ± 0,4 мВ (р < 0,05
и р < 0,01 соответственно, по сравнению с контрольной группой). Наиболее наглядной была разница между показателем коэффициента отклонения от возрастной нормы, который у детей второй группы был практически в 2 раза больше, чем у пациентов первой группы, и составлял 24,9 ± 4,1
и 12,4 ± 0,4% (р < 0,01 между группами). Проведенный корреляционный анализ между показателями стимуляционного миографического исследования и балльной оценкой клинических проявлений выявил прямую среднюю корреляцию (R = 0,34 ± 0,007; р < 0,05) между клинической тяжестью и скоростью проведения импульса по эфферентным волокнам (СПИ эфф.) большеберцового нерва, что указывало на то, что чем тяжелее клинические проявления, тем сильнее нарушено влияние надсегментарных структур на регуляцию моторной интеграции.
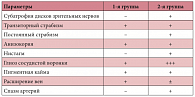
Оценка офтальмологического статуса позволила обнаружить у 71% пациентов второй группы с органическим поражением нервной системы частичную атрофию дисков зрительных нервов (табл. 4).
Нарушение рефракции у пациентов обеих групп было выражено практически в равной степени: у 13,2% пациентов первой и у 11,8% детей второй группы. У 81,6% больных первой группы наблюдался транзиторный сходящийся страбизм, у 8% пациентов он был постоянным (за счет дальнозоркости). У 29,4% детей второй группы выявлялось транзиторное сходящееся и расходящееся косоглазие, из них у 41% – стационарное сходящееся и у 23,5% – стационарное расходящееся (за счет частичной атрофии зрительного нерва). Динамическое наблюдение выявило, что неврологический страбизм со временем компенсируется, а рефракционный – усугубляется. Представляет интерес выявление у 63% больных первой и у 21% пациентов второй группы анизокории, часто непостоянной.
У 87% детей первой группы и у 53% пациентов второй группы диски зрительного нерва имели бледно-розовую окраску, наблюдалась деколорация с височных сторон. Скорость изменения окраски височных частей дисков зрительных нервов позволяла судить о степени созревания мозга и темпах миелинизации, что коррелировало с миографическими данными по скоростям проведения импульса по эфферентным волокнам.
У детей первой группы отмечалось наибольшее изменение вен в виде их расширения (74%) и асимметричности (71%), а у детей второй группы – наибольшее изменение артерий в виде сужения и извитости. Ангиопатия наблюдалась чаще у детей первой группы, чем у пациентов с тяжелым органическим поражением нервной системы, но у последних эти изменения являлись более грубыми.
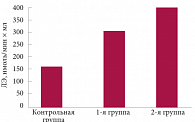
Основной поиск маркеров, отражающих тяжесть поражения нервной системы, осуществлялся путем лабораторных исследований: определение титра аутоантител к фактору роста нервов (анти-ФРН), активности лейкоцитарной эластазы (ЛЭ), аутоантител к основному белку миелина (анти-ОБМ) и протеазного ингибитора L1 (L1 ПИ). У наблюдаемых нами пациентов в зависимости от степени тяжести клинических проявлений отмечался достоверный рост концентрации ЛЭ в крови
(R = 0,5; р < 0,01). Так, у пациентов первой группы активность ЛЭ составляла 301 ± 17,1 нмоль/мин × мл
(р < 0,001 по сравнению с контрольной группой), а у пациентов второй группы – 396 ± 17 нмоль/мин × мл (р < 0,001); контрольные значения составили 164 ±
24 нмоль/мин × мл. Различия между средними величинами ЛЭ у больных первой и второй групп были статистически достоверными (р < 0,05) (рис. 2).
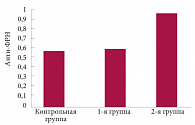
Показатели анти-ФРН у пациентов первой группы достоверно не отличались от нормы, а у больных второй группы выявлялось увеличение титра анти-ФРН, коррелировавшее с клинической тяжестью (прямая корреляция – R = 0,54,
р < 0,02). У пациентов второй группы в среднем значение анти-ФРН достигало 0,92 ± 0,07 (р < 0,003
по сравнению с контрольной группой (0,58 ± 0,17) и р < 0,02 по сравнению с пациентами первой группы (0,64 ± 0,07)) (рис. 3).
По данным нашего наблюдения, не отмечено достоверных изменений показателя анти-ОБМ у пациентов первой и второй групп по сравнению с контрольной. Возможно, это связано с возрастными особенностями миелинизации у детей, которая, по данным разных авторов, начинается около
5 месяцев жизни и заканчивается к 2 годам.
Активность L1 ПИ у детей первой группы была выше нормы и составляла 46,3 ± 2,5 МЕ/мл
(р < 0,01 по сравнению с контрольной группой (29,9 ± 1,2 МЕ/мл)) и практически не отличалась от нормативных показателей у детей второй группы (28,3 ± 1,9 МЕ/мл). Учитывая, что L1 ПИ является ингибитором ЛЭ и имеет защитные свойства, выявленные особенности представляются вполне логичными. При этом между ЛЭ и L1 ПИ была установлена обратная, средней интенсивности корреляция (R = -0,56 ± 0,02, р < 0,02).
Таким образом, результаты исследования показали, что наиболее значимыми лабораторными маркерами, позволяющими верифицировать степень клинической тяжести, являются ЛЭ и анти-
ФРН – значения этих показателей увеличивались по мере нарастания тяжести неврологических проявлений у детей первой и второй групп. Исходя из вышеизложенного, можно сделать вывод: чем выше уровень ЛЭ, тем сильнее степень поражения мозга при ППНС, а повышение на этом фоне уровня анти-ФРН является неблагоприятным признаком, указывающим на формирование органического дефекта, требующего максимального терапевтического вмешательства. Вероятно, уровень активности ЛЭ является маркером, указывающим на степень проницаемости гематоэнцефалического барьера, повреждение которого приводит к активации специфического иммунного ответа в виде синтеза анти-ФРН.
Таким образом, использование выявленных маркеров тяжести ППНС позволяет:
- дифференцировать степень тяжести последствий поражения нервной системы;
- оценить репаративные возможности детского мозга и предположить прогноз нарушений психомоторного развития;
- верифицировать в континууме эффективность проводимой терапии.
Выводы
Ведущими факторами, приводящими к возникновению перинатального поражения нервной системы, являются антенатальная и интранатальная гипоксия (50%) и внутриутробная инфекция (27%).
Структура синдромов последствий перинатального поражения нервной системы (ППНС) у детей раннего возраста имеет неоднородный характер и разную встречаемость. Наибольшую частоту и гетерогенность проявлений имеют нарушения двигательной сферы (68,5%). Они сопровождаются патологией психоречевого развития в 24% случаев, эмоционально-поведенческой сферы – в 14%, симптомами дисфункции вегетативной нервной системы – в 20%, парасомниями –
в 38%, судорожным синдромом –
в 7% случаев. Равномерная задержка темпов психомоторного развития у детей выявляется в 23% случаев.
Характер изменения мышечного тонуса у детей раннего возраста при выявлении патологии двигательной сферы определяет тяжесть и исход ППНС. Наиболее благоприятным в прогностическом плане является мышечный дистонус: у 41% детей отмечено выздоровление, у 3% – формирование органической патологии,
у 56% – функциональной. При мышечном гипертонусе в дальнейшем у 17% детей формируется органическая патология, а у 83% –
функциональные расстройства. Мышечная гипотония является наиболее неблагоприятным типом нарушения моторной интеграции и у 39% пациентов имеет исход в органическую, а у 61% – в функциональную патологию, что необходимо учитывать при подборе терапии.
При оценке степени тяжести поражения нервной системы объективными маркерами являются нейроспецифические иммунологические показатели анти-ФРН и ЛЭ. Они коррелируют с клиническими и миографическими показателями и данными офтальмологического исследования. При легком и среднем поражении нервной системы отмечается прямо пропорциональное тяжести повреждения нервной системы повышение уровня лейкоцитарной эластазы, при этом показатели уровня аутоантител к ФРН имеют нормальные значения. При тяжелом поражении нервной системы помимо повышения ЛЭ отмечается значительное увеличение уровня анти-ФРН.
Изменение офтальмологического статуса объективно отражает степень поражения нервной системы. При легкой и средней степени выявляются транзиторный страбизм, анизокория, на глазном дне –
глиоз сосудистой воронки, пигментная кайма и расширение вен. При тяжелом поражении нервной системы страбизм носит стойкий характер, выявляется нистагм, а на глазном дне часто обнаруживают субатрофию дисков зрительных нервов и артериоспазм.
Выраженность электромиографических критериев последствий перинатального поражения нервной системы: инкременция амплитуд мышечных ответов, укорочение ее дистальной латенции и увеличение площадей и коэффициента отклонения от возрастной нормы (по СПИ эфф.) – характеризует тяжесть поражения нервной системы.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.