Фетоплацентарный ангиогенез при преэклампсии. Клинико-морфологические аспекты
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. В исследование было включено 30 беременных с ПЭ, средний возраст – 29 ± 1,4 года. Беременные были разделены на две группы. Первую (основную) группу составила 21 беременная с ПЭ: десять пациенток находились на сроке до 34 недель гестации, 11 – на сроке 34–39 недель. Во вторую (контрольную) группу вошли девять пациенток с физиологически протекающей беременностью. Критериями включения были одноплодная беременность, наличие ПЭ по Международной классификации болезней 10-го пересмотра, добровольное информированное согласие на проведение исследования. Критерии исключения: экстрагенитальная патология, многоплодие, врожденные пороки развития плода. Значимых различий соматического и гинекологического статуса среди беременных обеих групп не выявлено.
Результаты. Приоритетное значение в развитии плацентарного ангиогенеза имеет фактор роста эндотелия сосудов (VEGF) и его рецепторы – VEGF R1 и VEGF R2. Баланс взаимодействия VEGF и рецепторов R1 и R2 приводит к адекватной васкуляризации ворсин на ранних стадиях инвазии трофобласта в спиральные артерии матки.
Заключение. Результаты проведенного морфологического исследования позволяют предположить, что важным фактором патогенеза плацентарной недостаточности и задержки роста плода являются гемодинамические показатели по Допплеру и ангиоархитектоники плацент. В отсутствие нарушений маточно-плацентарно-плодовой гемодинамики эндотелиальную дисфункцию следует рассматривать как компенсированную, при которой ожидаются благоприятные перинатальные исходы. Структурные изменения фетоплацентарного комплекса с нарушениями кровотока в маточных артериях и артерии пуповины при ПЭ расцениваются как субкомпенсированная и декомпенсированная формы плацентарной недостаточности.
Материал и методы. В исследование было включено 30 беременных с ПЭ, средний возраст – 29 ± 1,4 года. Беременные были разделены на две группы. Первую (основную) группу составила 21 беременная с ПЭ: десять пациенток находились на сроке до 34 недель гестации, 11 – на сроке 34–39 недель. Во вторую (контрольную) группу вошли девять пациенток с физиологически протекающей беременностью. Критериями включения были одноплодная беременность, наличие ПЭ по Международной классификации болезней 10-го пересмотра, добровольное информированное согласие на проведение исследования. Критерии исключения: экстрагенитальная патология, многоплодие, врожденные пороки развития плода. Значимых различий соматического и гинекологического статуса среди беременных обеих групп не выявлено.
Результаты. Приоритетное значение в развитии плацентарного ангиогенеза имеет фактор роста эндотелия сосудов (VEGF) и его рецепторы – VEGF R1 и VEGF R2. Баланс взаимодействия VEGF и рецепторов R1 и R2 приводит к адекватной васкуляризации ворсин на ранних стадиях инвазии трофобласта в спиральные артерии матки.
Заключение. Результаты проведенного морфологического исследования позволяют предположить, что важным фактором патогенеза плацентарной недостаточности и задержки роста плода являются гемодинамические показатели по Допплеру и ангиоархитектоники плацент. В отсутствие нарушений маточно-плацентарно-плодовой гемодинамики эндотелиальную дисфункцию следует рассматривать как компенсированную, при которой ожидаются благоприятные перинатальные исходы. Структурные изменения фетоплацентарного комплекса с нарушениями кровотока в маточных артериях и артерии пуповины при ПЭ расцениваются как субкомпенсированная и декомпенсированная формы плацентарной недостаточности.
Введение
Преэклампсия (ПЭ) – тяжелое осложнение беременности, которое является основной причиной материнской и перинатальной заболеваемости в 5–8% случаев. ПЭ приводит к различным акушерским проблемам: плацентарной недостаточности, задержке роста плода, преждевременным родам, кровотечению в родах и послеродовом периоде [1–3]. При этом преждевременные роды наблюдаются в 11% случаев [4].
Способа, позволяющего с достаточной степенью достоверности определить степень тяжести ПЭ, а также спрогнозировать ее течение, не существует [5–7]. Научные работы последних десятилетий посвящены возможностям прогнозирования ПЭ, разработке тестов на основании многофакторного анализа клинико-анатомических данных [8–10].
Многофакторный анализ позволяет выделять группы риска ПЭ для наблюдения, лечения с целью снижения акушерских осложнений, а также благоприятных перинатальных исходов [11–18].
В основе развития ПЭ лежит нарушенная плацентация с неадекватной инвазией цитотрофобласта и неполным ремоделированием спиральных артерий, снабжающих кислородом и питательными веществами плаценту [19].
Важным компонентом системы «мать – плацента – плод» является фетоплацентарный ангиогенез. При нарушении кровотока в маточно-плацентарно-плодовом комплексе развиваются осложнения беременности. Процесс васкуло- и ангиогенеза начинается до начала формирования плаценты и ремоделирования материнских сосудов. Важная роль в процессе фетоплацентарного ангиогенеза отводится семейству сосудистого эндотелиального фактора роста (VEGF) и его рецепторам – VEGF R1 и VEGF R2 [20].
VEGF A – один из важнейших регуляторов ангиогенеза, представлен полипептидами. Для него характерно высокое сродство к рецепторам VEGF R1 и VEGF R2 [21].
В результате нарушения фетоплацентарного ангиогенеза имеют место окислительный стресс в плаценте, выброс факторов эндотелиальной дисфункции в кровоток организма. Формирование эндотелиальной дисфункции приводит к ПЭ, задержке роста плода, его антенатальной гибели, обусловленной патологией плаценты.
В патогенезе эндотелиальной дисфункции особую роль играют нарушения созревания ворсинчатого дерева и дефект в ангиогенезе плаценты [22, 23].
Цель исследования – изучить фетоплацентарный ангиогенез у беременных с ПЭ на основании сопоставления результатов клинического обследования и морфометрического исследования последов с данной патологией.
Результаты исследования получены на основании изучения данных гемодинамических показателей фетоплацентарного комплекса с учетом морфологических особенностей плаценты.
Материал и методы
В исследование включено 30 беременных с ПЭ, средний возраст – 29 ± 1,4 года. Беременные были разделены на две группы. Первую (основную) группу составила 21 беременная с ПЭ: десять пациенток со сроком гестации до 34 недель, 11 – со сроком 34–39 недель. Во вторую (контрольную) группу вошли девять пациенток с физиологически протекающей беременностью. Диагноз устанавливали на основании критериев, указанных в Федеральных клинических рекомендациях Российского общества акушеров-гинекологов [24].
Критериями включения были одноплодная беременность, наличие ПЭ согласно Международной классификации болезней 10-го пересмотра, добровольное информированное согласие на проведение исследования. Критерии исключения: экстрагенитальная патология, многоплодие, врожденные пороки развития плода. Значимых различий соматического и гинекологического статуса среди беременных обеих групп не выявлено.
Все женщины прошли обследование в соответствии с приказом Минздрава России от 12 ноября 2012 г. № 572н «Об утверждении Порядка оказания медицинской помощи по профилю „акушерство и гинекология“ (за исключением использования вспомогательных репродуктивных технологий)». Всем беременным проводились общеклинические исследования, специальные – ультразвуковое исследование фетоплацентарного кровотока (ФПК), допплерометрия сосудов системы «мать – плацента – плод». В динамике изучались показатели кровотока в маточных артериях, средней мозговой артерии плода и артерии пуповины. В зависимости от данных допплерометрии к первой группе обследованных беременных были отнесены плоды с задержкой развития и нарушениями ФПК, ко второй – плоды с нормальными показателями допплерометрии.
Проведены макро- и микроморфологическое исследование последов и иммуногистохимическая оценка уровня экспрессии факторов роста эндотелия сосудов VEGF A и двух рецепторов – VEGF R1 и VEGF R2, а также оценка уровня экспрессии эндотелиальных маркеров CD 31 и CD 34, участвующих в ангиогенезе.
CD 34 отражает степень васкуляризации ворсин хориона и является ведущим показателем адекватности функции плаценты. С участием CD 31 происходит диапедез в очаге нарушенного ангиогенеза с развитием воспалительной реакции.
Исследование плаценты включает макроскопический анализ, определение формы долек, забор образцов ткани краевой, парацентральной и центральной зон как с материнской, так и с плодовой стороны. После стандартного гистологического исследования проведена иммуногистохимическая оценка.
При микроскопическом исследовании осуществлялась окончательная оценка зрелости ворсинчатого дерева, межворсинчатого пространства, сосудистого русла ворсин, синцитиальных почек, а также зон инфарктов плацентарной ткани. Иммуногистохимическое исследование проводилось на парафинированных срезах плацент толщиной 4–5 мкм с использованием стандартных протоколов и иммуногистостейнера Leica Bond Max (Leica Biosystem, Германия). В качестве антител использовали мышиные моноклональные антитела к CD 31 и CD 34 и кроличьи поликлональные антитела к VEGF R1, VEGF R2. Ядра клеток докрашивали гематоксилином.
Небольшое количество выборки обусловлено сложностью патоморфологического изучения плацент, а также использованием высокотехнологичного оборудования и высокой стоимостью иммуногистохимического анализа.
Статистическую обработку показателей выполняли с помощью программы IBM SPSS Statistics 25 (IBM, США) исходя из средних значений, стандартной ошибки средних, t-критерия Стьюдента и критерия χ2. Статистический анализ полученных данных проводили с использованием пакетов приложений Microsoft Office XP для статистической обработки материала и программы статистической обработки материала Statistica.
Результаты и их обсуждение
Первую группу составили беременные с ПЭ (n = 21), у которых при допплерометрии были выявлены нарушения маточного, пуповинного кровотока с задержкой развития плода (ЗРП) 2–3-й степени.
Настоящая беременность протекала на фоне токсикоза и угрозы прерывания в ранние сроки, преждевременных родов на 30–32-й неделе гестации. Развитие ПЭ отмечалось с 30 недель. При ультразвуковом исследовании выраженное маловодие выявлено у 12 пациенток, умеренное – у восьми из 21 пациентки.
Преждевременные роды произошли у восьми пациенток. Оперативное родоразрешение имело место в девяти случаях на разных сроках гестации в связи с тяжелой ПЭ, ухудшением состояния и отсутствием роста плода в динамике. У четырех новорожденных оценка по шкале Апгар составила 6 баллов на первой минуте жизни и 7 баллов – на пятой минуте, у восьми новорожденных – ЗРП 2–3-й степени.
У беременных первой группы с ПЭ на сроке до 34 недель и ЗРП с нарушением кровотока в маточных артериях неонатальные исходы были неблагоприятные. Восемь новорожденных из 21 были недоношенными и требовали лечения в отделении интенсивной терапии. Все новорожденные после стабилизации состояния переведены на второй этап выхаживания. Средняя масса детей составила 1980 ± 39,5 г. При морфологическом исследовании последа наблюдалась неправильная форма плацент массой 284,27 ± 5,1 г, что ниже относительно физиологической нормы для данного срока гестации.
При микроскопическом исследовании выявлены крупные инфаркты плаценты (16 из 21), тромбозы межворсинчатого пространства суббазальных и центральных зон, а также нарушение созревания ворсинчатого дерева, что является следствием нарушения материнского кровотока с последующим формированием ЗРП. При исследовании выявлена гиперплазия терминальных ворсин, синцитиальных почек, что свидетельствовало о запуске компенсаторно-приспособительных механизмов.
При иммуногистохимическом исследовании препаратов плаценты проведен анализ особенностей структуры с учетом экспрессии VEGF. Зарегистрирована слабо положительная экспрессия в ворсинах и эндотелии сосудов трофобласта при ПЭ. Зафиксировано развитие ЗРП 3-й степени с нарушением показателей допплерометрии как в маточных артериях, так и в артериях пуповины.
Приоритетное значение в развитии плацентарного ангиогенеза имеет фактор роста эндотелия сосудов (VEGF) и его рецепторы – VEGF R1 и VEGF R2. Баланс взаимодействия VEGF и рецепторов R1 и R2 приводит к адекватной васкуляризации ворсин на ранних стадиях инвазии трофобласта в спиральные артерии матки.
В условиях гипоксии при развитии ПЭ ключевым фактором является VEGF R1.
VEGF
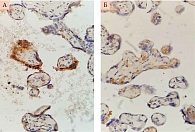
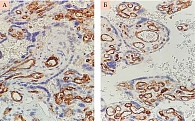
Адекватный ангиогенез и последующая васкуляризация крайне важны для выполнения всех клеточных функций организма. Плацентация млекопитающих требует обширного ангиогенеза для установления соответствующей сосудистой сети, чтобы поставлять кислород и питательные вещества растущему плоду. Cосудистый эндотелиальный фактор роста (VEGF) играет решающую роль в развитии нормальной сосудистой системы плаценты. VEGF экспрессируется умеренно в эндотелии сосудов в ворсинах трофобласта, на высоком уровне в ворсинах трофобласта при физиологической беременности и слабо положительно в ворсинах трофобласта и в эндотелии сосудов трофобласта при беременности, осложненной ПЭ (рис. 1). Снижение уровня VEGF и увеличение уровня его растворимого рецептора VEGF R1 (sFlt-1) (рис. 2) в крови свидетельствуют о развитии ПЭ.
VEGF R1
VEGF R1 считается ключевым фактором в возникновении ПЭ, поскольку увеличение уровня экспрессии этого рецептора вызывает изменения в трофобласте и эндотелии клеток, ингибируя пролиферацию клеток эндотелия и вазодилатацию. VEGF R1 экспрессируется умеренно в ворсинах трофобласта при физиологической беременности и на высоком уровне в ворсинах трофобласта и в эндотелии сосудов трофобласта при беременности, осложненной ПЭ (рис. 2).
VEGF R2
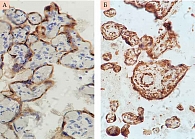
VEGF R2 наиболее выраженно экспрессируется в клетках эндотелия сосудов. Данный рецептор обладает мощной тирозинкиназной активностью и трансдуцирует основные сигналы для ангиогенеза. VEGF R2 экспрессируется слабо положительно в ворсинах трофобласта при физиологической беременности и на высоком уровне в ворсинах трофобласта и эндотелии сосудов трофобласта при беременности, осложненной ПЭ (рис. 3).
Изменения в фосфорилировании VEGF R2 могут быть непосредственно связаны с изменениями в ангиогенезе.
Исходя из изложенного, можно предположить, что при плацентарной недостаточности имеют место снижение экспрессии VEGF и выраженные изменения в его рецепторах. Это приводит к неадекватной инвазии трофобласта и ремоделированию спиральных артерий, вследствие чего нарушается баланс между поступлением крови от матери к плаценте и развитием плацентарной гипоксии.
CD 34
Преэклампсия связана с генерализованным эндотелиальным поражением или снижением функции эндотелия. Это свидетельствует о том, что повышенный эндотелиальный апоптоз и сниженный эндотелиальный регенерирующий потенциал могут играть важную роль в патогенезе данного заболевания. Эндотелиальные клетки экспрессируют CD 34 так же, как и гемопоэтические стволовые клетки. Точные функции белка CD 34 до сих пор не ясны, хотя его структура наводит на мысль о роли в качестве молекулы адгезии. Маркер экспрессируется умеренно в эндотелии сосудов в терминальных и стволовых ворсинах трофобласта при физиологической беременности. Уровень экспрессии CD 34 был выше в плацентах женщин с ПЭ (рис. 4). Повышение уровня CD 34 может быть обусловлено увеличением количества стволовых клеток для восстановления эндотелиальных клеток сосудов после генерализованного повреждения и дисфункции.
CD 31
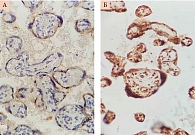
Эндотелиальные клетки позитивны при окрашивании антителами к CD 31. В ходе исследования установлено, что у пациенток с ПЭ интенсивность экспрессии маркера CD 31 снижается по сравнению с пациентками с нормальной физиологической беременностью (рис. 5). Уменьшение степени окрашивания может указывать на то, что CD 31-позитивные эндотелиальные клетки находятся в состоянии распада в качестве первого ответа на повреждающие или воспалительные действия.
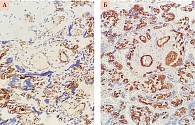
При морфометрии иммуногистохимических препаратов плаценты с использованием антител к CD 31 и CD 34 выявлено уменьшение количества кровеносных капилляров в одной ворсине. В связи с этим уменьшаются периметр ворсин и площадь обмена материнской крови с ворсинами.
Установлено, что при ПЭ среднее количество кровеносных капилляров на одну ворсину составляет 5,3 ± 0,3, в то время как на одну ворсину плацент женщин контрольной группы приходится в среднем 6,4 ± 0,4 кровеносного капилляра (p < 0,05). Кроме меньшего количества капилляров, приходящихся на одну ворсину плацент пациенток первой (основной) группы по сравнению с плацентами пациенток контрольной группы, меньше и средние значения периметра и площади капилляров: 224,5 ± 12,2 и 309,4 ± 20,6 мкм (p < 0,05); 145,9 ± 11,2 и 186,2 ± 10,7 мкм2 (p < 0,05) соответственно.
Согласно результатам иммуногистохимического исследования, в группе с ПЭ средний уровень экспрессии CD 31 составил 1,8 ± 0,2 балла, CD 34 – 2,3 ± 0,1 балла. В контрольной группе данные показатели были выше – 2,5 ± 0,2 и 2,9 ± 0,1 балла соответственно. Снижение уровня экспрессии эндотелиальных маркеров CD 31 и CD 34 в группе с ПЭ статистически достоверно (p = 0,005 и p = 0,033 соответственно).
Таким образом, CD 34 экспрессируется в эндотелиальных клетках, принимает участие в ангиогенезе и характеризует степень васкуляризации ворсин и активность плаценты. CD 31 участвует в ангиогенезе и обеспечивает васкуляризацию в очаге воспалительной реакции. Указанные факторы способствуют развитию предплацентарной гипоксии.
Заключение
Результаты проведенного морфологического исследования позволяют предположить, что важным фактором патогенеза плацентарной недостаточности и задержки роста плода являются гемодинамические показатели по Допплеру и ангиоархитектоники плацент. В отсутствие нарушений маточно-плацентарно-плодовой гемодинамики эндотелиальную дисфункцию следует рассматривать как компенсированную, при которой ожидаются благоприятные перинатальные исходы. Структурные изменения ФПК с нарушениями кровотока в маточных артериях и артерии пуповины при ПЭ расцениваются как субкомпенсированная и декомпенсированная формы плацентарной недостаточности.
Таким образом, ведение беременных с ПЭ и ЗРП требует особого подхода с учетом антенатальных показателей кровотока в системе «мать – плацента – плод».
N.Yu. Sakvarelidze, PhD, S.G. Tsakhilovа, PhD, Prof., V.S. Muradova, PhD, N.V. Zharkov, PhD, A.S. Zikova, V.V. Nasredinova
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
I.M. Sechenov First Moscow State Medical University
Contact person: Vera V. Nasredinova, nika.s07@list.ru
Purpose. To study placental angiogenesis in pregnant women with preeclampsia (PE), based on a comparison of the results of a clinical examination and a morphometric study of sequins with this pathology.
Material and methods. In the present work, we studied 30 pregnant women with PE, whose average age was 29 ± 1.4 years.
The pregnant women were divided into two groups. Group I (n = 21) consisted of pregnant women with PE, among whom 10 patients were within 34 weeks of gestation, and 11 – at 34–39 weeks. Group II (n = 9) – control group, with physiological pregnancy. The inclusion criteria were: singleton pregnancy, the presence of preeclampsia according to the ICD-10 classification, the patient's voluntary informed consent to the study. Exclusion criteria: extragenital pathology, multiple births, congenital malformations of the fetus. There were no significant differences in somatic and gynecological status among pregnant women in the surveyed groups.
Results. Vascular endothelial growth factor (VEGF) and its receptors, VEGF R1 and VEGF R2, are of priority importance in the development of placental angiogenesis. The balance of interaction between VEGF and R1 and R2 receptors leads to adequate vascularization of the villi in the early stages of trophoblast invasion into the spiral arteries of the uterus.
Conclusion. As a result of the morphological study, it can be assumed that hemodynamic parameters according to Doppler and angioarchitectonics of the placentas are an important factor in the pathogenesis of placental insufficiency and fetal growth retardation. In the absence of disturbances in uteroplacental-fetal hemodynamics, endothelial dysfunction should be considered as compensated, in which favorable perinatal outcomes are expected. Structural changes in the fetoplacental complex with impaired blood flow in the uterine arteries and umbilical cord arteries in PE are regarded as subcompensated and decompensated forms of placental insufficiency.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.