Диагностические возможности ПЭТ/КТ с 18F-ПСМА у пациентов с подозрением на рак предстательной железы
- Аннотация
- Статья
- Ссылки
- English
Цель – оценить возможность применения ПЭТ/КТ с 18F-ПСМА у пациентов с подозрением на РПЖ и неоднозначными данными уровня ПСА и мпМРТ.
Материал и методы. В исследование были включены 30 пациентов с подозрением на РПЖ с уровнем ПСА в «серой зоне» 2–10 нг/мл и Pi-RADS 3 по данным мпМРТ. Всем пациентам была проведена ПЭТ/КТ с 18F-ПСМА с последующей морфологической верификацией опухолевого процесса.
Результаты. У 7 (23,33%) из 30 пациентов имели место позитивные данные ПЭТ/КТ с 18F-ПСМА. Диагностическая модель, полученная при построении и последующем анализе ROC-кривой уровня SUV, показала высокие значения чувствительности (86%), специфичности (100%), диагностической точности (86%) и положительной прогностической значимости (100%) метода (площадь под ROC-кривой (AUC) 0,93) при референсных показателях накопления РФЛП (standardized uptake value (SUV) 2,5). Отрицательная прогностическая значимость составила 27%.
Заключение. Подтверждена высокая диагностическая точность ПЭТ/КТ с 18F-ПСМА в дифференциальной диагностике опухолевого процесса в предстательной железе при референсном показателе SUV > 2,5.
Мы рекомендуем проведение ПЭТ/КТ с 18F-ПСМА у пациентов с подозрением на РПЖ при неоднозначных показателях ПСА (2–10 нг/мл) и данных мпМРТ (Pi-RADS 3).
Цель – оценить возможность применения ПЭТ/КТ с 18F-ПСМА у пациентов с подозрением на РПЖ и неоднозначными данными уровня ПСА и мпМРТ.
Материал и методы. В исследование были включены 30 пациентов с подозрением на РПЖ с уровнем ПСА в «серой зоне» 2–10 нг/мл и Pi-RADS 3 по данным мпМРТ. Всем пациентам была проведена ПЭТ/КТ с 18F-ПСМА с последующей морфологической верификацией опухолевого процесса.
Результаты. У 7 (23,33%) из 30 пациентов имели место позитивные данные ПЭТ/КТ с 18F-ПСМА. Диагностическая модель, полученная при построении и последующем анализе ROC-кривой уровня SUV, показала высокие значения чувствительности (86%), специфичности (100%), диагностической точности (86%) и положительной прогностической значимости (100%) метода (площадь под ROC-кривой (AUC) 0,93) при референсных показателях накопления РФЛП (standardized uptake value (SUV) 2,5). Отрицательная прогностическая значимость составила 27%.
Заключение. Подтверждена высокая диагностическая точность ПЭТ/КТ с 18F-ПСМА в дифференциальной диагностике опухолевого процесса в предстательной железе при референсном показателе SUV > 2,5.
Мы рекомендуем проведение ПЭТ/КТ с 18F-ПСМА у пациентов с подозрением на РПЖ при неоднозначных показателях ПСА (2–10 нг/мл) и данных мпМРТ (Pi-RADS 3).
Рак предстательной железы (РПЖ) является одним из наиболее распространенных злокачественных новообразований (ЗНО) у мужчин и занимает второе место – 1 414 259 (14,1%) по количеству новых выявленных ЗНО в мире в 2020 г. РПЖ относится к часто выявляемым ЗНО – более чем в половине стран мира (112 из 185). При этом заболеваемость РПЖ существенно различается между странами с высоким индексом человеческого развития (ИЧР) и странами с низким ИЧР: 37,5 против 11,3 случая на 100 тыс. человек соответственно [1].
РПЖ делит четвертое и пятое место (6,8%) с опухолями пищевода в структуре смертности от ЗНО у мужчин после рака легкого, печени, кишечника и опухолей желудка [2].
Ранняя диагностика ЗНО является ключевым аспектом успешного лечения, увеличения продолжительности и повышения качества жизни пациента.
Клинические проявления ранних стадий РПЖ включают в себя прежде всего следующие симптомы: слабую или прерывистую струю мочи, ощущение неполного опорожнения мочевого пузыря, учащенное мочеиспускание, императивные позывы. Проблема в том, что данные симптомы не специфичны для РПЖ и могут возникать при других заболеваниях – уретрите, простатите, доброкачественной гиперплазии предстательной железы (ДГПЖ) и прочих [3].
Аналогичная ситуация складывается в отношении уровня простатического специфического антигена (ПСА): повышение может быть обусловлено воспалительными изменениями, ДГПЖ, инфарктом простаты, проведением пальцевого ректального исследования и рядом других факторов [4].
При уровне ПСА > 10 нг/мл РПЖ выявляется более чем у 60% пациентов, а при уровне ПСА в так называемой «серой зоне» (2–10 нг/мл) – только у 25–40% пациентов [5].
Традиционно первичная диагностика РПЖ состоит из пальцевого ректального исследования, определения уровня ПСА в сыворотке крови и трансректального ультразвукового исследования с дальнейшей верификацией диагноза с помощью биопсии, которая предполагает забор 12 биоптатов из различных анатомических областей предстательной железы [6, 7].
В связи с активным распространением и совершенствованием методов лучевой диагностики, согласно современным клиническим рекомендациям Ассоциации онкологов России, всем пациентам с установленным диагнозом РПЖ показано проведение магнитно-резонансной томографии (МРТ) предстательной железы для оценки распространенности опухолевого процесса. Пациентам с суммой баллов по шкале Глисона ≥ 7 рекомендовано выполнение мультипараметрической МРТ (мпМРТ) с использованием системы оценки Prostate Imaging Reporting and Data System (Pi-RADS) [6]. При этом Европейская ассоциация урологов (European Association of Urology, EAU) рекомендует выполнение мпМРТ всем пациентам перед биопсией предстательной железы для более точного выбора оптимального доступа при биопсии [8].
Несмотря на перечисленные методы диагностики, около трети случаев клинически значимых форм РПЖ остаются невыявленными [9].
Простатический специфический мембранный антиген (ПСМА) представляет собой трансмембранный гликопротеин 2-го типа, который экспрессируется на поверхности эпителиальных клеток предстательной железы в норме. При трансформации нормальных клеток предстательной железы в злокачественные количество рецепторов ПСМА увеличивается в 90% клеток и сверхэкспрессирует ПСМА в 100–1000 раз в зависимости от агрессивности опухоли (степень дифференцировки, метастатическая или гормон-резистентная форма заболевания). На этом основан метод позитронно-эмиссионной томографии (ПЭТ) с ПСМА-таргетными радиофармацевтическими лекарственными препаратами (РФЛП). Меченный радиоактивным трейсером ПСМА избирательно связывается с рецепторами ПСМА на поверхности нормальных и опухолевых клеток предстательной железы, преимущественно накапливаясь в опухолевых клетках. Физиологическая экспрессия ПСМА происходит в слюнных и слезных железах, почках, центральной нервной системе, двенадцатиперстной и толстой кишке [10].
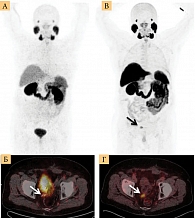
Сегодня используются два типа ПСМА-таргетных РФЛП: меченные галлием-68 (68Ga) и меченные фтором-18 (18F) препараты ПСМА с различными характеристиками. Во-первых, они отличаются способом производства: 68Ga-ПСМА изготавливается с помощью генератора германия-68, 18F-ПСМА – с помощью циклотрона. Во-вторых, 18F имеет более длительный период полураспада (110 минут), чем 68Ga (68 минут). В-третьих, 18F-ПСМА имеет более высокое разрешение и качество изображения по сравнению с 68Ga-PSMA (за счет более низкой энергии излучения позитронов – 0,65 МэВ по сравнению с 68Ga-ПСМА – 1,9 МэВ) и характеризуется меньшим выведением по мочевыводящим путям, чем 68Ga. Это позволяет добиться лучшей визуализации предстательной железы и лимфатических узлов, располагающихся около мочевого пузыря (рис. 1) [11–14].
Таким образом, ПЭТ/КТ с ПСМА может представлять большую ценность для диагностики РПЖ у пациентов с неоднозначными результатами МРТ (Pi-RADS 3) и ПСА («серая зона» – 2–10 нг/мл), в частности разграничения пациентов, имеющих показания к биопсии предстательной железы или активному наблюдению.
Цель – определить диагностические возможности ПЭТ/КТ с 18F-ПСМА для выбора оптимальной тактики ведения пациентов с подозрением на РПЖ при ПСА в «серой зоне» (2–10 нг/мл) и Pi-RADS 3 по данным мпМРТ.
Материал и методы
Исследование выполнено на кафедре онкологии и лучевой терапии Красноярского государственного медицинского университета им. проф. В.Ф. Войно-Ясенецкого. Сбор данных амбулаторных карт и ПЭТ/КТ-исследований проводился на базах Красноярского краевого клинического онкологического диспансера им. А.И. Крыжановского и Центра ядерной медицины Сибирского научно-клинического центра ФМБА России.
В исследование отобраны 30 пациентов с подозрением на РПЖ, основанным на показателях уровня ПСА в «серой зоне» 2–10 нг/мл и Pi-RADS 3 по данным мпМРТ. Всем пациентам проведена ПЭТ/КТ с 18F-ПСМА с дальнейшей верификацией процесса морфологически по данным биопсии.
ПЭТ/КТ выполнялась на томографе GE Discovery 600 на базе Центра ядерной медицины Сибирского научно-клинического центра ФМБА России. Обследования проводились натощак (последний прием пищи максимум за шесть часов до исследования). РФЛП 18F-ПСМА-1007 в дозе 200–300 МБк вводили внутривенно, через 80 минут проводилось сканирование. Всем пациентам выполнялось стандартное исследование в режиме «все тело» (от уровня глазниц до средней трети бедра) в сочетании с низкодозным КТ-сканированием для коррекции аттенуации ПЭТ-данных. Реконструкция изображения осуществлялась автоматически с дальнейшим совмещением (fusion) реконструированных ПЭТ- и КТ-данных.
Интерпретация ПЭТ данных выполнялась визуальным и полуколичественным способами. Визуально оценивали гиперфиксацию РФЛП в предстательной железе, ее характер (очаговый и/или диффузный), локализацию. Для полуколичественного анализа рассчитывали стандартизированное накопление РФЛП – standardized uptake value (SUV).
В качестве клинических и лабораторных параметров у больных РПЖ, включенных в исследование, оценивали возраст и уровень ПСА.
Обработка данных осуществлялась с помощью программы IBM SPSS Statistics 26. Оценка нормальности распределения признаков выполнена на основании одновыборочного критерия Колмогорова – Смирнова. Параметрические показатели представлены в виде среднего и среднеквадратичного отклонения, непараметрические – в виде медианы (Me), 10-го и 90-го перцентилей (C10–C90).
Кроме того, рассчитывали такие статистические показатели, как чувствительность, специфичность, прогностическая значимость и диагностическая точность ПЭТ/КТ с 18F-ПСМА, определяли референсный показатель SUV по построенной ROC-кривой с помощью показателя площади под кривой (AUC). Значение AUC 0,5–0,6 соответствует недостаточной диагностической эффективности, 0,6–0,7 – слабой, 0,7–0,8 – средней, 0,8–0,9 – хорошей, 0,9–1,0 – высокой.
Результаты
В исследование были включены 30 пациентов с подозрением на РПЖ. Критериями включения в исследование служили:
- уровень ПСА в «серой зоне» 2–10 нг/мл;
- структурные изменения предстательной железы, соответствующие Pi-RADS 3, по данным мпМРТ.
Всем обследуемым выполнены ПЭТ/КТ с 18F-ПСМА и дальнейшая биопсия с целью морфологического подтверждения злокачественного процесса. При отрицательных значениях биопсии всех пациентов отправляли на динамическое наблюдение с осмотром через шесть месяцев.
Средний возраст пациентов составил 71,7 ± 7,2 года. Согласно классификации Всемирной организации здравоохранения, больные были распределены на две возрастные группы: 60–74 лет – 19 (63,33%) пациентов и 75–79 лет – 11 (36,67%). Таким образом, практически две трети пациентов были в возрасте 60–74 лет.
Медиана значения ПСА у больных составила 8,62 [3,47–27,11] нг/мл.
У 7 (23,33%) из 30 пациентов получены позитивные данные ПЭТ/КТ с 18F-ПСМА. Среднее значение накопления SUV составило 12,22 ± 7,28. При сравнении с морфологическими данными у 6 (85,71%) пациентов из семи с признаками накопления РФЛП в предстательной железе был подтвержден РПЖ. У одного пациента гистологический тест оказался отрицательным, в том числе при повторной биопсии через 12 месяцев.
У оставшихся 23 (76,7%) пациентов результаты биопсии не подтвердили наличие злокачественного процесса, и только у 1 (4,35%) пациента при динамическом наблюдении через 12 месяцев повторной сатурационной биопсии был верифицирован РПЖ.
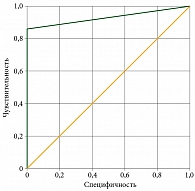
Диагностическая модель, полученная при построении и последующем анализе ROC-кривой уровня SUV, показала высокие значения чувствительности (86%), специфичности (100%), диагностической точности (86%) и положительной прогностической значимости (100%) метода. Отрицательная прогностическая значимость составила 27%, референсное значение SUV – 2,5, площадь под ROC-кривой (AUC) – 0,93 ± 0,093 (95%-ный доверительный интервал 0,73–1,0; p < 0,001). Это указывает на высокое качество прогностической модели (рис. 2).
Обсуждение
Анализ крупнейших отечественных и англоязычных баз данных (Elibrary, PubMed, Elsevier) показал редкую встречаемость исследований, посвященных оценке возможности ПЭТ/КТ с ПСМА-таргетными РФЛП в дифференцировке доброкачественных и злокачественных процессов в предстательной железе. Это, в частности, можно объяснить относительно недавним внедрением данного РФЛП в широкую клиническую практику [15–21].
Большинство исследований проводилось на небольшой выборке пациентов (от 15 до 97). Исследования существенно различались специфичностью (от 44,6 до 100%). Все они показали высокую чувствительность метода
(от 88,8 до 100%) [22].
В исследовании M.A. Hoffmann и соавт., основанном на анализе данных 25 пациентов, показано, что SUV > 2,5 демонстрирует наибольшую чувствительность (91,3%), специфичность (100%), диагностическую точность (92%) и положительную прогностическую значимость (100%) в выявлении первичного РПЖ. В то же время отрицательная прогностическая значимость составляет 50% [15].
Необходимо отметить также несколько исследований возможностей ПЭТ/КТ с ПСМА для прицельной биопсии предстательной железы у пациентов с подозрением на РПЖ или лиц с высокой вероятностью развития заболевания и отрицательными результатами предыдущих биопсий [19, 20, 23, 24].
В представленном исследовании оценивали результаты 30 ПЭТ/КТ с 18F-ПСМА у пациентов с подозрением на РПЖ. Полученные нами данные свидетельствуют о том, что ПЭТ/КТ с 18F-ПСМА (при референсном значении SUV > 2,5) является высокочувствительным (86%), высокоспецифичным (100%) и диагностически точным (86%) методом дифференциальной диагностики доброкачественного и злокачественного поражения предстательной железы. 100%-ный показатель положительной прогностической значимости метода позволяет разделить пациентов в зависимости от данных ПЭТ/КТ на две группы – нуждающихся в срочной биопсии предстательной железы (при SUV > 2,5) и подлежащих динамическому наблюдению. При этом невысокий показатель отрицательной прогностической значимости (27%) говорит о необходимости пристального активного наблюдения пациентов с отрицательными значениями ПЭТ/КТ с 18F-ПСМА.
Заключение
В нашем исследовании подтверждена высокая точность ПЭТ/КТ с 18F-ПСМА в дифференциальной диагностике доброкачественного и злокачественного процесса в предстательной железе. Референсный показатель SUV > 2,5 разделяет пациентов на подгруппы нуждающихся в проведении биопсии предстательной железы и подлежащих активному наблюдению.
Таким образом, приведенные данные позволяют рекомендовать проведение ПЭТ/КТ с 18F-ПСМА у пациентов с высоким риском РПЖ, основанным на уровне ПСА (2–10 нг/мл) и данных мпМРТ (Pi-RADS 3).
Финансирование. Исследование не потребовало дополнительного финансирования.
Конфликт интересов. Авторы сообщают об отсутствии конфликта интересов.
R.A. Zukov, PhD, Prof., V.V. Vyazmin, N.G. Chanchikova
V.F. Voyno-Yasenetsky Krasnoyarsk State Medical University
A.I. Kryzhanovsky Krasnoyarsk Regional Clinical Oncology Dispensary
Siberian Scientific and Clinical Center of the FMBA of Russia
Contact person: Ruslan A. Zukov, zukov_rus@mail.ru
Relevance. Prostate cancer (PC) is one of the most common malignant neoplasms in men. Every year, about 1.4 million new cases of prostate cancer are diagnosed in the world and 366,000 men die each year from this pathology. Despite the presence of a fairly wide range of diagnostic options in the early diagnosis of prostate cancer, primarily the determination of the level of prostate specific antigen (PSA) in the blood serum and multiparametric magnetic resonance imaging (mpMRI), there remains a group of patients with ambiguous values of the above indicators. The use of positron emission tomography combined with computed tomography (PET/CT) with a tumoritropic radiopharmaceutical drug (RFLP) 18F-PSMA improves the early diagnosis of prostate cancer, which is the key to success for successful treatment, duration and quality of life of the patient.
Material and methods. The study included 30 patients with suspected prostate cancer, based on the PSA level in the ʽgray zoneʼ 2–10 ng/ml and Pi-RADS 3 according to the MRI data. All patients underwent PET/CT with 18F-PSMA, with further morphological verification of the process.
Results. Out of 30 patients, 7 (23.33%) had positive PET/CT with 18F-PSMA. The diagnostic model obtained during the construction and subsequent analysis of the SUV level ROC-curve showed high values of sensitivity (86%), specificity (100%), diagnostic accuracy (86%) and positive predictive value (100%) of the method (area under ROC-curve (AUC) 0.93), with reference indicators of RFLP accumulation – standardized uptake value (SUV) 2.5. The negative predictive value was 27%.
Conclusion. Our study confirmed the high diagnostic accuracy of PET/CT with 18F-PSMA in the differential diagnosis of a tumor process in the prostate gland, with a reference indicator SUV > 2.5. We recommend 18F-PSMA PET/CT in patients with suspected PCa who have ambiguous PSA (2-10 ng/mL) and mpMRI (Pi-RADS 3) findings.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.