Оптимизация критериев отбора и оценки эффективности терапии радием-223 у больных раком предстательной железы
- Аннотация
- Статья
- Ссылки
- English


Рак предстательной железы (РПЖ) является одним из наиболее распространенных злокачественных новообразований у мужчин. В структуре онкологической заболеваемости мужского населения России он занимает второе место (14,9%), в структуре смертности от злокачественных новообразований – третье место (8,2%) после рака трахеи, бронхов, легкого и опухолей желудка. За последние десять лет интенсивные показатели заболеваемости РПЖ в России увеличились на 87,7%, стандартизированные – на 57,9% [1].
Лечебная тактика онкологических больных зависит от распространенности заболевания. При локализованных и местнораспространенных формах РПЖ современные методы терапии (хирургическое лечение, лучевая терапия) направлены на радикальное избавление от опухоли, что позволяет добиться относительно благоприятного течения заболевания в большинстве случаев. Тем не менее частота биохимического рецидива после хирургического вмешательства составляет 17–32% и зависит от типа оперативного пособия и стадии заболевания [2].
Несмотря на совершенствование методов диагностики РПЖ и внедрение простатспецифического мониторинга (ПСА – простатспецифический антиген), на момент установления диагноза практически у 20% пациентов определяется метастатический РПЖ, при котором радикальное лечение невозможно [1].
В силу указанных особенностей течения заболевания существует значительная группа больных РПЖ, у которых основным видом лечения является андрогендепривационная терапия или ее сочетание с ингибиторами андрогенного сигнала/химиотерапией в случае метастатической гормончувствительной формы РПЖ. Вместе с тем, несмотря на хороший инициальный ответ на данный вид лечения, у большинства пациентов со временем заболевание начинает прогрессировать, развивается кастрационно-резистентная форма РПЖ, ассоциируемая с неблагоприятным прогнозом [3]. Согласно современным клиническим рекомендациям, кастрационно-резистентный РПЖ (КРРПЖ) устанавливают при уровне тестостерона в сыворотке крови < 50 нг/дл, или 1,7 нмоль/л, в сочетании:
с биохимическим прогрессированием: три последовательных повышения уровня ПСА с разницей в одну неделю, с увеличением на 50% в двух измерениях от надира при уровне ПСА >2,0 нг/мл или
рентгенологическим прогрессированием – появлением новых очагов – двух или более очагов в костной ткани или очага в мягких тканях, согласно критериям RECIST [4].
У пациентов с КРРПЖ нередко развиваются костные, висцеральные и мягкотканные метастазы, а также поражаются лимфатические узлы. Поражение костной системы выявляется у подавляющего большинства пациентов (90%) [5, 6] и сопровождается развитием ряда осложнений, таких как болевой синдром [7], патологические переломы и связанная с ними компрессия спинного мозга [8], уменьшение подвижности, ухудшение качества жизни, выраженная инвалидизация [7]. Кроме того, развитие метастатического поражения костной системы ассоциировано с уменьшением общей выживаемости (ОВ) [5, 9].
Остановить стремительное прогрессирование заболевания и продлить жизнь пациентов с максимальным качеством – основная цель лечения. В течение последнего десятилетия количество опций, увеличивающих ОВ при метастатическом КРРПЖ (мКРРПЖ), значительно возросло. Речь идет об антиандрогенах нового поколения (абиратерон, энзалутамид), цитостатиках из группы таксанов (доцетаксел, кабазитаксел), иммунотерапии (олапариб, сипулейцел-Т) и единственном радиофармацевтическом лекарственном препарате (РФЛП) – радии-223 [4, 10].
Хлорид радия-223, зарегистрированный в России в конце 2016 г., постепенно появляется в различных регионах нашей страны под торговым названием Ксофиго® (АО «Байер»). Это первый таргетный РФЛП, терапевтическое действие которого обусловлено эмиссией альфа-частиц изотопа радия-223 и который продемонстрировал достоверное увеличение продолжительности жизни больных КРРПЖ с костными метастазами [11].
Как известно, костные метастазы приводят к сдвигу равновесия между клетками, продуцирующими костную ткань (остеобласты), и клетками-разрушителями (остеокласты). Преобладание тех или иных клеток определяет характер метастаза – литический, бластический, смешанный [12]. Действующее вещество препарата Ксофиго®, изотоп радия (радия (223Ra) хлорид), имитирует кальций и образует комплексное соединение с минералом костной ткани гидроксиапатитом. При этом следует подчеркнуть, что радий-223 – не прямой туморотропный препарат, он находит патологически измененную костную ткань, с преобладанием остеобластов, что обусловливает его эффективное влияние на бластические и смешанные метастазы, составляющие подавляющее большинство метастазов при РПЖ (70–90%) [13]. Дополнительно препарат воздействует на микроокружение опухолевых клеток, вызывая невосстанавливаемые разрывы двухцепочечной молекулы ДНК и сильный цитотоксический эффект, в том числе за счет bystander effect. Диапазон действия альфа-частиц радия-223 менее 100 мкм (менее десяти диаметров клетки), что минимизирует повреждение здоровых окружающих тканей и обеспечивает минимальную гематологическую токсичность.
В крупном международном многоцентровом двойном слепом плацебоконтролируемом исследовании ALSYMPCA с участием 921 пациента в группе радия-223 достоверно увеличилась ОВ, снизился риск симптоматических костных событий у больных мКРРПЖ по сравнению с группой плацебо. На основании положительных результатов данного исследования радий-223 был одобрен для применения в клинической практике в 2013 г. у больных КРРПЖ с костными метастазами и без висцеральных метастазов [11].
Критериями включения в исследование были симптоматические метаболически активные костные метастазы (два и более очага по данным остеосцинтиграфии), отсутствие висцеральных метастазов и поражение лимфатических узлов до 3 см в диаметре.
В ходе исследования отмечалось достоверное улучшение ОВ у больных, получавших радий-223, на 3,6 месяца по сравнению с группой плацебо (14,9 против 11,3 месяца, отношение рисков (ОР) 0,7; 95%-ный доверительный интервал (ДИ) 0,58–0,83; p < 0,001). Кроме того, зафиксировано увеличение медианы времени до первого симптоматического костного осложнения (15,6 против 9,8 месяца, ОР 0,66; 95% ДИ 0,52–0,83; p < 0,001). Остальные конечные вторичные точки также подтвердили несомненное преимущество применения радия-223 у данных пациентов (таблица) [11].
Как показал анализ полученных данных, эффективность радия-223 (ОВ и частота скелетных осложнений) не зависела от выраженности болевого синдрома [14]. ОВ была достоверно выше у пациентов, получивших пять и более инъекций радия-223, по сравнению с больными, которым было выполнено менее пяти введений препарата (17,9 и 6,2 месяца соответственно; р < 0,0001). Радий-223 обеспечивал значимое улучшение качества жизни пациентов, хорошо переносился и ассоциировался с минимальной гематологической токсичностью независимо от того, назначался ранее доцетаксел или нет [15]. Важный момент: применение радия-223 не препятствует последующему проведению терапии доцетакселом. Показатель ОВ у пациентов группы радия-223 превысил таковой в группе плацебо (14,4 и 11,3 месяца соответственно; p = 0,003). В III фазе клинических испытаний частота нежелательных явлений всех степеней тяжести оказалась выше в группе плацебо. Наиболее распространенными осложнениями терапии радием-223 были боль (50%), тошнота (36%) и анемия (31%) [11].
Одним из критериев оценки эффективности терапии радием-223 является мониторинг уровня щелочной фосфатазы (ЩФ) в сыворотке крови, но не уровня ПСА в отличие от гормональных агентов, чей механизм действия направлен на сигнальный путь андрогенных рецепторов, для которых уровень ПСА может указывать на терапевтический эффект [16, 17]. Подтверждение тому – снижение уровня ПСА на 30% в исследовании ALSYMPCA только у 16% пациентов, получавших альфа-радиотерапию, по сравнению с 6% пациентов группы плацебо (p < 0,001). При этом аналогичных показателей в снижении уровня ЩФ удалось достичь у 47% пациентов против 3% в группе плацебо, что коррелировало с ОВ [11]. Сказанное свидетельствует о том, что содержание ЩФ – более клинически значимый маркер, чем уровень ПСА, при костных метастазах у больных РПЖ. Изолированное повышение уровня ПСА не следует расценивать как показание к отмене терапии радием-223 [18]. Данные динамики уровней ЩФ и ПСА у пациентов, получавших терапию радием-223, требуют подтверждения в дополнительных клинических исследованиях. Определение других биомаркеров эффективности альфа-излучающего изотопа остается проблематичным [19].
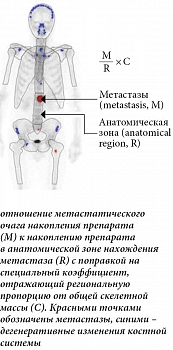
Перспективными биомаркерами в плане мониторинга эффективности лечения считаются радионуклидные количественные индексы метастазирования. Наиболее известен показатель bone scan index (BSI), отражающий количественную вовлеченность скелета в опухолевый процесс и представляющий собой отношение накопления препарата в патологических очагах к общему распределению препарата в скелете (рис. 1) [20].
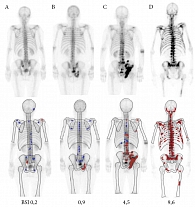
Данный индекс активно используется как при диагностике, так и при оценке эффективности терапии у больных РПЖ с костными метастазами. Одной из ключевых особенностей BSI является то, что объем метастатического поражения костной системы может быть объективно определен с помощью сцинтиграммы костей. У пациентов без метастазов BSI равен 0%, с увеличением количества определенных метастазов этот индекс возрастает. Немногочисленное метастатическое поражение скелета обычно соответствует BSI > 1%. Множественное распространенное поражение скелета, или суперскан (генерализованное поражение костной системы), обычно соответствует значениям BSI от 5 до ≥ 10% [20] (рис. 2).
Исследование показало, что изменение BSI с поправкой на уровень ПСА считается прогностическим через три и шесть месяцев лечения, тогда как изменение уровня ПСА с поправкой на BSI таковым не является (рис. 3) [21]. Кроме того, удвоение BSI у пациентов с мКРРПЖ приводит к увеличению риска смерти в 1,9 раза [22]. ОВ у пациентов с мКРРПЖ и пониженным уровнем BSI также выше, чем у других пациентов [21].
Следующий этап оценки количественной опухолевой нагрузки у пациентов – позитронно-эмиссионная томография/компьютерная томография (ПЭТ/КТ), которая в силу лучшей чувствительности и разрешающей способности ПЭТ-сканеров позволяет эффективнее выявлять количество очагов и оценивать степень поражения костного мозга [23].
Многообещающие результаты получены и при использовании диффузионно-взвешенной магнитно-резонансной томографии при оценке ответа на терапию радием-223 [24]. Но для большей объективизации результатов двух указанных методов визуальной диагностики требуются дополнительные данные. Таким образом, наиболее распространенным методом диагностики костных метастазов у больных РПЖ на сегодняшний день остается остеосцинтиграфия.
В настоящее время рекомендации по назначению терапии радием-233 сводятся к следующему. Применение радия-223 показано больным КРРПЖ с метаболически активными костными метастазами – два очага и более, при отсутствии висцеральных метастазов и лимфаденопатии не более 3–4 см в диаметре. Наличие «симптомных» костных метастазов остается спорным критерием отбора из-за широкого диапазона проявлений костной боли, а также в силу полученных в исследовании ALSYMPCA данных о том, что эффективность радия-223 (ОВ и частота скелетных осложнений) не меняется у больных как с выраженными, так и с минимальными симптомами [14]. Эти данные нашли подтверждение в крупном исследовании III фазы iEAP: радий-223 также продемонстрировал эффективность у пациентов с асимптоматическими костными метастазами [25].
Начальный уровень гемоглобина должен составлять ≥ 100 г/л, число тромбоцитов ≥ 100 × 109/л, нейтрофилов ≥ 1,5 × 109/л. Перед последующими введениями препарата уровень гемоглобина должен быть ≥ 80 г/л, показатели тромбоцитов и нейтрофилов ≥ 1×109/л и ≥ 50 × 109/л соответственно. При этом не следует забывать о более продолжительной ОВ у пациентов, получивших пять и более инъекций радия-223, по сравнению с больными, которым было выполнено менее пяти введений препарата [4, 11].
В то же время предварительные результаты исследования, в котором сравнивали эффективность радия-223 с доцетакселом и эффективность доцетаксела при КРРПЖ, показали безопасность комбинации альфа-радиотерапии и химиотерапии. У пациентов, получавших комбинированную терапию, чаще отмечалась нормализация уровня ЩФ (снижение на более чем 80% – 39 и 18% пациентов соответственно), а также регистрировались более высокие показатели выживаемости без прогрессирования (6,2 и 4,8 месяца соответственно) по сравнению с больными, которым назначали только химиотерапию [26]. В настоящее время ожидаются результаты исследования III фазы, посвященного оценке эффективности и безопасности комбинированной терапии радием-223 и доцетакселом в сочетании с андрогендепривационной терапией. Подобная комбинация не зарегистрирована, и ее применение рекомендуется только в рамках клинических исследований.
Назначение радия-223 в комбинации с остеомодифицирующими агентами (бисфосфонаты и деносумаб) ассоциируется с увеличением ОВ и отсрочкой появления первого костного осложнения, без ущерба безопасности лечения [25, 27].
Заключение
В течение последних лет количество лечебных опций для больных КРРПЖ существенно увеличилось, в том числе за счет появления системной альфа-радиотерапии радием-223. Радий-223, зарегистрированный в России в конце 2016 г. под торговым названием Ксофиго®, постепенно становится доступным для большего количества пациентов в разных регионах нашей страны.
Радий-223 увеличивает ОВ и время до первого костного осложнения при КРРПЖ с костными метастазами. Применение радия-223 ассоциируется с повышением качества жизни пациентов, хорошей переносимостью и минимальной гематологической токсичностью.
Полученные данные позволяют рекомендовать раннее назначение радия-223, на этапе выявления костных метастазов, до развития висцеральных метастазов. В частности, при прогрессировании заболевания на фоне терапии абиратероном или энзалутамидом назначение радия-223 можно рассматривать как лучший выбор по сравнению с альтернативной химиотерапией. Эффективность комбинации радия-223 и системной противоопухолевой терапии остается предметом изучения. Перспективными представляются разработка и внедрение количественных радионуклидных биомаркеров, обеспечивающих мониторинг безопасности и эффективности в процессе терапии радием-223.
V.V. Vyazmin, N.Yu. Shumilina, R.A. Zukov, PhD, Prof.
V.F. Voyno-Yasenetsky Krasnoyarsk State Medical University
A.I. Kryzhanovsky Krasnoyarsk Regional Clinical Oncology Dispensary
Contact person: Ruslan A. Zukov, zukov_rus@mail.ru
Castration-resistant prostate cancer (CRPC) with bone metastases is an adverse form of the prostate cancer associated with decreased overall survival (OS) and poor patient quality of life. Stopping the rapid progression of the disease and prolonging the patient's life in its maximum quality are the main goals of treatment. Over the past decade, there has been a real breakthrough in the number of options that increase OS in metastatic castration-resistant prostate cancer (mCRPC). One of the drugs is the only radiopharmaceutical radium-223. This article discusses the mechanisms of action of radium-223, optimization of patient selection parameters for this therapy, and methods for assessing the effectiveness and prognosis of treatment of mCRPC in patients receiving radium-223.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.