Диагностика вагинальных инфекций: традиционные методы и современные решения
- Аннотация
- Статья
- Ссылки





Для диагностики инфекционных заболеваний нижнего отдела генитального тракта, сопряженных, как правило, с воспалительными процессами органов малого таза различной этиологии, обычно используются традиционные лабораторные методы. Согласно приказу от 01.11.2012 № 572н «Об утверждении Порядка оказания медицинской помощи по профилю “акушерство и гинекология (за исключением использования вспомогательных репродуктивных технологий)”» обследование начинается с микроскопического исследования отделяемого женских половых органов на аэробные и факультативно-анаэробные микроорганизмы. При подозрении на инфекции, передающиеся половым путем (ИППП), проводятся молекулярно-биологические (полимеразная цепная реакция – ПЦР) и бактериологические исследования на аэробные и факультативно-анаэробные микроорганизмы и определение чувствительности к антибиотикам. Каждый из этих методов имеет свои преимущества и объективные ограничения, которые врачу-клиницисту необходимо учитывать при подборе индивидуальных алгоритмов обследования пациенток.
Метод микроскопии известен как самый быстрый и дешевый. Он решает следующие основные задачи:
- выявление возбудителя в клиническом материале;
- ориентировочная идентификация микроорганизмов на основе определения характерных морфологических признаков;
- изучение окрашенных мазков из колоний чистых культур.
Тем не менее использование микроскопии для диагностики инфекционных заболеваний сопряжено с низкой чувствительностью метода, субъективностью результатов и приблизительной количественной оценкой. Так, при диагностике трихомониаза микроскопический метод имеет самую низкую чувствительность, а именно: для мужчин – 10–12%, для женщин – 50–60%. Такие низкие показатели микроскопии обусловлены потерей микроорганизмом характерной подвижности после извлечения во внешнюю среду, тогда как метод ПЦР достоверно определяет возбудителя в 90–96% случаев.
Особенно затруднительно определение возбудителя заболевания в препаратах, содержащих значительное количество клеток эпителия и лейкоцитов. Сравнение чувствительности микроскопических методов исследования и ПЦР применительно к таким микроорганизмам, как Neisseria gonorrhoeae и Chlamydia trachomatis, свидетельствует, что в первом случае частота выявляемости патогена методом микроскопии у мужчин составляет 80–95%, у женщин – 30–50%, а во втором – 10–12%. При этом использование метода ПЦР дает возможность определять указанные микроорганизмы с частотой более 95% [6–12].
Традиционно при световой микроскопии выявляют не более 10 морфотипов: Lactobacillus spp., Gardnerella vaginalis, Bacteroides spp., Mobiluncus spp., Fusobacterium spp., Leptotrihia spp., Veillonella spp., Candida spp. и др. При этом морфотипы факультативно-анаэробных бактерий морфологически однотипны у многих видов и родов бактерий – колиформные палочки или грамположительные кокки. Например, Atopobium vaginae не имеет специфических микроскопических признаков, как Gardnerella vaginalis и Mobiluncus spp., и выглядит под микроскопом как обычная коринебактерия, довольно часто встречающаяся у здоровых женщин. При этом данный микроорганизм является одним из основных факторов развития рецидивирующих дисбиотических нарушений микробиоценоза урогенитального тракта, бактериального вагиноза и его осложнений.
Кроме того, при микроскопии мазков можно выявить микроорганизмы, присутствующие в биоматериале в количестве, обычно превышающем 105 КОЕ/мл, тогда как многие факультативно-анаэробные и аэробные бактерии могут проявлять патогенный эффект при сравнительно небольшом их количестве (до 104 КОЕ/мл), которое не выявляется при микроскопии, что снижает диагностическую ценность микроскопического исследования вагинального отделяемого.
В связи с этим возникает проблема установления этиологии воспалительного процесса/дисбиоза и определения тактики ведения пациента и, как следствие, наблюдается увеличение числа рецидивов.
«Золотой стандарт» лабораторных исследований, которым считается культуральный метод (бактериологический посев), позволяет обнаруживать все живые культивируемые микроорганизмы и определять антибиотикоустойчивость выявленных микроорганизмов, то есть по сути является наиболее клинически ориентированным, предоставляя врачу рекомендации по выбору препаратов. Тем не менее у культурального метода существуют объективные ограничения:
- отсутствие возможности культивирования большинства анаэробных микроорганизмов, являющихся наиболее частой причиной урогенитальных заболеваний у женщин;
- длительные сроки культивирования – от пяти дней и выше;
- жесткие условия хранения и транспортировки биоматериала;
- повышенные требования к организации лаборатории и диагностическим средам.
При четком соблюдении требований к качеству взятия, хранения и транспортировки биологического материала чувствительность культурального метода, например, при диагностике гонореи у мужчин составляет 95–98%, тогда как у женщин – не более 80–85%, в случае выявления трихомонады – 70–85%, хламидии – 60–80%.
Таким образом, традиционные методы лабораторного исследования – микроскопия и микробиология не всегда позволяют осуществить объективную диагностику воспалительных заболеваний нижнего отдела генитального тракта, что обусловливает клиническую потребность в использовании новых диагностических методов, в первую очередь молекулярно-генетических, в частности метода ПЦР.
ПЦР-диагностика – это один из наиболее достоверных методов выявления инфекций в организме человека. Метод позволяет определить наличие возбудителя заболевания, даже если он присутствует в исследуемом материале в незначительном количестве (всего несколько молекул его ДНК или РНК), что делает ПЦР одним из самых высокочувствительных и специфичных методов.
Метод ПЦР особенно эффективен при выявлении труднокультивируемых, некультивируемых, требующих сложной питательной среды и персистирующих форм микроорганизмов, с которыми часто приходится сталкиваться при латентных и хронических инфекциях, поскольку этот метод позволяет избежать сложностей, связанных с выращиванием микроорганизмов в лабораторных условиях.
Классическая ПЦР, позволяя идентифицировать в исследуемом материале искомые микробные агенты, клинически значима для обнаружения патогенных микроорганизмов, таких как Chlamydia trachomatis, Neisseria gonorrhoeae, Trichomonas vaginalis, Mycoplasma genitalium. Выявление данных микроорганизмов достаточно для принятия решения о назначении адекватной терапии.
В настоящее время заболевания, вызываемые условно патогенной микрофлорой, доминируют среди причин, по которым женщины обращаются к акушеру-гинекологу. Особенно стоит отметить, что данные процессы могут протекать без привычных клинических проявлений и ярко выраженных симптомов. Существенный вклад в бессимптомное течение заболевания вносят распространенные среди пациентов самодиагностика и самолечение, способствующие развитию такой клинической картины, в которой преобладают хронические и рецидивирующие формы.
Для диагностики заболеваний, вызванных условно патогенной микрофлорой, выявления факта наличия или отсутствия микробов недостаточно, поскольку данные микроорганизмы могут присутствовать как у здоровых женщин, так и при патологии. Клинически значимым является установление количественных соотношений компонентов нормальной и условно патогенной микрофлоры, что возможно при использовании метода ПЦР в реальном времени (PCR real-time) – исследований Фемофлор®. Исследования Фемофлор® включают количественное определение контроля взятия материала (КВМ), общей бактериальной массы (ОБМ), компонентов нормальной флоры (лактобактерии) и условно патогенных микроорганизмов (до 23 видов этиологически значимых аэробных и анаэробных микроорганизмов), дрожжеподобных грибов, микоплазм. Данная методика позволяет дифференцировать состояние микробиоценоза, выделяя нормоценоз (абсолютный, относительный), умеренный/выраженный дисбиоз (аэробный, анаэробный, смешанный), и определять наиболее эффективные в каждом отдельном случае терапевтические или коррекционные мероприятия [6].
Для решения различных клинических задач было разработано несколько вариантов исследования Фемофлор®, в состав каждого из которых входят те микроорганизмы, которые имеют значение для диагностики данного состояния (табл.).
Предлагаемая форма выдачи результатов с использованием цветовых маркеров и комментариев позволяет врачу быстро и грамотно оценивать результат исследования (рис. 1, 2).
Для получения корректных результатов принципиальное значение имеет качество взятия биоматериала для исследования, который должен содержать достаточное количество эпителиальных клеток человека (КВМ более 104), так как основная масса микроорганизмов, участвующих в создании микробиоценоза, локализована на поверхности эпителия, составляя так называемую биопленку. Именно микробная пленка вместе с поверхностными слоями эпителия, а не содержимое просвета является адекватным для исследования материалом.
Наиболее остро вопрос адекватной диагностики стоит при предгравидарной подготовке и ведении беременности, поскольку своевременно не диагностированные инфекции, ассоциированные с условно патогенной микрофлорой, могут стать причиной нарушения репродуктивной функции женщины, спонтанных абортов, преждевременных родов, внутриутробного инфицирования и низкой массы тела плода, постнатальных осложнений, а также осложнений в случае хирургических вмешательств на органах малого таза. В послеродовом периоде нарушения в балансе микрофлоры влагалища могут стать причиной серьезных инфекционных осложнений у родильниц: метроэндометрита, перитонита, сепсиса.
При этом интерпретация результатов количественного анализа состояния микробиоценоза урогенитального тракта должна обязательно проводиться с учетом клинической картины. Это связано с тем, что ранее принятая система назначения терапии, в том числе назначение антибиотиков на основании выявления определенных количеств отдельных представителей условно патогенной флоры урогенитального тракта (в первую очередь Ureaplasma и Mycoplasma), привела к стремительному росту антибиотикорезистентности, увеличению числа случаев рецидивирующего бактериального вагиноза и дисбиоза.
Так, на Междисциплинарном российском консенсусе по генитальным микоплазмам в 2006 г. был сформирован документ, принятый на совместном совещании дерматовенерологов, акушеров-гинекологов, урологов, клинических микробиологов, организаторов здравоохранения Российской Федерации, в котором указано: «Ureaplasma spp. и Mycoplasma hominis присутствуют на слизистых оболочках и в выделениях урогенитального тракта у 40–80% практически здоровых людей репродуктивного возраста в количестве менее 104 КОЕ/мл. Лечение следует назначать при наличии клинических проявлений воспалительного процесса и в случае, если U. urealyticum и M. hominis выявляются в количестве более 104 КОЕ/мл».
На данный момент однозначных доказательств клинической значимости результатов количественного определения отдельных микроорганизмов (Ureaplasma spp. и M. hominis) не существует. В связи с этим в Клинических рекомендациях по ведению больных с инфекциями, передаваемыми половым путем, и урогенитальными инфекциями Российского общества дерматовенерологов и косметологов (2012) указано: «При выявлении M. hominis и/или Ureaplasma spp. в количестве более 104 КОЕ/мл (или ГЭ/г) и при отсутствии клинических и/или лабораторных признаков воспалительного процесса мочеполовой системы лечение не проводится. Показанием к проведению лечения при отсутствии клинических признаков воспалительного процесса является выявление Ureaplasma spp. и/или M. hominis у доноров спермы, лиц с диагнозом “бесплодие” и женщин с невынашиванием беременности и перинатальными потерями в анамнезе. Половые партнеры лиц, инфицированных Ureaplasma spp. и/или M. hominis, подлежат лечению при наличии у них клинической симптоматики и лабораторных признаков воспалительного процесса мочеполовых органов (при исключении иной этиологии данного воспалительного процесса)» [5].
Исходя из современных рекомендаций в алгоритм интерпретации результатов Фемофлор® введен дифференциальный подход к оценке нормоценоза у женщин репродуктивного возраста. Он предусматривает определение состояний:
- абсолютный нормоценоз – количество бактерий рода Lactobacillus составляет не менее 80% от общей бактериальной массы, микроорганизмы из группы урогенитальных микоплазм не превышают значения 104 КОЕ/мл (рис. 3);
- относительный нормоценоз – на фоне доминирования лактобактерий (не менее 80% от ОБМ) количество урогенитальных микоплазм более 104 КОЕ/мл [1, 4].
Такой подход играет принципиальную роль при анализе результатов, полученных у беременных, поскольку у некоторых женщин в начале беременности максимальное количество условно патогенных генитальных микоплазм (M. hominis и Ureaplasma spp.) может достигать 106 КОЕ/мл без проявления клинических симптомов дисбиоза [2, 3].
Одной из ключевых особенностей технологии Фемофлор® является возможность идентификации и количественный анализ условно патогенных анаэробов, недоступных для обнаружения культуральным методом в рутинных лабораторных условиях (рис. 4). Тем не менее именно эта группа микроорганизмов играет важную роль в развитии гнойно-септических осложнений в послеоперационном периоде (например, после операции кесарева сечения, вульв- и гистерэктомии). В 25% случаев возбудителей осложнений определяют как «неустановленную микрофлору», что существенно затрудняет назначение этиотропной терапии. Следует отметить, что проведение данного анализа при подготовке к плановым гинекологическим операциям является важным шагом на пути профилактики послеоперационных осложнений.
Проведение анализа состояния микробиоценоза влагалища является важным этапом при реализации стратегии повышения качества жизни женщин в период постменопаузы. Это связано с тем, что возрастные изменения эстрогенового статуса обусловливают морфологическую перестройку многослойного плоского эпителия и сопровождаются изменениями кровотока влагалищной стенки. Синтез гликогена клетками эпителия влагалища находится под контролем эстрогенов, отсутствие гликогена, являющегося основным субстратом питания лактобактерий, приводит к резкому снижению количества нормофлоры. По сравнению с группой здоровых женщин репродуктивного возраста в постменопаузу происходит снижение общей бактериальной массы до 105,2–106,9 ГЭ/мл, уменьшение количества лактобатерий, снижение их доли в микробиоценозе, возрастает влияние анаэробных микроорганизмов (Gardnerella и др.). В вагинальном биоценозе происходит замещение лактобактерий представителями облигатно-анаэробной флоры [4].
Перечисленные изменения определяются как атрофический (сенильный) кольпит, коррекция которого с использованием заместительной гормональной терапии приводит к восстановлению микробиоценоза до уровня репродуктивного возраста.
Важно отметить, что комплексный подход к оценке состояния флоры урогенитального тракта целесообразен при широком спектре состояний, в том числе при анализе восстановления микробиоценоза после проведенной антибактериальной терапии, в случае использования внутриматочной спирали, при стрессовых воздействиях на организм (переохлаждение, смена климата, нарушение режима питания и авитаминоз), в ситуации частой смены половых партнеров. Для решения всех перечисленных задач может быть успешно использована диагностика методом Фемофлор®.
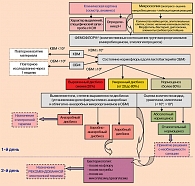
Таким образом, правильный выбор различных методов исследования генитального тракта женщин – микроскопии, микробиологии, ПЦР в реальном времени, основанный на сочетании достоинств и знании объективных ограничений методик (рис. 5), позволит акушеру-гинекологу подбирать рациональный диагностический алгоритм для каждого клинического случая, делая обследование пациенток информативным, а терапию – индивидуальной и эффективной.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.