Актуальное состояние и перспективы антибактериальной терапии инфекций верхних дыхательных путей
- Аннотация
- Статья
- Ссылки
- English
![Таблица 1. Эффективность антибиотиков (in vitro) против бета-лактамазопозитивных и бета-лактамазонегативных штаммов H. influenzae, выделенных в 2004–2005 гг. [5]](/upload/resize_cache/iblock/a67/195_350_1/Alkaloid1.jpg)
![Таблица 2. МПК50, МПК90 и процент чувствительности согласно стандартам CLSI и/или фармакокинетике (ФК)/фармакодинамике (ФД) для H. influenzae (n = 143); 60 продуцирующих бета-лактамазу [6]](/upload/resize_cache/iblock/eba/195_350_1/Alkaloid2.jpg)
![Таблица 3. МПК50, МПК90 и процент чувствительности согласно стандартам CLSI и/или фармакокинетике (ФК)/фармакодинамике (ФД) для M. catarrhalis (n = 62); 59 продуцирующих бета-лактамазу [6]](/upload/resize_cache/iblock/57d/195_350_1/Alkaloid3.jpg)
![Таблица 4. Клинический исход: улучшение или излечение, абс. (%) [8]](/upload/resize_cache/iblock/efd/195_350_1/Alkaloid4.jpg)
![Таблица 5. Частота персистенции H. influenzae в полости среднего уха на фоне лечения различными антибактериальными препаратами [9, 10]](/upload/resize_cache/iblock/af6/195_350_1/Alkaloid6.jpg)
![Рис. 2. Среднее содержание цефиксима в сыворотке крови и воспалительной жидкости после приема внутрь в дозе 400 мг (добавлены МПК90 ряда ключевых патогенных микроорганизмов и стандартные отклонения) [13]](/upload/resize_cache/iblock/713/195_350_1/Alkaloid7.jpg)
![Рис. 3. Частота нежелательных реакций при приеме цефиксима и амоксициллина клавуланата [14]](/upload/resize_cache/iblock/584/195_350_1/Alkaloid8.jpg)
![Таблица 6. Корреляция чувствительности бактерий к цефтриаксону и цефподоксиму [19]](/upload/resize_cache/iblock/078/195_350_1/Alkaloid9.jpg)
![Рис. 4. Концентрация моксифлоксацина в зависимости от времени (пациенты (n = 48) получали моксифлоксацин в дозе 400 мг/сут в течение пяти дней) [23]](/upload/resize_cache/iblock/a84/195_350_1/Alkaloid10.jpg)
![Рис. 5. Скорость эрадикации основных патогенов (исследование SPEED) [24]](/upload/resize_cache/iblock/8d7/195_350_1/Alkaloid11.jpg)
![Рис. 6. Эффективность моксифлоксацина и амоксициллина клавуланата на третий день [25]](/upload/resize_cache/iblock/ed4/195_350_1/Alkaloid12.jpg)
![Рис. 7. Эффективность моксифлоксацина и цефуроксима аксетила [26]](/upload/resize_cache/iblock/c5a/195_350_1/Alkaloid13.jpg)
![Таблица 7. Профиль антибиотиков, назначаемых пациентам в популяции согласно протоколу для лечения текущего эпизода синусита перед включением в исследование [28]](/upload/resize_cache/iblock/d7f/195_350_1/Alkaloid14.jpg)
На протяжении всей истории развития человечество сталкивается с острой респираторной вирусной инфекцией (ОРВИ). Формы ее распространения различны: единичные случаи, сезонный подъем заболеваемости, эпидемии и даже пандемии.
Пандемия SARS-CoV-2, которая официально считается завершенной, внесла существенные изменения в сознание людей, подходы к терапии вирусной инфекции, течение ОРВИ, микробный пейзаж слизистых оболочек, повлияла на рост антибиотикорезистентности. Одни изменения (явные) изучаются специалистами, другие еще предстоит осознать.
Задача врача двояка: с одной стороны – борьба с вирусным воспалением, с другой – своевременная эффективная терапия бактериальных осложнений. Развитие медицины и фармакологии привело к резкому снижению летальности при ОРВИ и гриппе, однако уровень заболеваемости остается высоким и не демонстрирует тенденции к снижению. Это обусловлено множеством факторов, в том числе нерациональным лечением.
Устойчивость бактерий к антимикробным препаратам и их персистенция относятся к важным факторам роста заболеваемости и смертности, поскольку связаны с повышенным риском неэффективности лечения и рецидивов инфекций и приводят к росту расходов на здравоохранение. Бактериальная резистентность легко определяется с помощью стандартных микробиологических анализов, поэтому угроза очевидна [1].
Как правило, при респираторных инфекциях именно вирусы запускают каскад патологических изменений, приводящих к развитию бактериальных воспалительных процессов в верхних и нижних дыхательных путях. Крайне важна дифференциальная диагностика вирусного и бактериального процесса. Конечно, первостепенное значение имеют правильная оценка клинической картины врачом, анализ состояния организма в целом и лор-органов. В помощь клиницистам – экспресс-методы диагностики этиологии воспаления, например гриппа A и B, SARS-CoV-2, стрептатест для экспресс-определения бета-гемолитического стрептококка группы А.
ОРВИ – банальная инфекция, но развитие осложнений, прежде всего бактериальных, нередко ухудшает течение заболевания и затягивает выздоровление пациента. По данным литературы, самое частое осложнение ОРВИ – острый риносинусит, который обычно носит вирусный характер, но иногда имеет бактериальную этиологию [2].
Согласно результатам многочисленных современных исследований, основными возбудителями острого бактериального риносинусита являются Streptococcus pneumoniae, Haemophilus influenzae и Moraxella catarrhalis, выявляемые у взрослых пациентов в 20–43, 22–35 и 2–10% случаев соответственно [3, 4].
Постоянно проводится мониторинг чувствительности основных патогенов к разным группам антибактериальных препаратов. По данным D.J. Biedenbach и соавт., чувствительность пневмококка, выделенного у пациентов с респираторными инфекциями верхних дыхательных путей, к амоксициллина клавуланату и цефуроксиму в России составляет 83,8/- и 67,6/65,6% по критериям CLSI/EUCAST соответственно (табл. 1) [2].
В исследовании W.T. Jansen и соавт. из 578 протестированных штаммов цефиксим (МПК90 (минимальная подавляющая концентрация) 0,06 мг/л) был одним из препаратов с наибольшей активностью против бета-лактамазопродуцирующих и бета-лактамазонегативных амоксициллин-резистентных изолятов. К цефиксиму оказались чувствительны 578 штаммов. По сравнению с другими цефалоспоринами цефиксим в 32 раза активнее цефуроксима и в 128 раз активнее цефаклора. Согласно рекомендациям CLSI (международные стандарты эффективности тестирования чувствительности к противомикробным препаратам), бета-лактамазонегативные амоксициллин-резистентные штаммы гемофильной палочки следует считать устойчивыми к амоксициллина клавуланату, цефаклору и цефуроксиму, несмотря на описанную выше некоторую восприимчивость in vitro [6].
Следует отметить, что цефиксим эффективен против всех штаммов гемофильной палочки независимо от продукции бета-лактамаз и наличия чувствительности к амоксициллину (табл. 2) [5, 6].
Чувствительность гемофильной палочки к амоксициллину, амоксициллина клавуланату, азитромицину, цефиксиму и цефуроксиму, по данным C.J. Harrison и соавт., достигает 55,2, 91,6, 0, 100 и 88,1% соответственно [6].
Чувствительность моракселлы к амоксициллину, амоксициллина клавуланату, азитромицину, цефиксиму и цефуроксиму составляет 4,8, 88,7, 98,4, 100 и 37,1% соответственно (табл. 3) [6].
С начала пандемии системные антибиотики вошли в тройку самых быстрорастущих в аспекте продаж групп препаратов, имеющих отношение к лечению коронавирусной инфекции: «противомикробные препараты для системного использования» (+39,9%) (основание – данные розничного аудита фармацевтического рынка РФ DSM Group, система менеджмента качества соответствует требованиям ISO 9001:2015).
Самый большой прирост по продажам показали макролиды. К сожалению, чаще всего не было показаний для их применения. Не стоит забывать, что макролиды могут не только приводить к росту перекрестной резистентности пневмококка к препаратам своего класса, но и потенцировать рост его устойчивости к аминопенициллинам [7].
Стартовая терапия представлена бета-лактамными антибиотиками. Аминопенициллины и цефалоспорины являются лидерами в терапии воспалительной патологии респираторного тракта. В немецком исследовании применение цефиксима у детей и взрослых с инфекциями верхних и нижних дыхательных путей характеризовалось высокой клинической эффективностью, близкой к 100% (табл. 4) [8].
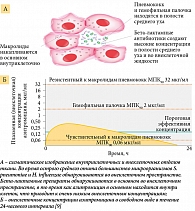
Кроме того, к частым осложнениям ОРВИ относятся острые средние отиты, которые в большинстве случаев лечатся местными препаратами. В тех ситуациях, когда необходима системная терапия, бета-лактамные антибиотики, включая цефиксим, в отличие от макролидов создают в полости среднего уха высокие концентрации, достаточные для эрадикации основных респираторных патогенов. Концентрация макролидов в полости среднего уха недостаточна для эрадикации гемофильной палочки и резистентного пневмококка (рис. 1) [9].
Благоприятный клинический исход независимо от бактериологического эффекта препарата может привести к ложному оптимизму при использовании менее эффективных антибиотиков. Только эрадикация патогена гарантирует полное излечение и профилактику рецидивирования процесса. Микробиологическая эффективность цефиксима в исследовании, посвященном лечению острого среднего отита, ассоциированного с гемофильной палочкой, в отличие от других антибиотиков составила 100% (табл. 5) [9, 10].
Острый тонзиллофарингит может быть одним из симптомов ОРВИ или протекать как самостоятельное заболевание. Воспаление, вызванное бета-гемолитическим стрептококком группы А, необходимо купировать системными антибиотиками. Очень важно провести дифференциальную диагностику для определения этиологии заболевания. В метаанализе J.R. Casey и M.E. Pichichero эффективность цефиксима и пероральных пенициллинов при лечении стрептококкового тонзиллита у детей в течение десяти дней составила: микробиологическая – 93,8 и 76,6%, клиническая – 97,9 и 83,0% соответственно [11]. По данным H.D. Davies и соавт., клиническая эффективность цефиксима по сравнению с амоксициллина клавуланатом в ряде медицинских центров США при стрептококковом тонзиллите у взрослых составила 94% [12].
Необходимо помнить об одном из важнейших фармакокинетических свойств цефиксима – способности создавать высокие концентрации в очагах инфекции и сохранять их на достаточном уровне в течение суток даже после однократного приема дозы 400 мг (рис. 2) [13].
На фоне приема системных антибиотиков возможны нежелательные реакции. Самые частые побочные явления встречаются при использовании клавулановой кислоты. Частота нежелательных реакций (диарея, жидкий стул, рвота) при приеме цефиксима в 2–4 раза ниже, чем при использовании амоксициллина клавуланата (рис. 3) [14].
Международная научно-практическая конференция (1st Cefixime Alkaloid Global Meeting), состоявшаяся 14–16 марта 2024 г. в Стамбуле (Турция), была посвящена вопросам применения антибиотиков при респираторных и урогенитальных инфекциях в разных странах, развития антибиотикорезистентности, стандартам и алгоритмам лечения респираторных и урологических инфекций, изменению чувствительности к антибиотикам после новой коронавирусной инфекции COVID-19, роли рациональной антибиотикотерапии в профилактике антибиотикорезистентности. Особое внимание было уделено международному опыту применения препарата цефиксим (в России представлен под торговым названием Панцеф®) производства компании Alkaloid в различных терапевтических областях. Мировые фармацевтические и медицинские эксперты, присутствовавшие на мероприятии, твердо убеждены в том, что многолетнее и успешное профессиональное и научное сотрудничество с компанией, часто охватывающее десятилетия, в первую очередь обусловлено качеством ее продукции.
На конференции прозвучали доклады ведущих экспертов медицинского сообщества в области клинической микробиологии, антимикробной химиотерапии, пульмонологии, оториноларингологии, терапии и урологии из 12 стран, включая Российскую Федерацию [15].
Появление на российском фармацевтическом рынке перорального цефалоспорина третьего поколения – цефподоксима проксетила, высокоактивного против возбудителей инфекций дыхательных путей, представленного в РФ под торговым наименованием Доксеф, открывает клиницистам дополнительные возможности эффективной антибиотикотерапии респираторных инфекций.
В рекомендациях, разработанных в рамках Стэнфордской программы антимикробной безопасности и устойчивого развития (Stanford Antimicrobial Safety & Sustainability Program, 2021, США), предпочтительные режимы терапии острого синусита у взрослых амбулаторных пациентов предусматривают использование амоксициллина клавуланата, цефподоксима или цефуроксима аксетила [16].
Результаты исследования, проведенного в 2023 г. на базе НИИ антимикробной химиотерапии ФГБОУ ВО «Смоленский государственный медицинский университет» Минздрава России, включавшего определение чувствительности 558 изолятов бактерий, в том числе 184 штаммов гемофильной палочки, 186 штаммов пневмококков и 188 штаммов S. pyogenes, выделенных от пациентов с инфекциями дыхательных путей в различных регионах Российской Федерации, свидетельствуют о высокой активности in vitro цефподоксима в отношении указанных возбудителей [17]. К цефподоксиму оказались чувствительны все протестированные изоляты гемофильной палочки. В отношении данного возбудителя активность цефподоксима превосходила in vitro таковую других пероральных антибактериальных препаратов (амоксициллин, амоксициллина клавуланат, цефтибутен, тетрациклин, ко-тримоксазол, макролиды), кроме респираторных фторхинолонов – левофлоксацина и моксифлоксацина. Среди исследованных изолятов S. pneumoniae 81,7% были чувствительны к цефподоксиму. По активности против пневмококков цефподоксим несколько уступал респираторным фторхинолонам (левофлоксацину, моксифлоксацину), линезолиду, цефтаролину, хлорамфениколу, но был эквивалентен по микробиологической чувствительности амоксициллину (81,7 против 83,9%) и цефтриаксону (81,7 против 82,9%). In vitro активность цефподоксима в отношении исследованных изолятов S. pyogenes, исходя из значений МПК50/90 и диапазона значений МПК, составила 100%. Примечательно, что полученные данные свидетельствуют о том, что активность цефподоксима в отношении S. pneumoniae и S. pyogenes сравнима с активностью амоксициллина и соответственно амоксициллина клавуланата. В то же время в отношении H. influenzae цефподоксим превосходил их активность in vitro [17].
Немаловажно также и то, что в отношении протестированных респираторных патогенов пероральный цефалоспорин третьего поколения цефподоксим не уступал по активности in vitro классическим парентеральным представителям данной группы – цефотаксиму и цефтриаксону. Это делает его оптимальной опцией при проведении ступенчатой терапии цефалоспоринами третьего поколения в стационаре, а также предоставляет возможность замены парентеральной терапии (в частности, цефтриаксоном), неоправданно широко используемой в амбулаторной отечественной практике и несущей в себе значительные неудобства и риски использования вне стационара, на пероральную цефподоксимом без угрозы потери эффективности [18].
Данное положение также подтверждается результатами исследования по прогнозированию чувствительности бактерий к цефподоксиму с использованием результата определения МПК цефтриаксона. В исследовании оценивали соответствие интерпретации результатов определения чувствительности к цефподоксиму и цефтриаксону для 3700 штаммов Streptococcus spp., H. influenzae, M. catarrhalis, метициллин-чувствительных стафилококков и Neisseria gonorrhoeae. На основании результатов исследования был сделан вывод, что МПК цефтриаксона позволяет достаточно точно прогнозировать чувствительность (или резистентность) микроорганизмов к цефподоксиму с приемлемой частотой серьезных ошибок в интерпретации результатов (1,5%) и абсолютным соответствием в аспекте чувствительности > 92% (табл. 6) [19].
В проспективном многоцентровом рандомизированном открытом исследовании подтверждена сравнимая клиническая эффективность пятидневного курсового лечения цефподоксимом и восьмидневного курса терапии амоксициллина клавуланатом у 512 взрослых пациентов с острым бактериальным риносинуситом. Показатели клинической эффективности составили 92,3 (215/233) и 93,6% (204/218) соответственно. Приверженность пациентов лечению оказалась значительно выше в группе цефподоксима по сравнению с группой амоксициллина клавуланата (99,2 против 95,5%; р = 0,011). Цефподоксим также отличался значительно лучшей переносимостью. Только 1,2% (3/247) пациентов, получавших данный препарат, сообщили о нежелательных лекарственных реакциях (НЛР). В то же время в группе амоксициллина клавуланата НЛР отмечались в 10,7% случаев [20].
В масштабном проспективном многоцентровом обсервационном исследовании оценивали эффективность и безопасность терапии цефподоксимом в дозе 200 мг/сут в течение 5–10 дней (продолжительность курсового лечения определялась лечащим врачом) у 1425 взрослых пациентов с острым максиллярным синуситом или острым тонзиллофарингитом. Средняя продолжительность курса лечения составила 5,87 ± 1,73 дня. В целом клиническое выздоровление наблюдалось у 83,3% больных, еще у 16,2% пациентов отмечалось клиническое улучшение. Эффективность терапии у пациентов с острым тонзиллофарингитом была достоверно выше, чем у больных острым синуситом (86,3 против 77,4%; p < 0,001). НЛР зарегистрированы у 0,8% пациентов. Все НЛР были легкими или умеренными по тяжести и разрешились по окончании лечения [21].
В другом многоцентровом международном проспективном двойном слепом плацебо-контролируемом исследовании с участием взрослых амбулаторных пациентов с острым синуситом эффективность и переносимость цефподоксима проксетила сравнивали с эффективностью и переносимостью цефаклора. В конце лечения цефподоксим проксетил был более эффективен, чем цефаклор, и обеспечил полное клиническое излечение в 84% случаев (102/122). В группе цефаклора этот показатель составил 68% (77/114) (p = 0,01) [22].
В ситуациях, когда стартовая терапия неэффективна, используются антибиотики резерва – респираторные фторхинолоны. К сожалению, широкое применение левофлоксацина при пандемии коронавируса, не всегда оправданное, привело к снижению его эффективности и необходимости увеличения дозы.
Основными принципами антибиотикотерапии в сложных клинических случаях являются назначение препарата с высокой активностью антибиотика in vitro в отношении основных возбудителей острого риносинусита, отсутствие клинически значимой антибиотикорезистентности, подтвержденные эффективность и безопасность препарата. К таким препаратам относится моксифлоксацин, который быстро создает высокие концентрации в тканях придаточных пазух (рис. 4) [23].
В проспективном открытом многоцентровом исследовании SPEED продемонстрирована высокая скорость эрадикации основных респираторных патогенов (S. pneumoniae, H. influenzae и M. catarrhalis) на фоне применения моксифлоксацина взрослыми пациентами с подтвержденным острым бактериальным риносинуситом (ОБРС). Моксифлоксацин в дозе 400 мг один раз в сутки в течение десяти дней приводил к эрадикации исходных бактерий у 83,3% пациентов на второй день, у 100% – на третий день и у 97,6% – на четвертый день. Клинический успех на контрольном визите отмечался у 94,7% пациентов (рис. 5) [24].
В проспективном рандомизированном многоцентровом исследовании среди 475 пациентов, проходивших десятидневный курс терапии по поводу ОБРС, установлена эквивалентность терапии моксифлоксацином и амоксициллина клавуланатом при более быстром исчезновении симптомов и восстановлении нормальной активности (рис. 6) [25].
В проспективном рандомизированном двойном слепом многоцентровом исследовании сравнивали эффективность и безопасность моксифлоксацина и цефуроксима у пациентов с ОБРС. Продемонстрирована более высокая эффективность моксифлоксацина: микробиологическая – 94,5 против 83,5%, клиническая – 96,7 против 90,7% (рис. 7) [26].
Моксифлоксацин обеспечивает высокую клиническую и микробиологическую эффективность в сложных клинических случаях. Микробиологическая эффективность моксифлоксацина у пациентов с неэффективной стартовой терапией ОБРС, а также у пациентов с неэффективной стартовой терапией и факторами риска составила 97,2 и 95,2% соответственно. Большинство пациентов с неэффективной стартовой терапией исходно принимали амоксициллин (21,4%) и амоксициллина клавуланат (25,1%) (табл. 7) [27].
Применение моксифлоксацина у пациентов с ОБРС по сравнению с использованием левофлоксацина сопровождалось более короткой продолжительностью терапии – 10,4 ± 4,7 дня на моксифлоксацине против 12,4 ± 5,4 на левофлоксацине, или на 16,1% меньше; более низкой вероятностью клинической неудачи терапии – 10,0 против 13,9%, а также на 30–35% меньшим риском рецидива заболевания. Группу моксифлоксацина представляли 3358 пациентов, группу левофлоксацина – 1522 пациента. Все назначения были первичны, без предшествующей антибиотикотерапии другими препаратами [28].
Клиническое применение пероральных цефалоспоринов третьего поколения (в частности, цефиксима, цефподоксима) при инфекциях верхних дыхательных путей определяется прежде всего спектром их высокой антимикробной активности против основных респираторных патогенов. Положительный клинический опыт применения, описанный в многочисленных международных исследованиях, обосновывает место антимикробных препаратов в терапии указанных инфекций как клинически и микробиологически эффективных и хорошо переносимых в легких и среднетяжелых клинических ситуациях. В то же время моксифлоксацин с учетом профиля его безопасности и широкого спектра действия представляется разумным терапевтическим вариантом в сложных клинических случаях.
Таким образом, широкий арсенал антимикробных препаратов позволяет специалистам осуществлять грамотный пациент-ориентированный подход к терапии инфекций верхних дыхательных путей в различных клинических ситуациях.
A.Yu. Ovchinnikov, PhD, Prof., N.A. Miroshnichenko, PhD, Prof., Yu.O. Nikolaeva, PhD
Russian University of Medicine
Contact person: Yuliya O. Nikolaeva, yu.o.nikolaeva@gmail.com
Complications due to acute respiratory viral infections are not uncommon. Frequent complications, such as bacterial (rhinosinusitis, otitis media), require the doctor to adequately prescribe medications for both therapy and prevention. The main principles of antibiotic therapy in complex clinical cases are as follows: the appointment of an in vitro antibiotic, highly active against the main pathogens, the absence of clinically significant antibiotic resistance, confirmed efficacy and safety of the drug. The clinical use of third-generation oral cephalosporins (in particular, cefixime, cefpodoxime) is determined by the spectrum of their antimicrobial activity against major respiratory pathogens, as well as positive clinical experience described in numerous international studies defining them as clinically and microbiologically effective, well-tolerated antimicrobials in mild and moderate clinical situations. At the same time, moxifloxacin, taking into account its safety profile and wide spectrum of action, seems to be a reasonable therapeutic option in complex clinical cases. Thus, a wide arsenal of antimicrobial drugs allows specialists to implement a competent patient-oriented approach to the treatment of upper respiratory tract infections in various clinical situations.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.