Дискуссионные вопросы терапии урогенитальных инфекций. XV Всероссийский съезд дерматовенерологов и косметологов. Сателлитный симпозиум компании «Астеллас»
- Аннотация
- Статья
- Ссылки



Современные представления о резистентности возбудителей урогенитальных инфекций к антимикробным препаратам
В начале выступления Маргарита Рафиковна РАХМАТУЛИНА, д.м.н., заместитель директора по научно-клинической работе Го-сударственного научного центра дерматовенерологии и косметологии, напомнила аудитории, что резистентность микроорганизмов – это полная или частичная их невосприимчивость к антибактериальным препаратам.
По данным Европейского центра по профилактике и контролю заболеваемости, дополнительный ущерб вследствие антибиотикорезистентности составляет около 1,5 млрд евро в год, а в странах Европейского союза, Норвегии и Исландии ежегодно около 25 тыс. человек умирает от инфекций, вызванных антибиотикорезистентными бактериями.
Наиболее актуальна данная проблема в отношении возбудителя гонококковой инфекции – Neisseria gonorrhoeae. Появление и распространение резистентных штаммов микроорганизмов не позволяют добиться их эрадикации и способствуют длительному течению заболевания и развитию его осложненных форм.
Согласно рекомендациям Все-мирной организации здравоохранения при назначении антибактериальных препаратов следует учитывать региональную картину резистентности. Препараты, предназначенные для терапии гонококковой инфекции, должны быть активны в отношении как минимум 95% штаммов, выделяемых в регионе заражения. В группах с высоким риском распространения гонококковой инфекции эффективность антибактериальной терапии должна приближаться к 100%1. Именно поэтому во многих странах существуют свои национальные (региональные) программы по мониторингу резистентности N. gonorrhoeae. В России таковой является RU-GASP (Russian Gonococcal Antimicrobial Susceptibility Programme). RU-GASP реализуется с 2002 г. Государственным научным центром дерматовенерологии и косметологии.
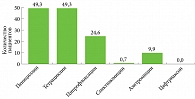
Согласно полученным данным, в последние годы в России наблюдается повышение устойчивости микроорганизма к пенициллинам, тетрациклинам, фторхинолонам, азитромицину, в меньшей степени – к спектиномицину. Среди выделенных не выявлено штаммов N. gonorrhoeae, нечувствительных к препаратам группы цефалоспоринов: цефтриаксону и цефиксиму. Уровень чувствительности как в целом по России, так и в отдельных федеральных округах составил 100% (рис. 1)2.
Таким образом, препаратами выбора для лечения гонококковой инфекции нижних отделов мочеполового тракта, гонококкового фарингита и гонококковой инфекции аноректальной области являются цефтриаксон в дозе 500 мг внутримышечно однократно или цефиксим в дозе 400 мг перорально однократно, альтернативным препаратом – спектиномицин в дозе 2 г внутримышечно однократно.
Лечение осложненных форм гонококковой инфекции осуществляется цефтриаксоном в дозе 1 г внутримышечно или внутривенно каждые 24 часа в течение 14 дней, или цефотаксимом в дозе 1 г внутривенно каждые 8 часов в течение 14 дней, или спектиномицином в дозе 2 г внутримышечно каждые 12 часов. Через 24–48 часов после начала парентеральной антибактериальной терапии при условии исчезновения клинических симптомов возможно ее продолжение цефиксимом в дозе 400 мг два раза в сутки перорально. Общая продолжительность лечения – 14 дней3.
Одним из наиболее распространенных заболеваний мочеполового тракта является урогенитальный трихомониаз, возбудитель – трихомонады. Для его лечения используют препараты группы нитроимидазолов. На сегодняшний день в России зарегистрирован ряд препаратов этой группы: орнидазол, метронидазол, тинидазол, секнидазол, ниморазол и др. В клинической практике наиболее широко применяются первые три.
Однако как многие бактерии в результате адаптационных реакций стали вырабатывать пенициллиназу, что сделало их нечувствительными к пенициллинам, так и некоторые штаммы урогенитальных трихомонад в последнее десятилетие стали менее чувствительными к метронидазолу. Несмотря на возможную кросс-резистентность к нитроимидазолам и известную трихомонацидную эффективность, например, фуразолидона, нитрофуранов или паромомицина, решить проблему резистентности к метронидазолу можно путем назначения других препаратов этой группы4.
Для лечения неосложненных форм заболевания рекомендуется применять внутрь метронидазол в дозе 500 мг два раза в сутки в течение семи дней, или орнидазол в дозе 500 мг два раза в сутки в течение пяти дней, или тинидазол в дозе 500 мг два раза в сутки в течение пяти дней. Лечение осложненного рецидивирующего урогенитального трихомониаза и трихомониаза других локализаций осуществляется метронидазолом в дозе 500 мг три раза в сутки в течение семи дней или в дозе 2 г один раз в сутки в течение пяти дней, или орнидазолом в дозе 500 мг два раза в сутки в течение десяти дней.
Урогенитальный хламидиоз также широко распространенная инфекция, которая передается половым путем. Повышению выявляемости заболевания в различных странах мира во многом способствовало внедрение скрининга урогенитальной хламидийной инфекции и использование чувствительных методов диагностики, таких как амплификация нуклеиновых кислот. Современные схемы лечения предполагают применение одного из антибактериальных препаратов следующих фармакологических групп: тетрациклинов (доксициклина), макролидов (азитромицина, джозамицина) или фторхинолонов (офлоксацина, левофлоксацина, моксифлоксацина и др.). В настоящее время существует ряд методик определения чувствительности хламидий к антибиотикам. Они различаются по виду используемых культур клеток, срокам инфицирования культуры клеток и внесения антибиотиков в питательную среду, процедурам оценки жизнеспособности хламидий после воздействия на них антимикробных препаратов. Так, в условиях in vitro зарегистрирована резистентность Chlamydia trachomatis к рифампицину и фторхинолонам. Резистентность к последним может быть обусловлена заменой отдельных нуклеотидов в генах gyrA и parC. Макролидные и тетрациклиновые антибиотики обладают высокой активностью против хламидий как в условиях in vitro, так и в условиях in vivo, и истинная резистентность к этим группам препаратов у патогенных для человека хламидий практически не встречается5, 6.
При лечении неосложненных форм хламидийной инфекции препаратами выбора считаются доксициклина моногидрат в дозе 100 мг два раза в сутки в течение семи дней, джозамицин в дозе 500 мг три раза в сутки в течение семи дней и азитромицин в дозе 1 г однократно. В качестве альтернативы применяется офлоксацин в дозе 400 мг два раза в сутки в течение семи дней.
Лечение хламидийной инфекции верхних отделов мочеполовой системы, органов малого таза проводится доксициклина моногидратом или джозамицином в вышеупомянутых дозах. Длительность курса терапии зависит от степени клинических проявлений воспалительного процесса, результатов лабораторных и инструментальных исследований. Она варьирует от 14 до 21 дня.
Рациональные подходы к терапии репродуктивно значимых инфекций
Заведующий кафедрой дерматовенерологии с клиникой Первого Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова, д.м.н., профессор Евгений Владиславович СОКОЛОВСКИЙ рассказал о современных подходах к диагностике и терапии репродуктивно значимых инфекций.
Согласно клиническим рекомендациям по ведению пациентов с инфекциями, передаваемыми половым путем (ИППП), и урогенитальными инфекциями, разработанным Российским обществом дерматовенерологов и косметологов (2012), для диагностики хламидиоза предназначены молекулярно-биологические методы исследования, позволяющие обнаружить специфические фрагменты ДНК и/или РНК C. trachomatis (методы амплификации нуклеиновых кислот на основе полимеразной цепной реакции (ПЦР), а также культуральные методы).
Докладчик подчеркнул, что другие методы лабораторных исследований, такие как прямая иммунофлюоресценция (ПИФ), иммуноферментный анализ (ИФА), микроскопический и морфологический методы, нельзя использовать для диагностики хламидийной инфекции.
С позиций доказательной медицины применение биологических, химических и алиментарных провокаций с целью повышения эффективности диагностики хламидийной инфекции также нецелесообразно7.
Показанием к лечению является идентификация C. trachomatis у пациента либо его полового партнера. Одновременное лечение половых партнеров является обязательным.
После окончания лечения проводятся повторные исследования: через 14 дней – на основании культурального метода исследования и методов амплификации РНК (NASBA – Nucleic Acids Sequence-Based Amplification) и не ранее чем через месяц – на основании методов амплификации ДНК (ПЦР, ПЦР-RТ).
Выбор фармакотерапии проводят с учетом анамнестических данных пациента (аллергические реакции, индивидуальная непереносимость препаратов, наличие сопутствующих инфекций).
Хламидийная инфекция у беременных повышает угрозу невынашивания, самопроизвольного выкидыша, неразвивающейся беременности, мертворождения, преждевременных родов, несвоевременного излития околоплодных вод, осложнений в родах и послеродовом периоде, а также заражения плода при прохождении через родовые пути. Именно поэтому лечение антибактериальными препаратами таких больных осуществляется на любом сроке беременности.
Терапия хламидийной инфекции у детей с массой тела более 45 кг проводится по тем же схемам, что и у взрослых пациентов. При этом учитываются имеющиеся противопоказания.
Дополнительная терапия (системная энзимотерапия, иммуномодулирующая терапия, местные антисептические препараты) пациентам с хламидийной инфекцией не показана.
Может быть применена одна из следующих схем лечения хламидийной инфекции нижнего отдела мочеполовой системы (нозологическая группа А 56.0), аноректальной области (А 56.3), хламидийного фарингита (А 56.4), хламидийного конъюнктивита (А 74.0):
1) препарат выбора:
-
доксициклина моногидрат 100 мг внутрь два раза в сутки в течение семи дней;
-
джозамицин 500 мг внутрь три раза в сутки в течение семи дней;
-
азитромицин 1 г внутрь однократно;
2) альтернативный препарат – офлоксацин 400 мг внутрь два раза в сутки в течение семи дней.
Схема лечения хламидийной инфекции верхних отделов мочеполовой системы, органов малого таза и других органов (А 56.1 и 56.8):
1) препарат выбора:
-
доксициклина моногидрат 100 мг внутрь два раза в сутки в течение 14–21 дня;
-
джозамицин 500 мг внутрь три раза в сутки в течение 14–21 дня;
2) альтернативный препарат – офлоксацин 400 мг внутрь два раза в сутки в течение 14–21 дня.
Длительность курса терапии зависит от степени клинических проявлений воспалительных процессов в мочеполовых органах, результатов лабораторных и инструментальных исследований – варьирует от 14 до 21 дня.
Согласно российским и европейским рекомендациям джозамицин (Вильпрафен®) обладает высоким уровнем безопасности и может применяться в период беременности и лактации8.
Для лечения беременных препарат принимают в дозе 500 мг три раза в сутки перорально в течение семи дней.
Для лечения хламидиоза у детей с массой тела менее 45 кг джозамицин используют в расчете 50 мг/кг массы тела в три приема в течение семи дней.
Доказано, что джозамицин не влияет на моторику и микрофлору кишечника. Риск лекарственных взаимодействий у этого препарата минимален9.
Российскими учеными был проведен метаанализ, результаты которого продемонстрировали, что при хламидийном уретрите у мужчин доксициклин (0,1 г два раза в сутки в течение семи дней) достоверно превосходит азитромицин (1 г однократно) по микробиологической эффективности (отношение шансов 0,15 при 95%-ном доверительном интервале 0,04–0,69, р = 0,009)10.
Установлено, что чувствительность C. trachomatis к антибиотикам при нормоксии и гипоксии различна. В условиях воспаления и гипоксии активность азитромицина снижается, а активность доксициклина повышается11.
Далее профессор Е.В. Соколовский перечислил наиболее вероятные причины неэффективности коротких курсов антибактериальной терапии. Гетеротипичная резистентность наблюдается при высокой бактериальной нагрузке (уретрит, цервицит) и наличии в микробной популяции персистеров и/или мутантов 23S рРНК12, 13. Причинами неэффективности коротких курсов антибактериальной терапии могут стать эффект недостаточной дозы бактериостатика и гомотипичная (мутация) резистентность. Определение ДНК/РНК-высокочувствительными методами амплификации нуклеиновых кислот в сроки пять и менее недель может сопровождаться ложноположительным ответом14.
Согласно результатам современных исследований, у пациентов с воспалительными заболеваниями урогенитальной системы также выявляют генитальные микоплазмы – Mycoplasma genitalium, Ureaplasma urealyticum, Mycoplasma hominis.
M. genitalium – возбудитель ИППП, патогенный микроорганизм, способный вызывать уретрит у лиц обоего пола и цервицит у женщин.
На сегодняшний день не подтверждена и не опровергнута связь между инфицированием M. genitalium и неблагоприятными исходами беременности (спонтанный аборт, преждевременные роды, замедление внутриутробного роста, мертворождение).
Согласно отечественным рекомендациям верификация диагноза заболеваний, вызванных M. genitalium, осуществляется с помощью молекулярно-биологических методов, направленных на обнаружение специфических фрагментов ДНК и/или РНК M. genitalium, с использованием тест-систем, разрешенных к медицинскому применению в Российской Федерации.
По мнению специалистов, другие методы лабораторных исследований, в том числе ПИФ, ИФА, культуральный метод, для диагностики использовать недопустимо.
Для оценки степени лейкоцитарной реакции и состояния микробиоценоза уретры, влагалища, цервикального канала необходимо провести микроскопическое исследование клинического материала.
С позиций доказательной медицины применение биологических, химических и алиментарных провокаций с целью повышения эффективности диагностики заболеваний, вызванных M. genitalium, нецелесообразно7.
Показаниями к обследованию на M. genitalium являются:
-
клинические и/или лабораторные признаки воспалительного процесса органов урогенитального тракта;
-
предгравидарное обследование половых партнеров;
-
беременность;
-
предстоящие оперативные (инвазивные) манипуляции на органах малого таза;
-
перинатальные потери и бесплодие в анамнезе;
-
половой контакт с инфицированным партнером в период до 60 дней;
-
сексуальное насилие в период до 60 дней.
Показанием к проведению лечения считается идентификация M. genitalium с помощью молекулярно-биологических методов у пациента либо его полового партнера. Одновременное лечение половых партнеров обязательно.
На данный момент ключевой проблемой, связанной с лечением больных микоплазменными инфекциями, является резистентность к антибактериальным препаратам.
С 2006 г. международные руководства рекомендуют лечение заболеваний урогенитального тракта, вызванных M. genitalium, азитромицином в дозе 1 г однократно. Однако результаты исследований свидетельствуют о снижении бактериальной чувствительности к макролидам. Доказано, что лечение азитромицином 1 г однократно может приводить к селекции штаммов M. genitalium, несущих мутации устойчивости к макролидам. Для M. genitalium данный режим лечения ассоциируется с потенциальным риском формирования устойчивости к макролидам15.
Результаты последних исследований показали, что в отсутствие резистентности к макролидам назначение пятидневного курса азитромицина эффективно и не индуцирует резистентность.
Таким образом, азитромицин в дозе 1 г не должен использоваться для лечения пациентов с симптомами уретрита, потенциально вызванного M. genitalium16.
Следует отметить, что согласно инструкции, одобренной в нашей стране, азитромицин вообще не должен применяться при лечении негонококковых уретритов, ассоциированных с генитальными микоплазмами. Единственное показание для его применения – хламидийная инфекция.
На сегодняшний день джозамицин – препарат выбора для антибактериальной терапии урогенитальных инфекций смешанной этиологии. Это единственный макролид для лечения урогенитальных инфекций с универсальной активностью in vitro как в отношении C. trachomatis, так и в отношении всех клинически значимых микоплазм17, 18.
Препаратами выбора для лечения инфекций, вызванных M. genitalium, являются доксициклина моногидрат 100 мг два раза в сутки в течение десяти дней или джозамицин 500 мг три раза в сутки перорально в течение десяти дней.
Альтернативный препарат – офлоксацин 400 мг внутрь два раза в сутки в течение десяти дней.
Беременным назначают только джозамицин в аналогичной дозе и режиме, детям с массой тела менее 45 кг – 50 мг/кг массы тела в три приема в течение десяти дней.
Mycoplasma hominis и Ureaplasma spp. – условно патогенные микроорганизмы, реализация патогенных свойств которых происходит при определенных условиях (высокий уровень бактериальной обсемененности, иммуносупрессия и т.д.).
Уреаплазмы способны вызывать уретрит у мужчин (U. urealyticum), цервицит, цистит, воспалительные заболевания органов малого таза, а также осложнять течение беременности, способствовать развитию послеродовых и послеабортных осложнений.
Показанием к обследованию на Ureaplasma spp. и M. hominis считается наличие клинико-лабораторных признаков воспалительного процесса в области урогенитального тракта при отсутствии патогенных возбудителей ИППП.
Если клинические проявления отсутствуют, обследованию подлежат пациенты с диагнозом «бесплодие», имеющие в анамнезе невынашивание беременности и перинатальные потери, доноры спермы.
Верификация диагноза базируется на результатах лабораторных исследований. Проводится микроскопическое исследование клинического материала из уретры, влагалища и цервикального канала для оценки состояния их эпителия, степени лейкоцитарной реакции, исключения сопутствующих ИППП (гонококковой инфекции, урогенитального трихомониаза), состояния микробиоценоза влагалища. Кроме того, используются культуральные и/или молекулярно-биологические методы. Целесообразность применения методики количественного определения (определение титра), как и клиническое значение полученных результатов, не доказана.
Докладчик отметил, что, учитывая высокую распространенность микоплазм в нижних отделах мочеполовой системы у практически здоровых лиц репродуктивного возраста, а также их этиологическое значение, проведение скринингового обследования на генитальные микоплазмы неоправданно.
Показанием к лечению при выявлении M. hominis и Ureaplasma spp. является наличие клинико-лабораторных признаков инфекционно-воспалительного процесса, при котором не выявлены другие возбудители ИППП, в том числе C. trachomatis, N. gonorrhoeae, Trichomonas vaginalis. Половые партнеры лиц, инфицированных M. hominis и/или Ureaplasma spp., подлежат лечению при наличии у них клинической симптоматики и лабораторных признаков воспалительного процесса мочеполовых органов при исключении иной этиологии данного процесса.
По данным российских и зарубежных исследований, M. hominis, U. urealyticum, Ureaplasma spp. сохраняли высокую чувствительность к джозамицину и доксициклина моногидрату19, 20.
Заболевания, вызываемые M. hominis и/или Ureaplasma spp., лечат по одной из следующих схем:
-
доксициклина моногидрат по 100 мг внутрь два раза в сутки в течение десяти дней;
-
джозамицин по 500 мг внутрь три раза в сутки в течение десяти дней.
Беременным джозамицин назначают в дозе 500 мг внутрь три раза в сутки в течение десяти дней, детям с массой тела менее 45 кг – исходя из 50 мг/кг массы тела в три приема в сутки.
Актуальные вопросы терапии вульвовагинального кандидоза
Особенностям течения, диагностики и современным методам лечения вульвовагинального кандидоза (ВВК) посвятила свое выступление заведующая кафедрой дерматовенерологии факультета повышения квалификации и профессиональной переподготовки специалистов Иркутского государственного медицинского университета (ФПК и ППС ИГМУ), д.м.н., профессор Ирина Олеговна МАЛОВА. Она отметила, что лечение ВВК по-прежнему остается одной из актуальных проблем современной медицины. Доля ВВК в структуре инфекционной патологии нижнего отдела урогенитального тракта составляет 40–50%. Особенностями ВВК являются частые рецидивы воспалительного процесса, возможность распространения последнего на другие органы и системы, риск развития гематогенной диссеминации аутоиммунного процесса.
В последние годы чаще регистрируется развитие уретритов и уретроциститов, а также восходящая кандидозная инфекция с симптомами эндометрита, сальпингита, пельвиоперитонита.
Следует отметить повышение частоты выявления видов Candida non-albicans в этиологии заболеваний урогенитального тракта.
У многих пациенток ВВК развивается во время беременности. У беременных с ВВК угроза прерывания возрастает в 1,5 раза. Кроме того, ВВК является одной из причин развития таких серьезных осложнений, как самопроизвольный выкидыш на ранних сроках, развитие хориоамнионита и плацентита, преждевременное излитие околоплодных вод, преждевременные роды. В послеродовом периоде могут развиться послеродовая раневая инфекция, послеродовый эндометрит, сепсис.
При ВВК у беременных повышается частота неонатального кандидоза среди доношенных детей, который может проявляться и как локализованная инфекция (стоматит, фарингит, ларингит, конъюнктивит, омфалит, дерматит, пневмония), и как диссеминированная (менингит, энцефалит, энтероколит, дерматит, пневмония, бронхит, эндокардит, пиелонефрит).
В настоящее время в Российской Федерации различают три клинические формы генитального кандидоза:
-
кандидоносительство;
-
острый урогенитальный кандидоз;
-
хронический (рецидивирующий) урогенитальный кандидоз.
Международная клиническая классификация ВВК (Европа, США, Канада и др.) выделяет неосложненный (у здоровых небеременных пациенток) и осложненный ВВК (тяжелое, хроническое течение, иммунокомпрометированность, беременность, наличие в этиологии C. non-albicans).
В связи с тенденцией к распространению ВВК особую важность приобретают своевременность и эффективность лечения.
Согласно Федеральным клиническим рекомендациям по диагностике и лечению ИППП, кожных и венерических болезней Российского общества дерматовенерологов и косметологов (РОДВК) за 2013 г. лечение проводится только после постановки диагноза «урогенитальный кандидоз», основанием служат результаты клинико-лабораторных исследований. Выявление элементов Candida spp. при микроскопии или культуральная идентификация грибов в отсутствие клинических симптомов не являются показанием к лечению.
Цели лечения:
1) клиническое выздоровление;
2) нормализация лабораторных показателей:
-
отсутствие элементов грибов;
-
лейкоцитоза при микроскопии;
-
роста или снижение концентрации грибов при культуральном исследовании;
3) предотвращение развития осложнений беременности, послеродового периода, при инвазивных гинекологических процедурах.
Для лечения ВВК применяют противогрибковые препараты – как местно (интравагинально), так и системно (перорально).
Докладчик подчеркнула, что при остром урогенитальном кандидозе предпочтение следует отдавать местным лекарственным средствам, чтобы избежать системного влияния на организм. В случае невозможности их использования рекомендованы системные препараты. Целесообразность применения влагалищных препаратов с лактобактериями или спринцеваний на сегодняшний день не является доказанной.
Основными препаратами при ВВК считаются имидазолы (клотримазол, кетоконазол, эконазол, изоконазол, миконазол), триазолы (флуконазол, итраконазол), полиеновые антибиотики (нистатин, леворин, натамицин).
В Федеральных клинических рекомендациях РОДВК (2013) при ВВК предусмотрены следующие схемы лечения:
-
натамицин (сила рекомендаций А) – влагалищные свечи 100 мг один раз в сутки в течение шести дней;
-
клотримазол (сила рекомендаций А) – влагалищные таблетки 200 мг один раз в сутки в течение трех дней или 100 мг один раз в сутки в течение семи дней;
-
миконазол (сила рекомендаций В) – влагалищные свечи 100 мг один раз в сутки в течение семи дней;
-
бутоконазол (сила рекомендаций С) – 2%-ный влагалищный крем 5 г однократно;
-
итраконазол (сила рекомендаций D) – влагалищные таблетки 200 мг один раз в сутки в течение 10 дней;
-
флуконазол (сила рекомендаций А) – капсулы 150 мг однократно;
-
итраконазол (сила рекомендаций С) – капсулы 200 мг один раз в сутки в течение трех дней.
При выраженных воспалительных процессах показаны вагинальные имидазолы – до 10–14 дней или флуконазол – 150 мг дважды с перерывом 72 часа.
В последние годы отмечено увеличение частоты выявления грибов Candida spp., резистентных к наиболее часто используемым противогрибковым препаратам. За 10 лет зафиксировано снижение чувствительности (числа абсолютно чувствительных штаммов) к флуконазолу – в 2,2 раза, итраконазолу – в 1,7 раза, кетоконазолу – в 2,7 раза, клотримазолу – в 1,9 раза. Однако отмечено повышение чувствительности к полиенам: леворину – в 2 раза, натамицину – в 3,4 раза21.
В связи с этим препаратами выбора все чаще становятся средства, обладающие фунгицидной активностью.
При лечении хронического рецидивирующего ВВК после проведения основного курса лечения рекомендована поддерживающая терапия не менее шести месяцев.
В случае хронического рецидивирующего урогенитального кандидоза при Candida spp., чувствительных к азолам, применяют местно азолы – курс до 14 дней (сила рекомендаций В) или флуконазол в дозе 150 мг трижды с интервалом 72 часа (сила рекомендаций А), при Candida non-albicans – интравагинально натамицин в дозе 100 мг один раз в сутки в течение 6–12 дней (сила рекомендаций С).
В качестве поддерживающей терапии показаны натамицин – влагалищные свечи 100 мг один раз в неделю (сила рекомендаций С), клотримазол – влагалищные таблетки 500 мг один раз в неделю (сила рекомендаций D) или флуконазол – капсулы 150 мг один раз в неделю (сила рекомендаций С).
Известно, что ВВК нередко сопутствует кандидоз кишечника. По данным отечественных исследований, частота встречаемости дисбиоза/кандидоза кишечника в популяции составляет 25%. При этом 31% всех дисбиозов кишечника – с избыточным ростом Candida spp.22
В исследованиях западных ученых почти у половины женщин с хроническим рецидивирующим ВВК выявляется кандидоз кишечника23, в исследованиях отечественных акушеров-гинекологов при анализе микробиоты у беременных выявлены идентичные грибы во влагалище и в кишечнике24. Таким пациентам может быть показан натамицин. Натамицин – противогрибковый антибиотик широкого спектра действия. Он относится к препаратам полиенового ряда. Натамицин оказывает первично фунгицидное действие: фиксируясь на стероловых компонентах мембраны гриба, нарушает ее проницаемость и вызывает лизис клетки гриба.
Его преимуществами перед другими препаратами являются широкий спектр антимикотической активности, более высокая активность по отношению к C. albicans и C. non-albicans, чем у нистатина. Он не влияет на влагалищный микробиоценоз, нетоксичен при применении внутрь и местно. Препарат можно использовать на ранних сроках беременности (с первого триместра) и в период лактации.
Для лечения хронического рецидивирующего ВВК в сочетании с кандидозом кишечника в период обострения назначают комбинацию двух лекарственных форм натамицина: вагинальные свечи по 100 мг один раз в сутки в течение шести дней и кишечнорастворимые таблетки по 100 мг четыре раза в сутки в течение десяти дней. После завершения основного курса лечения необходим курс препаратами, способствующими восстановлению микробиоты кишечника. Для поддерживающей терапии возможно применение натамицина вагинально по 100 мг один раз в сутки в течение трех дней перед менструацией в течение шести месяцев.
Результаты клинических исследований, проведенных на кафедре дерматовенерологии ФПК и ППС ИГМУ (2010–2013), продемонстрировали, что клиническая ремиссия ВВК после терапии натамицином отмечалась у 100% больных. Лейкоцитоза при микроскопии влагалищного отделяемого не обнаружено. У 78% пациентов отсутствовал рост грибов во влагалище.
После лечения натамицином пациентов с кандидозом кишечника клиническое выздоровление отмечено у 64%, улучшение – у 36%. У пациентов не отмечался рост грибов в кишечнике и дисбактериоз.
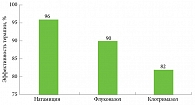
Через шесть месяцев поддерживающей терапии хронического рецидивирующего ВВК клиническая ремиссия была констатирована у 96% пациенток, рецидив – лишь у двух (рис. 2). Культуральное исследование на наличие Сandida spp. было отрицательным у 96% пациентов.
Через шесть месяцев после окончания перорального приема натамицина по поводу кандидозного дисбиоза кишечника клиническая ремиссия отмечена у 100% больных. Дисбактериоз кишечника после шести месяцев наблюдения не зафиксирован ни у одной пациентки.
Для лечения беременных, страдающих урогенитальным кандидозом, препаратом выбора является полиеновый антимикотик натамицин (Пимафуцин®).
Согласно Федеральным клиническим рекомендациям РОДВК (2013) для лечения беременных применяют натамицин в виде влагалищных свечей по 100 мг один раз в сутки в течение трех – шести дней, начиная с первого триместра (сила рекомендаций С). Со второго триместра беременности также рекомендован клотримазол в виде влагалищных таблеток 100 мг один раз в сутки в течение семи дней (сила рекомендаций В) или в виде 1%-ного крема 5 г один раз в сутки в течение семи дней (сила рекомендаций В).
Следует отметить, что при наличии у половых партнеров пациенток с ВВК симптомов баланопостита, уретрита целесообразно их обследование и при необходимости лечение. По мнению отечественных и зарубежных специалистов, в отсутствие симптомов половые партнеры не подлежат лечению.
Для лечения кандидозного баланопостита применяют такие препараты, как натамицин – 2%-ный крем один-два раза в сутки в течение семи дней (сила рекомендаций D), клотримазол 1%-ный крем два раза в сутки в течение семи дней (сила рекомендаций D), флуконазол в дозе 150 мг перорально однократно (сила рекомендаций А), итраконазол в дозе 200 мг перорально один раз в сутки в течение трех дней (сила рекомендаций D).
Заключение
Выбор антибактериального или антимикотического препарата должен основываться в первую очередь на высокой чувствительности возбудителя к данному лекарственному средству. Кроме того, препарат должен обладать низкой степенью токсичности и хорошей переносимостью.
В настоящее время в соответствии с российскими клиническими рекомендациями препаратами выбора для лечения неосложненных и осложненных форм хламидийной инфекции, а также микоплазменной и уреаплазменной инфекций считаются доксициклина моногидрат (Юнидокс Солютаб®) и джозамицин (Вильпрафен®), ВВК и кандидоза кишечника – натамицин (Пимафуцин®).
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.