количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Практика
Эффективная фармакотерапия ожирения – залог успешного лечения заболеваний, связанных с лишним весом
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Эндокринология" №3 (29)
- Аннотация
- Статья
- Ссылки
- English
Ожирение устойчиво ассоциируется с развитием целого ряда хронических заболеваний, приводящих к снижению качества жизни пациентов, инвалидизации и смерти. В статье рассматривается взаимосвязь между ожирением и заболеваниями опорно-двигательного аппарата, описываются механизмы, при помощи которых ожирение способствует развитию остеоартроза. Показано, что снижение массы тела может замедлить прогрессирование остеоартроза. Излагаются методы нефармакологического и медикаментозного лечения ожирения с позиций предотвращения развития и улучшения течения остеоартроза и снижения риска сердечно-сосудистых заболеваний. Представлен собственный опыт применения сибутрамина (Редуксин®) у 28 больных ожирением с остеоартрозом коленных суставов II–III стадии. У всех больных лечение сибутрамином привело к уменьшению массы тела и окружности талии, сопровождалось уменьшением выраженности симптомов остеоартроза и улучшением показателей липидного обмена, что позволило рекомендовать препарат для лечения пациентов с ожирением и сопутствующими заболеваниями опорно-двигательного аппарата.
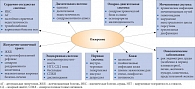
Рис. 1. Заболевания и состояния, обусловленные ожирением
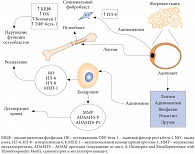
Рис. 2. Взаимосвязь жировой и хрящевой тканей

Таблица. Выбор методов терапии избыточного веса и ожирения в зависимости от ИМТ
Введение
Ожирение является результатом нарушения энергетического баланса и развивается при увеличении потребления пищи и снижении расхода энергии. В XXI веке ожирение стало одной из самых распространенных проблем здоровья населения многих стран мира, включая Россию. Повсеместно наблюдается стремительное увеличение частоты этого заболевания. Согласно эпидемиологическим прогнозам, к 2025 г. во всем мире от ожирения будут страдать 40% мужчин и 50% женщин [1, 2]. Уже давно ожирение рассматривается не просто как избыток жировой ткани в организме, а как хроническое рецидивирующее заболевание, ассоциирующееся с рядом серьезных осложнений.
С широким распространением ожирения увеличивается и количество обусловленных им заболеваний и патологических состояний (рис. 1). Лишний вес способствует развитию и проявлению таких хронических заболеваний и нарушений, как ишемическая болезнь сердца (ИБС), сахарный диабет (СД) 2 типа, дислипидемия и атеросклероз, артериальная гипертония (АГ), синдром ночного апноэ, заболевания опорно-двигательной системы, и многих других, приводящих к потере трудоспособности, резко снижающих качество жизни и сокращающих ее продолжительность [1, 3–5]. Именно поэтому проблеме терапии ожирения и связанных с ним заболеваний уделяется все больше внимания.
Установлена четкая взаимосвязь между ожирением и сердечно-сосудистыми заболеваниями (ССЗ) [2, 6]. Так, в возрасте старше 18 лет повышение массы тела на 1,0 кг увеличивает риск развития АГ на 5%, а прибавка 8,0–11,0 кг увеличивает риск ССЗ в 1,6 раза. Кроме того, у лиц среднего возраста с избыточной массой тела вероятность развития АГ выше на 50% по сравнению с теми, у кого нормальная масса тела. Снижение массы тела в пределах 5,0–9,9 кг уменьшает риск развития АГ на 15%, а на 10 кг и более – на 26% [6]. Ожирение ухудшает течение АГ, повышает риск возникновения ранних сосудистых осложнений. С одной стороны, ожирение способствует нарастанию АГ, с другой – непосредственно вызывает нарушения сократимости миокарда. Наряду с этим избыточная масса тела у пациента с АГ ускоряет развитие гипертрофии миокарда левого желудочка – фактора повышенного риска внезапной смерти. Особенно неблагоприятным считают абдоминальное ожирение, которое часто наблюдается и при относительно невысоких величинах индекса массы тела (ИМТ) [7].
Ожирение как причина развития и прогрессирования остеоартроза
Неизбежным спутником ожирения являются заболевания опорно-двигательной системы [4, 6]. Среди больных с избыточной массой тела достаточно высока распространенность остеоартроза – хронического дегенеративно-дистрофического заболевания суставов [8–10]. Основные клинические симптомы недуга – боль и деформация суставов – приводят к их функциональной недостаточности.
В эпидемиологических исследованиях показано частое сочетание остеоартроза с ожирением, метаболическим синдромом и СД 2 типа. Прежде всего это относится к остеоартрозу коленных суставов, при котором выявлена выраженная зависимость между величиной ИМТ и риском этого заболевания [8, 11, 12]. При остеоартрозе в первую очередь поражаются так называемые нагрузочные суставы, особенно суставы ног (коленный и тазобедренный), что значительно ухудшает качество жизни больных и может приводить к развитию инвалидности. В исследовании F.M. Cicuttini и соавт. показано, что прибавка массы тела всего на 1 кг увеличивает риск остеоартроза коленного сустава и карпометокарпальных суставов на 9–11%. Симптоматический или бессимптомный остеоартроз нижних конечностей был обнаружен у близнецов, которые были всего на 3–5 кг тяжелее своих братьев или сестер [9].
При ИМТ > 30 кг/м² риск развития остеоартроза коленных суставов в 4 раза выше, чем при ИМТ 25 кг/м² [4]. Исследование D.J. Hart и T.D. Spector, включавшее 1000 женщин, выявило, что относительный риск развития одностороннего и двустороннего остеоартроза коленных суставов, по данным рентгенологического исследования, составил соответственно 6,2 и 18 у лиц с ИМТ > 26,4 кг/м² по сравнению с обследованными лицами с ИМТ < 23,4 кг/м² [13]. Ожирение оказывает влияние и на прогноз остеоартроза [14, 15]. Интересно, что 27% и 69% случаев артропластики соответственно бедра и колена у женщин среднего возраста в Великобритании были связаны с ожирением [8]. Повышенная масса тела способствует прогрессии рентгенологических проявлений остеоартроза коленных суставов, при этом высокий ИМТ оказывает более выраженное влияние на заболеваемость остеоартрозом, чем на его прогрессирование [9, 11].
Характерным симптомом, наблюдаемым при остеоартрозе у людей с ожирением, является потеря хрящевой ткани. Сложность патогенеза остеоартроза обусловлена особым строением хрящевой ткани; ее основная функция сводится к адаптации сустава к механической нагрузке (сжатие при нагрузке и восстановление при ее снятии) и обеспечению движения в суставе без трения суставных поверхностей [8, 9]. Суставной хрящ на 98% состоит из соединительнотканного матрикса, основными компонентами которого служат коллагеновые волокна, преимущественно 2-го типа. Все остальное пространство заполнено гиалуроновой кислотой и сульфатированными протеогликанами. Ключевая роль в поддержании равновесия между анаболическими и катаболическими процессами отводится клеточным элементам хряща – хондроцитам [16]. Повреждение хондроцита связано с активацией специфических рецепторов на мембране (рецепторы к интерлейкину (ИЛ) 1, лептину, фибронектину f), запускающих активацию синтеза провоспалительных и деструктивных медиаторов, опосредованную белками ядерного фактора транскрипции каппа-B (NF-каппа-B). Значение имеет также увеличение продукции цитокинов, которые стимулируют синтез протеаз, активатора плазминогена, простагландина E и, с одной стороны, способствуют пролиферации синовиальных клеток, с другой – подавляют синтез коллагена и протеогликанов хондроцитами [4, 16, 17]. При остеоартрозе происходит гиперпродукция хондроцитами циклооксигеназы-2, фермента, индуцирующего синтез простагландинов, принимающих участие в развитии воспаления и индуцибельной формы оксида азота, оказывающего токсическое действие на хрящ и индуцирующего апоптоз хондроцитов [4, 6, 13] (рис. 2).
Следует учитывать, что последствия остеоартроза – боль и нарушение функции сустава – вынуждают больного сократить или ограничить физическую активность, что в свою очередь увеличивает прибавку массы тела и затрудняет лечение ожирения.
Существует несколько точек зрения в отношении механизмов, при помощи которых ожирение способствует развитию остеоартроза [4]. Несомненно, что при лишнем весе суставы подвергаются повышенной механической нагрузке (биомеханическая теория, К. Martin, 1997). Интересно, что на поверхности хондроцитов обнаружены механорецепторы, чувствительные к давлению и связанные с внеклеточным матриксом сигнальным каскадом. Ожирение, предположительно, может индуцировать повреждение хряща через активацию этих рецепторов [6].
Вместе с тем существуют и другие механизмы, связанные с ожирением и способные изменить метаболизм хрящевой, костной ткани и привести к развитию остеоартроза. В научной литературе представлены многочисленные данные о взаимосвязи остеоартроза с метаболическими нарушениями, обусловленными инсулинорезистентностью (ИР) [8, 15, 18, 19]. Жировая ткань является эндокринным органом и секретирует большое количество цитокинов, хемокинов и пептидов, осуществляющих важные физиологические функции в организме. Имея паракринный, аутокринный и эндокринный механизмы действия, адипоцитокины влияют на метаболизм углеводов, жиров, процессы воспаления, свертывания, иммунитета, ангиогенеза, жизнедеятельности костной, хрящевой ткани и многое другое [2, 4, 7]. У худощавого взрослого человека в организме присутствует порядка 35 млрд адипоцитов, а у тучного человека их количество может достигать 125 млрд.
Нарушение регуляции синтеза и секреции сигнальных веществ жировой тканью может служить связующим звеном, посредством которого ожирение и ИР становятся фактором риска заболеваний опорно-двигательного аппарата, поскольку активизируют дегенеративно-воспалительные процессы в суставных структурах. Однако риск развития сопутствующих ожирению патологических состояний в значительной степени определяется особенностями отложения жировой ткани в организме [7]. Наиболее опасно абдоминальное отложение жира, о котором свидетельствует увеличение окружности талии (у мужчин – более 94 см, у женщин – более 80 см). Особенность абдоминального жира заключается в том, что в нем очень активно протекают метаболические процессы. Адипоциты висцерального, в отличие от подкожного жира, имеют высокую плотность и чувствительность бета-адренорецепторов (особенно бета-3 типа), рецепторов кортизола и андрогенов, но при этом низкую плотность и чувствительность инсулиновых рецепторов и альфа-адренорецепторов. Незначительное влияние инсулина в абдоминальной жировой ткани способствует повышенной продукции свободных жирных кислот. ИР представляет собой снижение биологических эффектов инсулина в различных органах и тканях. При этом возникает необходимость в увеличении количества инсулина для компенсации состояния ИР. Развивающаяся компенсаторная гиперинсулинемия усиливает поглощение глюкозы периферическими тканями, а также уменьшает продукцию глюкозы печенью, что определенное время поддерживает нормальное содержание глюкозы крови. Гиперинсулинемия, с одной стороны, необходима для преодоления ИР, а с другой – представляет собой патологический процесс, способствующий возникновению и развитию метаболических, гемодинамических и системных нарушений. Нарушение метаболизма инсулина при ожирении также способствует ухудшению анаболических процессов в хондроцитах, если учитывать их чувствительность к инсулину [1, 20].
Среди адипоцитокинов, осуществляющих связи между жировой тканью и опорно-двигательным аппаратом, а также участвующих в развитии изменений со стороны тканей скелета при ожирении, большое внимание уделяется лептину – пептиду, наиболее изученному к настоящему времени. Недавно было установлено, что кроме регуляции пищевого поведения лептин выполняет и другие важные функции, например участвует в метаболизме хрящевой ткани [17]. Наличие рецепторов лептина во всем семействе клеток мезенхимального происхождения, к которому относятся хондробласты/хондроциты, остеобласты/остеоциты и клетки макрофагального ряда, обеспечивает эндокринную, паракринную и аутокринную регуляцию, осуществляемую этим гормоном по отношению к структурам, формирующим суставы [18].
Действуя на Т-клетки как модулятор, лептин играет важную роль в патогенезе ряда воспалительных заболеваний, включая дегенеративные и воспалительные заболевания суставов [19]. Так, в исследовании Н. Dumond и соавт. обнаружено, что у женщин с остеоартрозом гиперэкспрессия лептина в хрящевой ткани коррелирует со степенью разрушения хряща [18]. При избыточной продукции лептина замедляется синтез продуктов хрящевого матрикса. В эксперименте лептин индуцирует апоптоз хондроцитов, что приводит к потере хрящевой ткани. Как провоспалительный медиатор, лептин стимулирует через NF-каппа-В продукцию провоспалительных цитокинов как моноцитами и макрофагами, так и хондроцитами; в результате в хрящевой ткани активируются металопротеиназы и наблюдается апоптоз хондроцитов [17]. Внутрисуставные инъекции лептина стимулируют анаболические процессы и активируют синтез ростовых факторов в хряще и хондроцитах [21]. Лептин играет определенную роль в воспалительном ответе и может увеличивать продукцию макрофагами провоспалительных цитокинов. В целом характер влияния лептина на ткани опорно-двигательного аппарата зависит как от его концентрации, так и от присутствия целого ряда гормонально-метаболических факторов в циркуляции и в средах, непосредственно окружающих клетки хрящевой и костной ткани [1]. Действуя через систему провоспалительных цитокинов, лептин может способствовать потере хрящевой ткани, а стимулируя синтез факторов роста клетками мезенхимальной ткани в суставах, приводить к активному новообразованию хрящевых клеток, формированию хрящевых выростов и их оссификации, иначе говоря, к образованию остеофитов.
G. Miller и соавт. изучили взаимосвязь уровня сывороточного лептина, ожирения и прогрессирования остеоартроза коленных суставов у пациентов в возрасте старше 60 лет с ИМТ 28,0 кг/м² и выше [22]. Результаты исследования (длительностью 18 месяцев) свидетельствуют о том, что снижение уровня сывороточного лептина – один из механизмов, с помощью которого снижение массы тела может замедлить прогрессирование остеоартроза. Таким образом, лептин, по-видимому, является связующим звеном между остеоартрозом и ожирением, при котором всегда возрастает тканевой и системный уровень лептина, способствующего повышению концентрации провоспалительных и ростовых факторов, под влиянием которых развиваются деструктивные процессы в тканях скелета.
В настоящее время ожирение рассматривается как состояние хронического подострого системного воспаления, что связано с увеличением синтеза провоспалительных цитокинов как адипоцитами, так и макрофагами жировой ткани (например, ИЛ-1-бета, ИЛ-6, фактора некроза опухоли альфа (ФНО-альфа), С-реактивного протеина). При этом количество макрофагов, мигрирующих в жировую ткань (особенно в висцеральную), тем больше, чем выше выраженность ИР [2, 7]. Это вносит весомый вклад в развитие остеоартроза, который также расценивается как низковоспалительное состояние [1, 8, 13].
Воспаление усиливает разрушение хряща, поскольку провоспалительные цитокины способствуют высвобождению хондроцитами ферментов – матриксных металлопротеаз, активаторов плазминогена, повреждающих коллаген и протеогликаны хряща [23]. Отметим, что экспрессия ФНО-альфа более всего выражена в адипоцитах висцеральной жировой ткани [7]. Стимулируя пролиферацию фибробластов, синтез простагландинов, фактора активации тромбоцитов, супероксидных радикалов и подавляя синтез коллагена и протеогликанов, ФНО-альфа усиливает деструктивные эффекты в суставных структурах. Существенное влияние на прогрессирование деградации хряща при остеоартрозе оказывает нарушение синтеза или действия анаболических медиаторов – инсулиноподобного фактора роста-1 и трансформирующего фактора роста бета, активность которых связана с репарацией хрящевой ткани.
Следовательно, избыточная (особенно висцеральная) жировая ткань принимает участие в процессах деградации хрящей, развитии воспаления в суставах и соответственно в прогрессировании остеоартроза. В свою очередь похудение приводит к уменьшению содержания различных маркеров воспаления, что положительно сказывается на течении остеоартроза.
Особенности лечения ожирения у пациентов с остеоартрозом
Лечение ожирения – достаточно сложная задача, поскольку это хроническое заболевание, требующее длительного наблюдения. Несмотря на серьезность данной проблемы, терапевтические эффекты порой остаются неудовлетворительными. Практика показывает, что более чем 90% людей, снизивших массу тела, в течение одного года вновь прибавляют в весе, а в некоторых случаях масса тела становится даже больше исходной [2, 24]. Современные подходы к лечению ожирения предполагают использование нефармакологических методов терапии, которые при необходимости дополняются фармакотерапией (таблица).
Основной целью лечения ожирения наряду со снижением массы тела, несомненно, является предотвращение развития сопутствующих заболеваний или улучшение их течения, максимальное снижение риска развития ССЗ и их осложнений, повышение качества жизни пациента [2, 3, 5]. Согласно современным рекомендациям, клинически значимое снижение массы тела составляет 5% от исходной величины. Интересно, что у больных ожирением с диагностированным остеоартрозом коленных суставов нетрудоспособность, обусловленная заболеванием опорно-двигательного аппарата, может быть значительно снижена с уменьшением массы тела на 5,1% [8]. Для пациентов с ИМТ > 35 кг/м² желаемой целью терапии является снижение массы тела на 10% от исходной величины. После достижения эффективного похудения необходимо осуществлять меры по поддержанию достигнутых результатов и предупреждению рецидивов заболевания [2].
Основу терапии ожирения составляют низкокалорийное питание и ограниченное потребление жиров. Похудение за счет отрицательного энергетического баланса достигается снижением физиологической калорийности рациона на 500–600 ккал/сут. Снижение массы тела может быть достигнуто при соблюдении низкокалорийной диеты, содержащей не более 25–30% жира от суточной калорийности рациона, в том числе насыщенных жиров менее 7–10%, полиненасыщенных – до 10% и мононенасыщенных – менее 20%, холестерина менее 300–200 мг, содержание клетчатки должно составлять 20–25 г/сут и более. Потребление углеводов (медленноусвояемых) должно составлять 55–60%, а белков – 15% от общей калорийности рациона. Также рекомендуется употребление соли в умеренных количествах (до 5 г в день). Контроль эффективности снижения массы тела достигается обязательным ежедневным ведением пациентом дневника питания, в котором указываются все приемы пищи, полный перечень продуктов и их объем, количество потребленной жидкости.
Больным могут быть рекомендованы регулярные динамические физические нагрузки (дозированная ходьба, плавание, велотренажер) умеренной интенсивности (4–5 занятий в неделю по 30–45 мин), поскольку в начале терапии больные часто не в состоянии выполнять продолжительные и интенсивные занятия. Однако следует иметь в виду, что интенсивная физическая нагрузка (более 10 000 шагов в сутки) способствует структурным изменениям в коленном суставе, особенно у пациентов с остеоартрозом, осложненным повреждением мениска или костного мозга (по данным магнитно-резонансной томографии). Таким пациентам следует избегать интенсивных физических нагрузок (более 10 000 шагов в сутки) и выбирать альтернативные методы снижения массы тела [12].
Для пациента с ожирением и остеоартрозом осуществление мероприятий по уменьшению массы тела – первоочередная задача с точки зрения снижения механической нагрузки и профилактики ССЗ и их осложнений [8, 9, 11]. Успешная коррекция массы тела позволит уменьшить интенсивность болевого синдрома в пораженных суставах, будет способствовать замедлению прогрессирования остеоартроза, а также значительно снизит риск сердечно-сосудистых осложнений. В исследовании D. Felson и соавт., включавшем 800 женщин, было продемонстрировано, что уменьшение ИМТ на 2 кг/м² на протяжении 10 лет снизило риск развития остеоартроза более чем на 50% [8].
Среди пациентов, снизивших массу тела на фоне немедикаментозных вмешательств, около двух третей вновь прибавляют потерянный вес в течение года, а большинство – в последующие 5 лет жизни. В некоторых случаях масса тела становится даже больше исходной. Только 4–5% больных ожирением могут достигнуть положительных результатов без дополнительной фармакотерапии. Медикаментозная терапия проводится пациентам при ИМТ ≥ 30 кг/м² и при ИМТ ≥ 27 кг/м² в случае наличия связанных с ожирением патологических состояний и факторов риска ССЗ [2].
Фармакотерапия ожирения используется в качестве дополнения к немедикаментозным методам и позволяет не только повысить приверженность пациента немедикаментозному лечению, но и достигнуть более эффективного снижения массы тела и его поддержания в течение длительного времени. Следует иметь в виду, что у пациентов с ожирением достаточно часто диагностируются различные варианты расстройства пищевого поведения [19, 25, 26]. К современным лекарственным средствам, используемым для лечения ожирения и коррекции пищевого поведения больных, относится сибутрамин, фармакологическое действие которого заключается в селективном торможении обратного захвата серотонина и норадреналина в синапсах центральной нервной системы [24, 27, 28]. Результатом накопления серотонина в синаптической щели является усиление и пролонгирование чувства насыщения и, как следствие, уменьшение объема потребляемой пищи. Это один из механизмов действия препарата, способствующих снижению аппетита и формированию правильного пищевого поведения у пациента [19, 25]. Как показали исследования, 87% пациентов придерживаются сформированного в процессе терапии сибутрамином пищевого поведения [24].
Следует особо подчеркнуть необходимость длительного поддержания достигнутых результатов после окончания фармакотерапии ожирения. Снижение скорости метаболизма с развитием синдрома низкого Т₃ затрудняет дальнейшую эффективную потерю массы тела у большинства пациентов. В этой связи очень важным представляется второй механизм действия сибутрамина: активируя бета-3- и бета-2-адренорецепторы адипоцитов, препарат стимулирует процессы термогенеза и увеличивает расход энергии организма, тем самым инициируя липолиз [27]. Таким образом, при снижении массы тела препарат увеличивает скорость метаболических процессов [19, 25]. Показано, что среди пациентов, ранее получавших лечение сибутрамином, 74% сохранили свой вес на прежнем уровне или в дальнейшем еще больше снизили массу тела (против 41% в группе пациентов, принимавших плацебо) [24].
Опыт применения сибутрамина (Редуксин®) на кафедре эндокринологии и диабетологии МГМСУ свидетельствует о высокой эффективности и безопасности препарата для лечения больных ожирением, страдающих остеоартрозом. В открытое неконтролируемое исследование было включено 28 больных ожирением с остеоартрозом коленных суставов II–III стадии женского пола в возрасте 45–65 лет (средний ИМТ 37,6 ± 8,8 кг/м²). В исследование не включались пациенты с СД 2 типа, неконтролируемой АГ, булимией, психическими и тяжелыми соматическими заболеваниями. Тяжесть суставного синдрома определялась путем оценки интенсивности болевого синдрома в покое и при движении по визуальной аналоговой шкале (ВАШ, мм) и индексу WOMAC (Western Ontario and McMaster University – Университеты Западного Онтарио и Макмастера). Первый тест отражал общую выраженность суставной боли по оценке больного с использованием 100-миллиметровой шкалы боли, согласно которой 0 означает отсутствие боли, а 100 – максимальную интенсивность боли [29]. Индекс WOMAC определялся с помощью опросника для самостоятельной оценки пациентом выраженности боли в покое и при ходьбе (5 вопросов), выраженности и длительности скованности (2 вопроса), а также функциональной недостаточности в повседневной деятельности (17 вопросов). Непосредственно сама оценка проводилась с использованием шкалы ВАШ (см), далее все полученные показатели суммировались. В течение 24 недель пациенты получали Редуксин® по 10–15 мг/сут на фоне гипокалорийного питания с дефицитом калорий 500–600 ккал по сравнению с расчетным показателем суточной калорийности.
Все пациенты полностью завершили курс лечения Редуксином. На фоне комплексной терапии у всех больных наблюдалась положительная динамика антропометрических показателей. При этом у большинства снижение массы тела достигло клинически значимых величин; также зарегистрировано уменьшение окружности талии. Важно отметить, что похудение при применении сибутрамина сопровождалось уменьшением симптомов остеоартроза (по шкале ВАШ). Больные отметили улучшение качества жизни на 40% (по шкале ВАШ). Кроме того, суммарный индекс WOMAC снизился на 58,2%. Под влиянием Редуксина уменьшение массы тела сопровождалось положительной динамикой уровня ряда сердечно-сосудистых факторов риска: снизилась концентрация общего холестерина и триглицеридов на 11 и 17% соответственно. Одновременно возросла концентрация липопротеидов высокой плотности на 7,3%. В целом анализ данных индивидуального дневника питания и мнения пациентов свидетельствует о том, что регулярный прием Редуксина в дозе 10–15 мг позволяет легко и эффективно соблюдать рекомендации врача по низкокалорийному питанию. Переносимость препарата была хорошей. Не было отмечено достоверных изменений показателей артериального давления (АД), частоты сердечных сокращений (ЧСС). Полученные результаты позволяют рассматривать Редуксин® как препарат выбора для больных ожирением, страдающих остеоартрозом коленных суставов.
Лечение Редуксином инициируют с начальной дозы 10 мг, принимаемой однократно утром, независимо от приема пищи. В дальнейшем оценивается эффективность проводимой терапии; если не достигнуто снижение массы тела на 2 кг и более в течение первых четырех недель применения, то доза Редуксина увеличивается до 15 мг/сут. В начале первого месяца лечения рекомендуется контролировать ЧСС, каждые 2 недели – АД, в дальнейшем – один раз в 1–3 месяца. Лечение препаратом необходимо прекратить при увеличении ЧСС на 10 и более ударов в минуту и повышении показателей систолического и диастолического АД на 10 мм рт. ст. при двух последовательных измерениях. Редуксин® не следует применять при неконтролируемой АГ, ИБС, нарушениях сердечного ритма, сердечной недостаточности, эпилепсии, печеночной и почечной недостаточности, терапии ингибиторами моноаминоксидазы и антидепрессантами, глаукоме. Следует воздержаться от приема препарата во время беременности и лактации.
Заключение
Ожирение – широко распространенное заболевание, эффективная терапия которого чрезвычайно важна с точки зрения предотвращения развития связанных с ним многочисленных патологических состояний. Полученные научные данные свидетельствуют о том, что избыточная масса тела играет важную роль в развитии заболеваний опорно-двигательного аппарата, а снижение массы тела является неотъемлемым компонентом лечения остеоартроза, поскольку приводит к улучшению функции суставов, повышению физической активности и качества жизни пациентов. Удобство в применении, высокая эффективность и хорошая переносимость позволяют рекомендовать Редуксин® для снижения массы тела у больных ожирением, в том числе с сопутствующими заболеваниями, включая остеоартроз.
1. Manson J.E., Willett W.C., Stampfer M.J. et al. Body weight and mortality among women // N. Engl. J. Med. 1995. Vol. 333. № 11. P. 677–685.
2. Yanovski S.Z., Yanovski J.A. Obesity // N. Engl. J. Med. 2002. Vol. 346. № 8. P. 591–602.
3. Calle E.E., Rodriguez C., Walker-Thurmond K. et al. Overweight, obesity, and mortality from cancer in a prospectively studied cohort of U.S. adults // N. Engl. J. Med. 2003. Vol. 348. № 17. P. 1625–1638.
4. Lementowski P.W., Zelicof S.B. Obesity and osteoarthritis // Am. J. Orthop. (Belle Mead N.J.). 2008. Vol. 37. № 3. P. 148–151.
5. Rahmouni K., Correia M.L., Haynes W.G. et al. Obesity-associated hypertension: new insights into mechanisms // Hypertension. 2005. Vol. 45. № 1. P. 9–14.
6. Pottie P., Presle N., Terlain B. et al. Obesity and osteoarthritis: more complex than predicted! // Ann. Rheum. Dis. 2006. Vol. 65. № 11. P. 1403–1405.
7. Tchernot A., Despers J.P. Pathophysiology of human visceral obesity: an update // Physiol. Rev. 2013. Vol. 93. № 1. P. 359–404.
8. Насонова В.А., Мендель О.И., Денисов Л.Н. и др. Остеоартроз и ожирение: клинико-патогенетические взаимосвязи // Профилактическая медицина. 2011. № 1. С. 29–37.
9. Cicuttini F.M., Baker J.R., Spector T.D. The association of obesity with osteoarthritis of the hand and knee in women: a twin study // J. Rheumatol. 1996. Vol. 23. № 7. P. 1221–1226.
10. Reijman M., Pols H.A., Bergink A.P. et al. Body mass index associated with onset and progression of osteoarthritis of the knee but not of the hip: the Rotterdam Study // Ann. Rheum. Dis. 2007. Vol. 66. № 2. P. 158–162.
11. Coggon D., Reading I., Croft P. et al. Knee osteoarthritis and obesity // Int. J. Obes. Relat. Metab. Disord. 2001. Vol. 25. № 5. P. 622–627.
12. Ding C., Parameswaran V., Cicuttini F. et al. Association between leptin, body composition, sex and knee cartilage morphology in older adults: the Tasmanian older adult cohort (TASOAC) study // Ann. Rheum. Dis. 2008. Vol. 67. № 9. P. 1256–1261.
13. Hart D.J., Spector T.D. The relationship of obesity, fat distribution and osteoarthritis in women in the general population: the Chingford Study // J. Rheumatol. 1993. Vol. 20. № 2. P. 331–335.
14. Lago R., Gómez R., Lago F. et al. Leptin beyond body weight regulation--current concepts concerning its role in immune function and inflammation // Cell. Immunol. 2008. Vol. 252. № 1–2. P. 139–145.
15. Lago R., Gomez R., Otero M. et al. A new player in cartilage homeostasis: adiponectin induces nitric oxide synthase type II and pro-inflammatory cytokines in chondrocytes // Osteoarthritis Cartilage. 2008. Vol. 16. № 9. P. 1101–1109.
16. Buckwalter J.A., Mankin H.J., Grodzinsky A.J. Articular cartilage and osteoarthritis // Instr. Course Lect. 2005. Vol. 54. P. 465–480.
17. Goldring M.B., Berenbaum F. The regulation of chondrocyte function by proinflammatory mediators: prostaglandins and nitric oxide // Clin. Orthop. Relat. Res. 2004. № 427. Suppl. P. S37–S46.
18. Dumond H., Presle N., Terlain B. et al. Evidence for a key role of leptin in osteoarthritis // Arthritis Rheum. 2003. Vol. 48. № 11. P. 3118–3129.
19. Hainer V., Kabrnova K., Aldhoon B. et al. Serotonin and norepinephrine reuptake inhibition and eating behavior // Ann. N.Y. Acad. Sci. 2006. Vol. 1083. P. 252–269.
20. Tatari H. The structure, physiology, and biomechanics of articular cartilage: injury and repair // Acta Orthop. Traumatol. Turc. 2007. Vol. 41. Suppl. 2. P. 1–5.
21. Otero M., Lago R., Gómez R. et al. Leptin: a metabolic hormone that functions like a proinflammatory adipokine // Drug News Perspect. 2006. Vol. 19. № 1. P. 21–26.
22. Miller G.D., Nicklas B.J., Loeser R.F. Inflammatory biomarkers and physical function in older, obese adults with knee pain and self-reported osteoarthritis after intensive weight-loss therapy // J. Am. Geriatr. Soc. 2008. Vol. 56. № 4. P. 644–651.
23. Sokolove J., Lepus C.M. Role of inflammation in the pathogenesis of osteoarthritis: latest findings and interpretations // Ther. Adv. Musculoskelet. Dis. 2013. Vol. 5. № 2. P. 77–94.
24. Arterburn D.E., Crane P.K., Veenstra D.L. The efficacy and safety of sibutramine for weight loss: a systematic review // Arch. Intern. Med. 2004. Vol. 164. № 9. P. 994–1003.
25. Appolinario J.C., Bacaltchuk J., Sichieri R. et al. A randomized, double-blind, placebo-controlled study of sibutramine in the treatment of binge-eating disorder // Arch. Gen. Psychiatry. 2003. Vol. 60. № 11. P. 1109–1116.
26. Phelan S., Wadden T.A. Combining behavioral and pharmacological treatments for obesity // Obes. Res. 2002. Vol. 10. № 6. P. 560–574.
27. Walsh K.M., Leen E., Lean M.E. The effect of sibutramine on resting energy expenditure and adrenaline-induced thermogenesis in obese females // Int. J. Obes. Relat. Metab. Disord. 1999. Vol. 23. № 10. P. 1009–1015.
28. Luque C.A., Rey J.A. The discovery and status of sibutramine as an anti-obesity drug // Eur. J. Pharmacol. 2002. Vol. 440. № 2–3. P. 119–128.
29. Международные индексы оценки активности, функционального статуса и качества жизни больных ревматическими заболеваниями. М.: изд. группа «Ассоциация ревматологов России», 2007. 88 с.
Effective drug treatment of obesity is a prerequisite to successful management of obesity-related diseases
Ye.V. Biryukova, I.V. Solovyova
State Budgetary Educational Institution for Higher Professional Education ‘Moscow State University of Medicine and Dentistry named after A.I. Evdokimov’ of the Ministry of Health of Russia, Endocrinology and Diabetology Department
Contact person: Yelena Valeryevna Biryukova, lena@obsudim.ru
Obesity is strongly associated with varied chronic disorders which result in low quality of life, high risk of disability and death. The authors discuss the relationship between obesity and musculoskeletal diseases, and osteoarthritis-promoting mechanisms in obese persons. Weight loss may decelerate progression of osteoarthritis. Methods of non-drug and drug correction of obesity are analyzed from the perspective of osteoarthritis symptoms improvement/prevention and cardiovascular prophylaxis. The authors present the results of own study of sibutramine (Reduksin®) in 28 obese patients with knee osteoarthritis stage II–III. In all patients, sibutramine administration resulted in the reduction of body weight and waist circumference, improvement of osteoarthritis symptoms and lipid profile. Thus, sibutramine is recommended for the treatment of obese patients with associated musculoskeletal problems.
Новости на тему
25.02.2025
04.07.2022 13:00:00
29.06.2022 17:00:00
12.04.2022 09:00:00
31.03.2022 12:00:00
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.