Роль синдрома поликистозных яичников в первичной профилактике сердечно-сосудистых заболеваний и сахарного диабета
- Аннотация
- Статья
- Ссылки
- English
В статье представлены различные фенотипы СПКЯ, приведены данные о патогенезе, эпидемиологии, факторах риска, профилактике и лечении СПКЯ. Проведен анализ данных современных исследований, подтверждающих связь между СПКЯ и кардиометаболическими заболеваниями. Профилактика и лечение СПКЯ могут играть значительную роль в предупреждении сердечно-сосудистых заболеваний и СД 2 типа. Терапия СПКЯ направлена в первую очередь на изменение образа жизни, но для достижения целевых результатов необходимо дополнительное назначение медикаментозных препаратов.
В статье представлены различные фенотипы СПКЯ, приведены данные о патогенезе, эпидемиологии, факторах риска, профилактике и лечении СПКЯ. Проведен анализ данных современных исследований, подтверждающих связь между СПКЯ и кардиометаболическими заболеваниями. Профилактика и лечение СПКЯ могут играть значительную роль в предупреждении сердечно-сосудистых заболеваний и СД 2 типа. Терапия СПКЯ направлена в первую очередь на изменение образа жизни, но для достижения целевых результатов необходимо дополнительное назначение медикаментозных препаратов.
Введение
У женщин репродуктивного возраста СПКЯ – частое заболевание [1]. Оно характеризуется нарушениями фертильности и метаболизма [2].
СПКЯ представляет собой одну из самых актуальных проблем в репродуктивной эндокринологии, так как это заболевание ассоциировано с невынашиванием беременности и бесплодием [2]. Кроме того, у женщин с СПКЯ более высок риск развития сердечно-сосудистых заболеваний (ССЗ) [3]. При нарушениях менструального цикла у женщин с СПКЯ могут возникать такие кардиометаболические заболевания, как абдоминальное ожирение и СД. Женщины с СПКЯ генетически предрасположены к их развитию [3], поэтому у таких пациенток необходимо проводить оценку риска и первичную профилактику кардиометаболических заболеваний.
Цель обзора – проанализировать современные литературные данные, отражающие связь СПКЯ с ССЗ и кардиометаболическими заболеваниями.
При подготовке обзора были использованы следующие полнотекстовые и библиографическо-реферативные базы данных: бесплатная база данных PubMed, созданная Национальным центром биотехнологической информации (NCBI); научная электронная библиотека eLIBRARY.RU; научная электронная библиотека «КиберЛенинка». Поиск источников первичной информации осуществлялся на глубину 9 лет (2015–2024 гг.).
Определение и эпидемиология СПКЯ
Известно, что СПКЯ (синдром Штейна – Левенталя) – широко распространенное заболевание среди женщин репродуктивного возраста [4]. Согласно эпидемиологическим исследованиям, его диагностируют примерно у 11% женщин репродуктивного возраста, у женщин с бесплодием этот показатель доходит до 70%, а у женщин с гирсутизмом СПКЯ выявляют у 65–70% [5]. По данным исследования, распространенность СПКЯ в мире составляет 9,2%, отмечена чрезвычайно высокая распространенность СПКЯ на африканском континенте, в связи с чем системам здравоохранения необходимо принимать меры для своевременной диагностики и лечения этого синдрома [6]. В России, согласно статистическим данным, его частота составляет 5–20% [7]. Заболевание характеризуется нарушением менструального цикла, хронической ановуляцией и бесплодием, гиперандрогенией (ГА), поликистозным изменением яичников и увеличением их размеров и служит фактором риска (ФР) развития ССЗ и СД 2 типа [8].
Согласно Роттердамскому подходу, включающему в себя критерии Национального института здоровья США (National Institutes of Health – NIH) 1990 г. и Общества по гиперандрогениям и СПКЯ (Androgen Excess and Polycystic Ovary Syndrome Society – AE-PCOS) 2006 г., выделяют четыре фенотипа СПКЯ [9]:
фенотип А (классический) — все признаки СПКЯ (клинический гиперандрогенизм и/или ГА, овуляторная дисфункция и поликистозные яичники по данным ультрасонографии); характеризуется ожирением, инсулинорезистентностью (ИР), высоким уровнем антимюллерова гормона;
- фенотип B (классический NIH-фенотип) — ГА и олиго-/ановуляция;
- фенотип C (овуляторный) — ГА и поликистозная структура яичников по данным УЗИ;
- фенотип D (неандрогенный) — олиго-/ановуляция и поликистозная структура яичников по данным ультрасонографии [10].
Фенотип A, или полный СПКЯ, – самый распространенный из фенотипов (44,8%, 95%-й доверительный интервал (ДИ) 40,3–49,3); за ним следует фенотип D, называемый негиперандрогенным СПКЯ (19,5%); затем фенотип C, называемый овуляторным СПКЯ (16,2%); и фенотип B, представляющий собой фенотип A, но без поликистозной морфологии яичников (14,9%). По данным обзора, посвященного анализу динамики распространенности СПКЯ и частоты его фенотипов в Европе и США, был отмечен рост этих показателей, что, по крайней мере, отчасти связано с изменением диагностических критериев. Авторы пришли к выводу, что в целом частота СПКЯ примерно одинакова и в европейских странах, и в США. Однако в США, в отличие от Европы, чаще встречается фенотип A и реже – фенотип C [11].
Патогенез СПКЯ и связь с кардиометаболическими нарушениями
По данным одного из исследований, СПКЯ возникает в результате полигенной предрасположенности в сочетании с воздействием окружающей среды, которое может включать эпигенетические изменения и внутриутробное программирование [12].
Единой теории патогенеза СПКЯ не существует, его этиология еще до конца не изучена. В основе патогенеза нарушения фертильности у пациенток лежат причины гормонального характера: избыточное выделение лютеинизирующего гормона (ЛГ) передней доли гипофиза, стимулирующего образование мужских половых гормонов — тестостерона и андростерона, что приводит к появлению кист желтого тела [13].
Согласно результатам исследования Ya. Xu и соавт., СПКЯ — эндокринное заболевание, характеризующееся аномальным уровнем стероидных гормонов в периферической крови и некачественными яйцеклетками. Во время созревания фолликула в яичниках тека-клетки вырабатывают андрогены, которые затем проникают в гранулезные клетки, где андрогены превращаются в эстрогены, лимитирующим ферментом в этом процессе выступает ароматаза цитохрома Р450. Рецепторы эстрогена (estrogen receptor – ER) включают ERα, ERβ и мембранный рецептор GPR30. Аномальная экспрессия эстрогенов и их рецепторов, а также ферментов, связанных с синтезом эстрадиола, тесно связаны с СПКЯ [14].
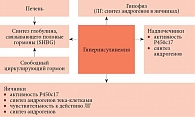
Причиной СПКЯ может быть запрограммированное нарушение выработки инсулина с формированием инсулинорезистентности (ИР). Инсулин способен стимулировать рост фолликулов, вырабатывающих андрогены (мужские половые гормоны) [15]. Таким образом, избыток инсулина снижает выработку глобулина. Инсулин влияет на стероидогенез, вызывает ингибиторную реакцию на белок SHBG (глобулин, связывающий половые гормоны) и провоцирует продукцию IGFBP-1 (белок-1, связывающий инсулиноподобный фактор роста). Уменьшение уровня SHBG приводит к повышению уровня свободного тестостерона, который вызывает ГА (акне, гирсутизм, аменорею и др.). Резистентность к инсулину служит фактором развития кардиометаболических нарушений (дислипидемии, гипертонии, абдоминального ожирения, предиабета/СД), что повышает риск ССЗ у женщин [16]. Патогенез СПКЯ, согласно инсулиновой теории, представлен на рисунке. Однако современное понимание патофизиологии метаболических заболеваний, ассоциированных с СПКЯ, остается неполным, и используемые для лечения метаболических осложнений этого синдрома терапевтические стратегии по-прежнему ограниченны.
В исследовании M.A. Sanchez-Garrido и соавт. сделан вывод, что избыток андрогенов играет важную роль в развитии метаболических нарушений, связанных с СПКЯ, таких как метаболический синдром (МС) и ожирение, оказывая заметное воздействие на жировую ткань, печень, поджелудочную железу и мышцы, и, что особенно важно, на головной мозг [17].
МС в сочетании с ожирением и СПКЯ связан с овуляторной дисфункцией, нарушениями менструального цикла, повышенной частотой самопроизвольного прерывания беременности, преэклампсией [18]. МС представляет собой симптомокомплекс, сочетающий в себе абдоминальное ожирение, ИР, гипергликемию, дислипидемию и артериальную гипертензию (АГ) [19]. Риск МС увеличивается с момента прекращения выработки яичниками стероидных гормонов (менопауза), что в свою очередь связано с относительным избытком андрогенов и абсолютным дефицитом эстрогенов [20]. Таким образом, женщины с СПКЯ входят в группу риска развития МС.
Женщины с СПКЯ-ассоциированным ожирением имеют более высокий риск осложнений беременности (включая гестационный СД, преждевременные роды и преэклампсию) [21]. При планировании беременности этим пациенткам рекомендуется провести предварительную оценку индекса массы тела (ИМТ), измерение артериального давления и пероральный глюкозотолерантный тест.
Проявления МС при СПКЯ также связаны с развитием дислипидемии. Так, по данным N. Patel и соавт., патофизиология дислипидемии различается у мужчин и женщин, а также меняется в течение жизни женщин. В то время как повышенный уровень липидов или липидный дисбаланс чаще встречаются у женщин в постменопаузе старше 50 лет, такое состояние, как СПКЯ, наблюдаемое у молодых женщин, повышает риск развития ССЗ [22].
Факторы риска развития СПКЯ
Причины, способствующие возникновению СПКЯ до конца не изучены, но, несомненно, этому заболеванию способствуют определенные ФР.
Генетические мутации (ключевые гены представлены генами, контролирующими метаболические процессы обмена глюкозы, состояния гиперинсулинемии и ИР, а также генами, отвечающими за синтез стероидных гормонов и индивидуальную чувствительность тканей к андрогенам; изменения в структуре этих генов могут вызвать ряд симптомов, характерных для СПКЯ [23].
Психические расстройства (которые могут привести к попыткам самоубийства), по данным исследования T. Hsu и соавт., риск суицида был в 8,7 раза выше у женщин с СПКЯ и психическими заболеваниями, чем без данного диагноза [24].
Курение матери во время беременности (по данным ученых из Швеции, риск развития СПКЯ возрастал у дочерей, чьи матери во время беременности выкуривали 10 и более сигарет в день) [25].
Ожирение (МС в сочетании с ожирением и СПКЯ связан с овуляторной дисфункцией, нарушением МЦ, снижением эффективности лечения бесплодия и индукции овуляции, повышенной частотой самопроизвольного прерывания беременности [26]), доля женщин с ожирением среди больных с СПКЯ разнится: например, в Англии у 90% женщин с СПКЯ ИМТ > 25 кг/м2, в Австралии – у 76%, в США – у 61%, а в Китае только 20% пациенток имеют ожирение [27].
Гормональный дисбаланс (высокий уровень тестостерона или его умеренное повышение при функциональной яичниковой ГА у женщин репродуктивного возраста и при снижении эстрогенпродуцирующей функции яичников у женщин в пери- и постменопаузе ассоциированы с повышением риска МС) [28].
ФР возникновения СПКЯ, несмотря на его высокую распространенность, до сих пор изучены недостаточно. В когортном исследовании Christ J.P. и соавт. попытались выявить факторы, предшествующие формированию СПКЯ [29]. Авторы провели сравнительный анализ «случай – контроль» с участием пациентов, зарегистрированных в клинике Kaiser Permanente в Вашингтоне с 2006 по 2019 г. Потенциальные ФР, предшествовавшие постановке диагноза, включали наличие СПКЯ в семейном анамнезе, преждевременное менархе, количество беременностей, расовую принадлежность, увеличение веса, ожирение, прием вальпроатов, МС, эпилепсию, предиабет и СД 1 и 2 типов. Пациенты с СПКЯ по сравнению с пациентами без СПКЯ чаще были нерожавшими (70,9% против 62,4%), а за три года до начала исследования чаще страдали ожирением (53,8% против 20,7%), МС (14,5% против 4,3%), предиабетом (7,4% против 1,6%) и СД 2 типа (4,1% против 1,7%) (р < 0,001 для всех сравнений).
Таким образом, можно сделать вывод, что факторы риска СПКЯ не только влияют на здоровье сердечно-сосудистой системы, но и связаны с риском развития других заболеваний, в первую очередь метаболических нарушений.
Причинно-следственная связь СПКЯ с ССЗ и СД 2 типа
Женщины с СПКЯ имеют повышенный риск нарушений психического здоровья, осложнений беременности, возникновения ССЗ и СД.
Риск развития СД 2 типа связан с ИР – основным патогенетическим механизмом развития СД [30]. По данным Американской диабетической ассоциации, из-за ИР поджелудочная железа вырабатывает избыточное количество инсулина, при этом повышается его концентрация в крови [31]. Высокое содержание инсулина способствует более активному синтезу андрогенов и приводит к нарушению овуляции. Согласно результатам более поздних исследований, женщины с поликистозной формой яичников и постоянной ановуляцией являются единственными, кто подвержен ИР. Таким образом, ИР является отличительной характеристикой этого состояния [32].
Авторы из Великобритании утверждают, что у женщин с СПКЯ вероятность развития диабета в 3–5 раз выше, чем у здоровых [33]. В обзорном метаанализе отметили, что общая распространенность СПКЯ у женщин с СД 2 типа составляет приблизительно 21%. Самый высокий уровень заболеваемости СПКЯ у женщин с СД 2 типа был в Океании, более низкий – в Европе и Азии, ниже всего – в Северной Америке [34]. По данным другого метаанализа, при СПКЯ нет безусловного риска развития СД 2 типа: он возникает в результате либо ожирения, либо ГА [35].
Q. Liu и соавт. пытались понять причину, лежащую в основе нарушений метаболизма глюкозы, СД 2 типа и СПКЯ, которая не связана с ИМТ и остается неясной в наблюдательных исследованиях. Они обнаружили генетическую связь между этими нарушениями, обусловленную как биологической плейотропией, так и некоторыми другими причинами, не соотносящимися с ИМТ [36].
Было доказано, что СПКЯ ассоциируется с более высоким риском развития ССЗ: ишемической болезни сердца, заболеваний периферических артерий, аритмии, сердечной недостаточности, артериальной гипертензии, а также ишемического инсульта и инфаркта миокарда. По результатам метаанализа Z. Wan и соавт. установлено, что женщины в возрасте от 10 до 54 лет с СПКЯ сталкиваются с увеличением риска ССЗ в 1,37 раза по сравнению с теми, у кого нет этого синдрома. В глобальном масштабе примерно 0,85% новых случаев ССЗ в 2019 г. были связаны с СПКЯ, что соответствует более чем двукратному увеличению случаев ССЗ, связанных с СПКЯ, с 1990 г. [37].
Также имеются данные о том, что пациенты с СПКЯ подвержены более высокому риску CCЗ, атеросклероза и АГ. Многие факторы, участвующие в окислительном стрессе, воспалении и тромбозе, были предложены в качестве маркеров сердечно-сосудистого риска, показывающих повреждение эндотелиальных клеток при СПКЯ. К этим маркерам относят асимметричный диметиларгинин (АДМА), С-реактивный белок (СРБ), гомоцистеин, ингибитор активатора плазминогена I (PAI-I), активность PAI-I, фактор роста эндотелия сосудов и т.д. [38].
В исследовании C. Meun и соавт. было доказано, что среди 200 женщин среднего возраста АГ была более распространена у женщин с СПКЯ по сравнению с женщинами того же возраста из контрольных групп [39]. Sun D. и соавт. провели метаанализ и выяснили, что СПКЯ способствует развитию атеросклероза, приводя к функциональным и структурным изменениям его предикторов: толщины интима-медиа сонной артерии; вазодилатации, опосредованной потоком; вазодилатации, опосредованной нитроглицерином; скорости распространения пульсовой волны и количества кальция в коронарных артериях [40]. O. Osibogun и соавт. пришли к выводу, что у женщин с СПКЯ чаще повышены уровень кальция в коронарных артериях, СРБ, толщина интима-медиа сонных артерий и более выражена эндотелиальная дисфункция [41]. T.R. Berni и соавт. в исследовании 2021 г. стремились установить риск возникновения ИМ, стенокардии и реваскуляризации и доказали, что у молодых женщин с СПКЯ этот риск возрастает [42].
Таким образом, по данным исследований последних девяти лет, установлен бóльший риск возникновения сердечно-сосудистых событий у женщин с СПКЯ по сравнению с женщинами без этого диагноза, однако требуются дальнейшие исследования для более глубокого изучения этого вопроса.
Лечение женщин с СПКЯ и профилактика ССЗ
Изменение образа жизни, включая диету, физические упражнения и модификацию поведения, снижают выраженность метаболической дисфункции и улучшают репродуктивное здоровье у пациенток с СПКЯ, особенно у женщин с ожирением. Модификация образа жизни признана в качестве основного метода лечения СПКЯ, особенно у пациентов с сопутствующим ожирением [43].
В статье A. Woodward и соавт. изучено влияние физических упражнений на репродуктивную функцию у женщин с СПКЯ: результаты нескольких исследований указывают на улучшение частоты менструаций и/или овуляций после занятий спортом [44]. Механизм, с помощью которого физические упражнения снижают ФР ССЗ и восстанавливают репродуктивную функцию, связан с улучшением чувствительности тканей к инсулину и снижением гиперинсулинемии.
Помимо кардиометаболических и репродуктивных осложнений, СПКЯ ассоциируется с увеличением распространенности психических расстройств. Физические упражнения улучшают психическое здоровье женщин с СПКЯ, что зависит от определенных физиологических факторов [45]. Согласно рекомендациям по лечению СПКЯ, физическая активность средней интенсивности у взрослых 18–64 лет должна составлять не менее 150 минут в неделю. Фактические данные подтверждают, что эти рекомендации должны быть в основе любого назначения врача [46].
В исследовании с участием авторов из Китая было показано, что ряд диетических схем (средиземноморская и кетогенная диеты, диетические подходы к остановке гипертензии – Dietary Approaches to Stop Hypertension DASH – и др.) способствуют снижению массы тела и ИР и улучшению репродуктивной функции [47].
Для снижения массы тела и поддержания здоровья, профилактики ССЗ пациенткам с СПКЯ рекомендовано:
- проводить регулярный контроль массы тела;
- обследоваться на наличие факторов сердечно-сосудистого риска и общего риска ССЗ [48];
- соблюдать принципы рационального питания и дозированных физических нагрузок в течение продолжительного периода.
Значительную часть в лечении СПКЯ занимает фармакотерапия (таблица). При развитии СД 2 типа на фоне поликистоза яичников назначают сахароснижающие препараты. Метформин показан при высоком риске ССЗ, он снижает ИР, резистентность тканей к лептину у беременных женщин с СПКЯ и уменьшает риск увеличения массы тела [49]. Наряду с метформином в фармакотерапии пациенток с СПКЯ и ИМТ ≥ 30 кг/м2 используют лираглутид, имеющий официальные показания к лечению ожирения в таких случаях [50].
Терапию статинами необходимо применять у женщин с СПКЯ с повышенным риском ССЗ атеросклеротического генеза. Если степень риска ССЗ неизвестна, диагностика субклинического атеросклероза (наличие бляшек в сонной артерии или кальция в коронарной артерии) может быть полезна для совместного принятия решения о начале лечения статинами. Другие препараты, например агонисты рецепторов глюкагоноподобного пептида 1 (ГПП-1), используют для снижения риска ССЗ у инсулинорезистентных групп [50].
Для лечения бесплодия требуется модификация образа жизни в сочетании со стимулирующими овуляцию препаратами, такими как кломифена цитрат или ингибитор ароматазы (летрозол), а при резистентности к инсулину и гиперандрогенных состояниях необходимо назначение сенсибилизаторов инсулина и антиандрогенов отдельно или в комбинации. Несомненный интерес вызывает механизм действия этих препаратов. Кломифена цитрат имеет способность связываться с рецепторами эстрогенов на всех уровнях [51]. Летрозол в свою очередь оказывает антиэстрогенное действие, хотя его эффект опосредуется не за счет блокады эстрогеновых рецепторов, а за счет ингибирования синтеза ароматазы и снижения конверсии андрогенов в эстрогены [52]. При СПКЯ были опробованы и более новые сенсибилизаторы инсулина: мио-инозитолы, агонисты ГПП-1, ингибиторы ДПП-4 и НГЛТ-2 [53].
S. Zhang и соавт. рассмотрели инновационный метод лечения СПКЯ и связанных с ним сопутствующих заболеваний, направленный на парасимпатическую модуляцию. Он основан на неинвазивной чрескожной стимуляции ушного блуждающего нерва (ta-VNS) [54]. Лечение СПКЯ осуществляется с помощью регуляции энергетического обмена путем двунаправленной блуждающей сигнализации. При этом снижается ИР благодаря противодиабетическому эффекту, активируются противовоспалительные механизмы, восстанавливается гомеостаз оси микробиота–кишечник–мозг и симпато-вагусный баланс для улучшения исходов ССЗ, нивелируются психические расстройства. Это безопасная клиническая процедура, и она может стать многообещающим методом лечения в дополнение к уже существующим методикам.
Заключение
СПКЯ тесно связан с нарушениями гормонального фона, вследствие которых могут развиваться ССЗ. В связи с этим профилактика и лечение СПКЯ носит комплексный характер. В первую очередь необходимо изменить образ жизни, но для достижения целевых показателей требуется дополнительная медикаментозная терапия. С учетом распространенности и ряда осложнений СПКЯ, приводящих к заболеваниям сердца, данный синдром можно рассматривать в качестве мишени для первичной профилактики ССЗ. Наряду с этим избыток инсулина в крови у женщин с СПКЯ может стать причиной ожирения и СД 2 типа, поэтому профилактика и лечение СПКЯ могут играть значительную роль в предупреждении СД 2 типа.
Таким образом, наши результаты показывают, что СПКЯ может повлиять на исход различных заболеваний, в числе которых кардиометаболические нарушения и ССЗ.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
E.A. Savchuk, M.N. Mamedov, Kh.R. Akhundova, T.V. Mekhdiev
National Medical Research Center for Therapy and Preventive Medicine
Russian Medical Academy of Continuing Professional Education
Multidisciplinary clinic ‘Alliance’, Sheki, Azerbaijan
Contact person: Elizaveta A. Savchuk, draftasvir@mail.ru
Polycystic ovary syndrome (PCOS) is one of the most common endocrinopathies among women of reproductive age, which is associated with the development of insulin resistance, type 2 diabetes mellitus, and diseases of the cardiovascular system.
The article presents various phenotypes of PCOS, provides data on the pathogenesis, epidemiology, risk factors, prevention and treatment of PCOS. The analysis of modern research data confirming the link between PCOS and cardiometabolic diseases is carried out. Prevention and treatment of PCOS can play a significant role in the prevention of cardiovascular diseases and type 2 diabetes. PCOS therapy is primarily aimed at lifestyle changes, but additional medication is necessary to achieve the desired results.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.