Эффективность аутоцитокинов, глутаргина и вихревого импульсного магнитного поля у пациентов с хроническим панкреатитом
- Аннотация
- Статья
- Ссылки
- English
Цель – изучить эффективность аутоцитокинов, глутаргина и вихревого импульсного магнитного поля у больных хроническим панкреатитом.
Материал и методы. 59 больных хроническим панкреатитом были случайным образом распределены на две группы. Первую (основную) составили 34 пациента, вторую (группу сравнения) – 25 пациентов. В контрольную группу вошли 20 здоровых добровольцев. Были проведены общеклинические и инструментальные обследования. У всех участников исследования оценивались биохимические, иммунологические показатели. Все больные получали традиционную терапию. В основной группе дополнительно применяли аутологичные цитокины, глутаргин и вихревое импульсное магнитное поле.
Результаты. После лечения клиническое улучшение (снижение выраженности болевого синдрома, диспепсических проявлений, частоты стула) в первой (основной) группе отмечалось раньше, чем во второй (группе сравнения). В первой группе наблюдалось достоверное снижение трансформирующего фактора роста бета-1 и уровня литостатина (REG-1-альфа), который является основной составляющей панкреатических камней. Зафиксированы нормализация активности амилазы, липазы, трипсина и фосфолипазы А, существенное снижение продуктов перекисного окисления липидов и активация антиоксидантной защиты, улучшение качества жизни больных. Хорошие и удовлетворительные результаты зарегистрированы у 94,1% пациентов основной группы, что в 1,2 раза выше аналогичного показателя в группе сравнения.
Заключение. Применение аутоцитокинов, глутаргина и вихревого импульсного магнитного поля в лечении больных хроническим панкреатитом способствует снижению уровня цитокинов, продуктов перекисного окисления липидов, активации антиоксидантной защиты, нормализации уровня ферментов и улучшению качества жизни больных.
Цель – изучить эффективность аутоцитокинов, глутаргина и вихревого импульсного магнитного поля у больных хроническим панкреатитом.
Материал и методы. 59 больных хроническим панкреатитом были случайным образом распределены на две группы. Первую (основную) составили 34 пациента, вторую (группу сравнения) – 25 пациентов. В контрольную группу вошли 20 здоровых добровольцев. Были проведены общеклинические и инструментальные обследования. У всех участников исследования оценивались биохимические, иммунологические показатели. Все больные получали традиционную терапию. В основной группе дополнительно применяли аутологичные цитокины, глутаргин и вихревое импульсное магнитное поле.
Результаты. После лечения клиническое улучшение (снижение выраженности болевого синдрома, диспепсических проявлений, частоты стула) в первой (основной) группе отмечалось раньше, чем во второй (группе сравнения). В первой группе наблюдалось достоверное снижение трансформирующего фактора роста бета-1 и уровня литостатина (REG-1-альфа), который является основной составляющей панкреатических камней. Зафиксированы нормализация активности амилазы, липазы, трипсина и фосфолипазы А, существенное снижение продуктов перекисного окисления липидов и активация антиоксидантной защиты, улучшение качества жизни больных. Хорошие и удовлетворительные результаты зарегистрированы у 94,1% пациентов основной группы, что в 1,2 раза выше аналогичного показателя в группе сравнения.
Заключение. Применение аутоцитокинов, глутаргина и вихревого импульсного магнитного поля в лечении больных хроническим панкреатитом способствует снижению уровня цитокинов, продуктов перекисного окисления липидов, активации антиоксидантной защиты, нормализации уровня ферментов и улучшению качества жизни больных.



Хронический панкреатит (ХП) – заболевание, характеризующееся длительным течением, тяжелыми осложнениями, широкой распространенностью среди разных групп населения и имеющее высокую социальную значимость [1–5]. Специфическое лечение ХП отсутствует, а консервативное направлено на купирование обострений, хронического болевого синдрома, коррекцию экзокринной/эндокринной недостаточности поджелудочной железы (ПЖ), обменных нарушений и осложнений [6–9]. Медикаментозные средства применяются при выраженном болевом синдроме, характерном для данного заболевания [5, 10–12].
В основе лечения ХП на ранних стадиях лежит механизм прерывания на молекулярно-клеточном уровне активации фибробластов провоспалительными цитокинами острофазового ответа (фактор роста тромбоцитов (platelet-derived growth factor, PDGF), трансформирующий фактор роста бета-1 (transforming growth factor beta 1, TGF-бета-1), интерлейкины (ИЛ) 1 и 6, фактор некроза опухоли (ФНО) альфа) и их трансформации в миофибробласты, а также поступательного накопления во внеклеточном матриксе коллагенов, экспрессия которых свидетельствует о формировании необратимых склеротических изменений железы [13].
Важную роль в патогенезе ХП, как и в любом воспалительном процессе, играют провоспалительные (ИЛ-1, 6, 8, ФНО-альфа, фактор активации тромбоцитов) и противовоспалительные цитокины (ИЛ-10, антагонист рецепторов ИЛ-1 и др.) [14–17]. При дисбалансе про- и противовоспалительных медиаторов, а точнее преобладании первых, воспаление усиливается. Риск осложнений заболевания возрастает, поскольку медиаторы воспаления вызывают как местные, так и системные эффекты.
Одним из методов регуляции дисбаланса иммунной системы и воздействия на цитокиновую сеть считается метод аутоцитокинотерапии [18, 19]. Аутоцитокины действуют по сетевому принципу, их иммунокорригирующее действие направлено на клетки, участвующие в воспалении, регенерации и развитии иммунного ответа. Применение композиции цитокинов, секретируемых мононуклеарными клетками периферической крови больного, позволяет избежать развития побочных токсических и аллергических эффектов [18]. На сегодняшний день накоплен опыт по использованию эндогенных иммуномодуляторов в составе лечебных схем в онкологии, гематологии, гинекологии, гастроэнтерологии, офтальмологии [16, 20, 21].
Цель исследования – изучить эффективность аутоцитокинов, глутаргина и вихревого импульсного магнитного поля в лечении больных хроническим панкреатитом.
Материал и методы
В клинике государственного учреждения «Институт гастроэнтерологии НАМН Украины» с октября 2011 г. по август 2012 г. стационарное лечение получили 59 пациентов (64,4% мужчин и 35,6% женщин) с хроническим панкреатитом, случайным образом разделенных на две группы. Первую (основную) группу составили 34 пациента, вторую (группу сравнения) – 25 пациентов. В контрольную группу вошли 20 здоровых добровольцев. Больные прошли обследование, включавшее сбор жалоб, анамнеза, физикальных данных, выявление сопутствующих заболеваний. Кроме того, были проведены общеклинические анализы крови и мочи, биохимический анализ крови, исследование сыворотки крови для определения ферментативной активности ПЖ (амилаза, липаза, фосфолипаза А). Определены уровни гликозилированного гемоглобина (GHb), гиалуроновой кислоты [22], показатели перекисного окисления липидов (ПОЛ), антиоксидантной защиты (АОЗ) [23, 24], содержание гексозаминов [22], оксипролина белковосвязанного (ОПбсв) [25], молекулы средней массы (МСМ) [26]. Выполнены иммунологические (иммуноферментный анализ с применением наборов «Вектор Бест» (г. Новосибирск) для определения в крови уровней ИЛ, ФНО-альфа, TGF-бета-1, REG-1-альфа, лактоферрина) и инструментальные исследования (ультразвуковые, гастроскопия, эндоскопическая ретроградная холангиопанкреатография, рентгенография, компьютерная томография органов брюшной полости с болюсным усилением). После установления диагноза проводилась патогенетическая и симптоматическая терапия, согласно принятым стандартам [7]. Результаты лечения оценивались по завершении 12-месячного наблюдения за больными.
Комплекс лечебных мероприятий был направлен на решение нескольких задач:
- исключение провоцирующих факторов (алкоголь, лекарственные средства, обструкция);
- снижение выраженности болевого синдрома;
- коррекция экзо- и эндокринной недостаточности;
- терапия сопутствующих расстройств.
Поэтапное лечение ХП в зависимости от степени выраженности болевого абдоминального синдрома предусматривало диету (дробное питание, жиры менее 60 г/сут), использование панкреатических ферментов (по 25–40 тыс. ед. липазы на основной прием пищи и 10 тыс. ед. липазы – на промежуточный), H2-блокаторов рецепторов гистамина или ингибиторов протонной помпы, ненаркотических анальгетиков (ацетилсалициловая кислота, диклофенак, ибупрофен, пироксикам), октреотида (сандостатин). С целью коррекции питательной недостаточности назначали среднецепочечные триглицериды (трисорбон), жирорастворимые витамины A, D, E, K.
Для нормализации уровня провоспалительных и профиброзных цитокинов и коррекции состояния иммунной системы применяли аутоцитокинотерапию. Больным трехкратно (через день) вводили подкожно в 5–7 точек в области плеча в дозе 1,5–3 мл (0,3–0,4 мл в каждую точку) аутоцитокины, полученные каскадной стимуляцией. Курс аутоцитокинотерапии назначали на 14–16-й день пребывания в клинике (в подостром периоде заболевания). Сеансы проводили с интервалами 3–5 дней. Доза аутоцитокинов составила 100 мкг/мл [18, 20].
Для ограничения оксидативного стресса и снижения уровня продуктов ПОЛ, улучшения состояния системы АОЗ больным ХП назначали глутаргин (аргинина глутамат) по три таблетки (0,75 г) три раза в сутки 15–21 день.
Для купирования хронического болевого синдрома применяли вихревое импульсное магнитное поле (ВИМП) на проекцию ПЖ и биологически активные точки по 5–15 минут курсом 10–15 сеансов. ВИМП обладает способностью активизировать защитные механизмы организма за счет улучшения микроциркуляции, нормализации реологических свойств крови, биохимических показателей и иммунной системы, скорости передачи нервных импульсов. ВИМП применяли через 8–10 дней от начала лечения (в периоде затухающего обострения). Продолжительность лечения – три-четыре недели до полной нормализации клинических данных, снижения уровня показателей воспаления, исчезновения нейтрального жира, крахмала и мышечных волокон в кале.
Исходя из оценки клинико-лабораторных показателей полученные результаты лечения были интерпретированы следующим образом:
- хорошие: высокая степень эффективности лечения. У пациентов отсутствовали какие-либо симптомы, связанные с патологией ПЖ. Отмечались улучшение общего состояния, исчезновение болевого синдрома, нормализация уровня лабораторных показателей, повышение массы тела > 8 кг;
- удовлетворительные: средняя степень эффективности лечения. Имели место слабо выраженные симптомы, которые поддавались консервативному лечению, не требовали применения инвазивных методов диагностики и лечения (улучшение общего состояния пациентов, эпизодическое повышение показателей ферментативной функции, редкая, слабой интенсивности боль в проекции ПЖ, незначительное увеличение массы тела (2–3 кг));
- плохие: низкая степень эффективности лечения (требовалось применение инвазивных методов диагностики и лечения). Наблюдались незначительное улучшение состояния больных, стойкий болевой синдром, прогрессирование экзо- и эндокринной недостаточности ПЖ, явления портальной гипертензии.
Результаты и их обсуждение
После лечения в первой (основной) группе хороших результатов достигли 25 (73,5%) больных, удовлетворительных – семь (20,6%). Плохие результаты имели место в двух (5,8%) случаях. Во второй группе (группе сравнения) результаты лечения были достоверно (р < 0,05) ниже: хорошие результаты наблюдались у 12 (48,0%) пациентов, удовлетворительные – у семи (28,0%). Плохие результаты, свидетельствовавшие о низкой степени эффективности лечения, зафиксированы в шести (24,0%) случаях. Итак, в основной группе хороших и удовлетворительных результатов достигли 94,1% больных. Этот показатель в 1,2 раза превысил аналогичный показатель в группе сравнения. Плохие результаты в группе сравнения встречались в 4,1 раза чаще, чем в основной.
На фоне лечения у большинства пациентов основной группы наблюдалась положительная динамика клинической картины. Болевой синдром купировался в среднем на 4–6 дней раньше, чем в группе сравнения. Диспепсический синдром у больных основной группы уменьшился в среднем через восемь дней, в группе сравнения – через 10–12 дней. Частота стула нормализовалась через 11–13 дней от начала лечения в первой группе и через 17–19 дней – во второй. Хороший клинический результат лечения сопровождался улучшением показателей иммунной системы, биохимических показателей и качества жизни больных.
Анализ динамики изменений иммунных показателей после проведенного лечения продемонстрировал положительные изменения уровня цитокинов, ответственных за активацию звездчатых клеток ПЖ, регуляцию фиброзо- и камнеобразования. Так, при анализе этих показателей у больных через год после лечения установлено достоверное снижение содержания лактоферрина в сыворотке крови с 17458,35 ± 846,91 до 7167,68 ± 1599,15 нг/мл (р < 0,001), литостатина (REG-1-альфа) – с 2143,17 ± 87,29 до 1179,83 ± 99,51 пг/мл (р < 0,001), TGF-бета-1 – с 39,34 ± 8,05 до 22,12 ± 3,37 нг/мл (р < 0,05). Уровень эластазы кала достоверно увеличился с 156,5 ± 12,73 до 198,6 ± 11,39 мкг/г (р < 0,05) и у 75% пациентов был в пределах нормы.
У пациентов основной группы эти изменения происходили на фоне улучшения всех звеньев иммунитета: гуморального, клеточного, регуляторного. Так, у всех больных основной группы после лечения абсолютное число CD3+ нормализовалось и достигло 0,84 ± 0,09 × 109/л (исходно – 0,95 ± 0,08 × 109/л), в контрольной группе – 0,76 ± 0,04 × 109/л (р < 0,05). Достоверно увеличилось относительное количество CD4+ – с 28,38 ± 1,73 до 36,08 ± 0,87%, в контрольной группе – 38,71 ± 0,52% (р < 0,05). Отмечалось достоверное снижение относительного количества CD8+ с 26,46 ± 1,75 до 18,05 ± 1,32% (р < 0,05). После лечения этот уровень не отличался от аналогичного показателя контрольной группы – 18,39 ± 0,57%. Данные изменения привели к восстановлению иммунорегуляторного индекса CD4+/CD8+ с 1,56 ± 0,12 до 1,89 ± 0,23, который после лечения не отличался от показателя контрольной группы – 1,97 ± 0,07 (p > 0,05). Повышенный уровень CD19+ 21,34 ± 1,64% у 41,6% пациентов основной группы после лечения снизился до 15,67 ± 1,70% (р < 0,05), что привело к нормализации данного показателя (в контрольной группе – 14,78 ± 0,48%). В основной группе после лечения отмечалась нормализация уровня НСТ (показателя активности фагоцитов) (снижение с 19,82 ± 3,26 до 12,56 ± 2,35) и циркулирующих иммунных комплексов (ЦИК) (с 6,94 ± 0,28 до 2,99 ± 0,31 ед. опт. плот.; р < 0,05). Это свидетельствовало о нормализации функциональной активности нейтрофилов и фагоцитарного звена иммунитета.
В отличие от основной группы в группе сравнения позитивных изменений всех звеньев иммунитета не зафиксировано. Отмечалась нормализация относительного количества СД19+ – снижение с 21,09 ± 1,72 до 16,3 ± 1,49%, в контрольной группе – 14,78 ± 0,48% и уровня ЦИК – с 6,76 ± 0,31 до 4,02 ± 1,08 ед. опт. плот., в контрольной группе – 3,42 ± 0,23 ед. опт. плот. (р < 0,05). Другие показатели достоверно после лечения не изменились. Главное – не отмечалось положительных изменений в восстановлении иммунорегуляции.
О положительном эффекте лечения свидетельствовали также изменения биохимических показателей сыворотки крови, анализ которых после лечения проводили исходя из оценки процессов фиброза, холестаза, липидного обмена, эндотоксемии. Показатель развития эндотоксемии (МСМ), который был достоверно повышен у больных первой и второй групп по сравнению с пациентами контрольной группы, после лечения снизился в 1,54 раза – с 760,44 ± 46,31 до 493,18 ± 30,87 мг/л в первой группе (р < 0,001) и существенно не изменился во второй: до лечения – 617,47 ± 35,15, после лечения – 643,75 ± 129,15 мг/л. В контрольной группе этот показатель составил 445,60 ± 18,20 мг/л. Содержание общих липидов и холестерина после лечения осталось приблизительно на том же уровне. Это указывало на нарушение расщепления липидов и их последующего всасывания в кишечнике по панкреатогенному типу. Общее количество триглицеридов и бета-липопротеидов у больных после лечения существенно не отличалось от аналогичного показателя у пациентов контрольной группы.
После лечения наблюдалось снижение уровней ОПбсв у больных первой группы в 1,15 раза – с 184,97 ± 7,84 до 159,74 ± 6,51 мкмоль/л (контрольная группа –136,04 ± 4,30 мкмоль/л) (р < 0,01) и гексозаминов до 6,63 ± 0,42 ммоль/л (р < 0,05). При сравнении этих показателей за период до и после лечения у пациентов второй группы существенных изменений не зафиксировано. Явления холестаза подтверждались повышением у больных обеих групп х-липопротеидов в 1,63 и 1,3 раза соответственно при неизмененном содержании желчных кислот. Активность гамма-глутамилтранспептидазы у пациентов обеих групп до лечения имела тенденцию к повышению, а в отдаленном периоде после лечения наблюдалось постепенное ее снижение по сравнению с предыдущими показателями (р > 0,05).
Согласно анализу динамики показателей системы «ПОЛ – АОЗ» до и после лечения (табл. 1), у больных первой группы после лечения существенно снизилась концентрация субстратов ПОЛ в гептановой фазе по сравнению с периодом до лечения (p < 0,05). Оксодиеновые конъюгаты в гептановой фракции в обеих группах после лечения не обнаружены (по сравнению с периодом до лечения). Характерным считалось отсутствие оснований Шиффа в обеих фазах. Наблюдалась тенденция к снижению концентрации продуктов ПОЛ – малонового диальдегида (МДА) в обеих группах после лечения.
При рассмотрении системы АОЗ после лечения в первой группе активность супероксиддисмутазы была снижена (p < 0,05), а во второй на 53,0% повышена в отличие от показателей до лечения. При этом в первой группе активность каталазы достигла границ физиологической нормы, а во второй возросла на 32,2%.
При анализе ферментативной активности ПЖ после лечения выявлено достоверное снижение активности альфа-амилазы в первой группе (p < 0,05). Во второй группе активность данного фермента также имела тенденцию к снижению (табл. 2). Активность липазы и трипсина снизилась в обеих группах. У больных второй группы в 1,4 раза уменьшилась активность фосфолипазы А. Накопление в крови глюкозы было более характерным для первой группы, где уровень GHb увеличился с 6,52 ± 0,84 до 7,17 ± 1,41 мкМ фру/ч Hb. Во второй группе отмечалось снижение концентрации этого показателя.
При анализе сонографических данных установлено, что после лечения у больных первой группы размеры ПЖ уменьшились за счет уменьшения головки (р < 0,002) (тело и хвост практически не изменились) (табл. 3). Диаметр главного панкреатического протока (ГПП) достоверно не изменился и оставался умеренно расширенным. Контуры ПЖ в 82,3% случаев были неровными и в 44,1% случаев нечеткими из-за фиброзных изменений, что подтверждалось повышением показателя относительной плотности паренхимы ПЖ.
У больных второй группы после лечения размеры ПЖ практически не изменились и приблизились к верхней границе нормы. Неровные и четкие контуры ПЖ свидетельствовали о фиброзе органа и отсутствии воспалительного процесса на момент исследования. Просвет ГПП достоверно уменьшился, что говорило о снижении внутрипротокового давления: 5,27 ± 1,23 мм через 3–6 месяцев после лечения и 4,38 ± 0,87 мм через шесть месяцев и более (р < 0,01).
После лечения качество жизни больных, согласно оценке по опроснику SF-36 и опроснику, разработанному нами, улучшилось. Достоверно увеличились показатели физического компонента здоровья – 52,3 ± 6,7 против 43,2 ± 8,4 балла до лечения (р < 0,05). Качество жизни по физическому компоненту улучшилось за счет достоверного увеличения показателя общего здоровья: 52,9 ± 3,5 против 46,2 ± 2,1 балла до лечения (р < 0,05). По другим шкалам (ролевое физическое функционирование, физическое функционирование, боль) отмечалась тенденция к улучшению качества жизни, но достоверных различий показателей не выявлено.
Показатель психологического компонента здоровья также достоверно увеличился – 57,5 ± 4,9 против 43,0 ± 3,7 балла до лечения (р < 0,05). Улучшение качества жизни по психологическому компоненту обусловлено достоверным улучшением показателей жизнеспособности, социального функционирования, психического здоровья: 57,0 ± 4,0 против 42,1 ± 2,6 балла до лечения (р < 0,05), 66,1 ± 4,5 против 48,0 ± 3,3 до лечения (р < 0,05), 63,2 ± 3,5 против 49,2 ± 2,8 балла до лечения (р < 0,05) соответственно. По шкале ролевого эмоционального функционирования отмечалась тенденция к улучшению качества жизни, но достоверных различий показателей не установлено.
Кроме того, мы проанализировали субъективную оценку больными уровня здоровья по сравнению с прошлым годом. Так, если до лечения уровень здоровья по сравнению с прошлым годом оценивался больными в среднем на 34,6 ± 3,9 балла, то после лечения он возрос в 2,1 раза – 74,1 ± 5,1 балла (р < 0,0001).
Специфический опросник, разработанный нами для оценки качества жизни при наличии ХП, включал вопросы о влиянии заболевания на качество жизни в целом и жалобах в частности (боль в левом подреберье, опоясывающая боль, вздутие живота и др.). Больные также самостоятельно оценивали, насколько им мешают жалобы, обусловленные ХП, в повседневной жизни, как эмоционально они воспринимают свою болезнь (ответы варьировались от «спокойного» отношения к «значительному эмоциональному беспокойству»).
Данные опроса показали положительную динамику. Так, значительно выраженная боль до лечения отмечалась у 27,5% опрошенных, умеренно выраженная – у 55,0%, незначительно выраженная – у 12,5%. После лечения умеренно выраженная боль имела место у 32,5% пациентов, незначительная – у 42,5%. Остальных пациентов боль не беспокоила. Аналогично значительно меньше после лечения беспокоили вздутие и урчание в животе.
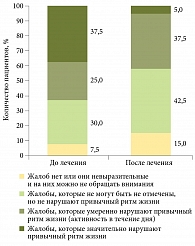
На рисунке показано, насколько жалобы больных ХП нарушали повседневный образ жизни и ухудшали ее качество. После лечения только 5,0% больных отмечали значительное негативное влияние заболевания на качество жизни (против 37,5% до начала лечения). Процент пациентов, у которых заболевание не ухудшало или незначительно ухудшало качество жизни, увеличился с 7,5 до 15,0 и с 30,0 до 42,5 соответственно. Невыраженные жалобы, на которые можно было не обращать внимания, отметили 32,5% пациентов до лечения против 52,4% после лечения. Умеренные жалобы и проявления ХП, которые не могли быть незамеченными, но не нарушали привычный ритм жизни, до лечения имели место в 35,0% случаев (против 42,5% после лечения). В то же время о проблемах и жалобах, которые значительно нарушали активность и ритм жизни в течение суток, говорили 32,5% респондентов до лечения и 5,0% после лечения.
Таким образом, на основании самооценки пациентов установлена положительная динамика в отношении влияния жалоб на повседневный образ жизни. Однако по эмоциональному восприятию пациентами заболевания ситуация улучшилась, но незначительно. Так, ХП эмоционально значительно беспокоил 12,5% пациентов до лечения против 10,0% после лечения, умеренно – 42,5 и 30,0%, слегка – 27,5 и 37,5% соответственно. 17,5% больных до лечения относились к заболеванию эмоционально спокойно. После лечения таких пациентов стало больше – 22,5%.
Заключение
Достигнутый в большинстве случаев положительный эффект доказывает, что лечение больных ХП должно быть комплексным. Воздействие на основные звенья патогенеза заболевания позволяет тормозить развитие фиброзных и других структурных изменений ПЖ.
Авторы статьи подтвердили отсутствие конфликта интересов и финансовой поддержки исследования, о которых необходимо сообщить.
N.B. Gubergrits, DM, Prof., Ye.A. Krylova, PhD, V.Ye. Kudryavtseva, PhD, A.I. Rudenko, PhD, V.A. Makarchuk, PhD
Donetsk National Medical University, Liman, Donetsk region, Ukraine
Endotehnomed, Dnipro, Ukraine
Pridneprovsk State Academy of Physical Culture and Sports, Dnipro, Ukraine
State Institute of Gastroenterology of the National Academy of Medical Sciences of Ukraine, Dnipro
Contact person: Yelena Aleksandrovna Krylova, lenkrlenkr@gmail.com
For effective treatment of chronic pancreatitis, it is necessary to influence the main pathogenesis in order to inhibit the development of fibrous and other structural changes in the pancreas.
Purpose of the study. To study the effectiveness of autocytokines, glutargin and vortex pulsed magnetic field in the treatment of patients with chronic pancreatitis.
Material and methods. 59 patients with chronic pancreatitis were examined. Patients underwent general clinical and instrumental examinations, evaluated biochemical, immunological parameters. The patients were randomly divided into 2 groups: 34 patients of the main group and 25 patients of the comparison group. All patients underwent therapy in accordance with the standards. In the main group, autocytokines, glutargin, and a vortex pulsed magnetic field were additionally used.
Results. After treatment in the main group of patients, clinical improvement (decrease in the severity of pain, dyspeptic manifestations, stool frequency) occurred earlier than in the control group. In the main group, a significant decrease in fibrosis activator TGF-1β and lithostatin (REG-1α), which is the main component of pancreatic stones, was observed. A normalization of the activity of amylase, lipase, trypsin and phospholipase A, a significant decrease in lipid peroxidation products and activation of antioxidant protection, an improvement in the quality of life of patients was noted. Good and satisfactory results in the main group of patients amounted to 94.1% and were 1.2 times higher than the comparison group.
Conclusion. The use of autocytokines, glutargin and vortex pulsed magnetic field in the treatment of patients with chronic pancreatitis helps to reduce the level of cytokines, lipid peroxidation products, activate antioxidant protection, normalize the level of enzymes and improve the quality of life of patients.
Key words: chronic pancreatitis, treatment, cytokines, quality of life
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.