Эффективность и безопасность различных доз гимекромона у больных, перенесших холецистэктомию
- Аннотация
- Статья
- Ссылки
- English




Введение
Желчнокаменная болезнь (ЖКБ) – это многофакторное и многостадийное заболевание, характеризующееся нарушением обмена холестерина и/или билирубина с образованием камней в желчном пузыре и/или желчных протоках [1]. Распространенность ЖКБ в мире высока с тенденцией к увеличению: конкременты в желчном пузыре выявляются у 10% населения, а частота увеличивается примерно в два раза каждые 10 лет [2]. В развитых странах распространенность ЖКБ варьирует на уровне 5–25% [3], однако лишь четверть пациентов отмечают клинические проявления [4]. По данным S.B. Kim и соавт., распространенность бессимптомного холецистолитиаза в западных странах, включая США и Европу, составляет 13–50%, в то время как в восточных странах, включая Корею, данный показатель значительно ниже – 2–11% [5]. В России распространенность холецистолитиаза также неуклонно растет и составляет 3–12%. Среди женщин данная патология выявляется в 1,8 раза чаще [6].
Лечение ЖКБ, в зависимости от стадии процесса, может быть консервативным и оперативным. Лапароскопическая холецистэктомия является золотым стандартом лечения желчнокаменной болезни и самой часто выполняемой операцией в мире и в России среди плановых хирургических вмешательств. Впервые холецистэктомия была выполнена немецким хирургом Карлом Лангенбухом 15 июля 1882 г. в клинике Лазаря в Берлине. В России данная операция была выполнена в 1889 г. польским хирургом Ю.Ф. Косинским [7]. После хирургического лечения большая часть пациентов отмечает уменьшение или купирование клинических проявлений, однако, по данным ряда авторов, симптомы могут сохраняться у 40% пациентов с той или иной степенью выраженности [3, 4].
Наличие симптомов после хирургического лечения свидетельствует о постхолецистэктомическом синдроме (ПХЭС) [8, 9]. ПХЭС – это совокупность функциональных и/или органических изменений билиарного тракта, возникающих после холецистэктомии на фоне сложных патофизиологических нарушений, имеющих место при ЖКБ, основными из которых являются печеночно-клеточная дисхолия и дискоординация сфинктерного аппарата билиарного тракта [1].
Совокупность симптомов ПХЭС наиболее часто представлена болевым синдромом (билиарной болью), диспепсией и диареей [10]. Наиболее часто они являются проявлением функциональных расстройств, обусловленных дисфункцией сфинктера Одди и нарушениями моторики кишечника [4]. Вместе с тем метаанализ работ, в которых оценивали происхождение отдаленных симптомов после холецистэктомии, показал, что в большинстве исследований (64 из 130) основной причиной их возникновения являлись различные сопутствующие патологии, не связанные с выполненной операцией (1–65%), а дисфункция сфинктера Одди встречалась в 3–40% (21 из 130 исследований) [11].
По мнению А.А. Ильченко, клинические проявления у больных, перенесших холецистэктомию, могут быть обусловлены четырьмя группами причин: во-первых, диагностическими ошибками при обследовании больного на дооперационном этапе и/или во время операции; во-вторых, техническими погрешностями во время операции; в-третьих, функциональными нарушениями, связанными с удалением желчного пузыря; в-четвертых, обострением или прогрессированием существовавших до операции заболеваний [1].
Эксперты Римского консенсуса IV предложили диагностические критерии билиарной боли [12].
Эпизоды боли в эпигастральной области/правом подреберье, включая все признаки:
- длительность ≥ 30 минут, стойкая боль;
- боль рецидивирует с разными интервалами (не ежедневно);
- боль нарушает активность пациента и/или требует обращения за неотложной медицинской помощью;
- отсутствие явной связи (< 20%) с моторикой кишечника;
- отсутствие существенного (< 20%) облегчения при изменении положения тела или приеме антацидов/антисекреторных средств.
Поддерживающие критерии:
- боль сопровождается тошнотой, рвотой;
- иррадиирует в спину, правую подлопаточную область;
- пробуждает ото сна.
При развитии болевого и диспепсического синдромов функциональной этиологии показано проведение консервативной терапии [4]. При развитии у пациента диареи вследствие синдрома избыточного бактериального роста в тонкой кишке показано применение кишечных антисептиков [13]. В терапии по поводу дисфункции сфинктера Одди применяют препараты со спазмолитическими свойствами [14]. Одним из препаратов, показанных для лечения больных с симптомами, обусловленными дисфункцией сфинктера Одди, является гимекромон, миотропный спазмолитик с преимущественным действием в отношении билиарного дерева и сфинктера Одди [15]. Согласно инструкции, гимекромон может назначаться в дозе 600–1200 мг в сутки. При этом в большинстве исследований применяли дозу 1200 мг в сутки [16]. Опубликованные данные свидетельствуют о преимуществах этой дозы [17].
Целью настоящего исследования явилось сравнение клинической эффективности препарата гимекромон (Одестон) в дозах 600 мг и 1200 мг в сутки у больных с холецистэктомией в анамнезе.
Материал и методы
В МКНЦ им. А.С. Логинова в 2020–2021 гг. проведено неинтервенционное проспективное наблюдательное исследование, в ходе которого пациенты с болевым синдромом и диспепсическими расстройствами, ранее перенесшие холецистэктомию, получали препарат гимекромон в дозе 600 или 1200 мг в сутки.
В исследование было включено 36 пациентов: двое мужчин, 34 женщины от 39 до 77 лет, средний возраст составил 59 лет. Холецистэктомия была выполнена по поводу ЖКБ. Средняя продолжительность послеоперационного периода составила девять лет. Все пациенты соответствовали критериям включения: отсутствие сопутствующей органической патологии в стадии обострения, беременности, гиперчувствительности к препарату.
Всего было осуществлено три визита: на первый, 21-й и 90-й дни.
Во время первого визита проводили сбор анамнеза, опрос пациентов методом анкетирования для оценки болевого и диспепсического синдромов. Кроме того, были выполнены клинический и биохимический анализы крови, общий анализ мочи, проведено ультразвуковое исследование органов брюшной полости с целью исключения органической патологии гепатобилиарной зоны как возможной причины болевого синдрома, а также определен диаметр общего желчного протока.
Форму стула оценивали по Бристольской шкале, которая включает семь его типов: 1-й и 2-й соответствуют запору (отдельные твердые комки, колбасовидный, но комковатый); 3-й и 4-й – нормальный стул (колбасовидный, гладкий и мягкий); 5, 6 и 7-й типы – диарея (пушистые рваные кусочки, водянистый, без твердых кусочков).
Для оценки интенсивности болевого синдрома в обеих группах использовали визуальную аналоговую шкалу (ВАШ). Оценку проводили по десятибалльной шкале, где 0–4 мм – нет боли; 5–44 мм – слабая боль; 45–74 мм – умеренная боль; 75–100 мм – сильная боль.
Для оценки билиарной боли и ее влияния на повседневную активность проводили тест RAPID (англ. Recurrent Abdominal Pain Intensity and Disability). Оценку влияния боли на повседневную активность проводили на первом и третьем визите. Выделяли четыре степени ограничения повседневной активности: степень I – 0–5 баллов, боль незначительная; степень II – 6–10 баллов, ограничение активности; степень III – 11–20 баллов, умеренное ограничение активности; степень IV – 21 и более баллов, выраженное ограничение активности.
Пациенты были рандомизированы в две группы: в первую группу были включены 18 пациентов, получавших препарат гимекромон (Одестон) в дозе 600 мг в сутки (200 мг три раза в день), во вторую – 18 человек, получавших дозу 1200 мг в сутки (400 мг три раза в день). Другие спазмолитики пациенты не принимали. Продолжительность терапии составила 21 день.
Во время второго визита (21-й день) были повторно выполнены клинический и биохимический анализы крови, общий анализ мочи, ультразвуковое исследование органов брюшной полости с определением диаметра общего желчного протока, интенсивность болевого синдрома оценивали по ВАШ.
Удовлетворенность терапией измеряли по пятибалльной шкале, где 1 – полностью удовлетворен; 2 – скорее удовлетворен; 3 – отсутствие как удовлетворенности, так и неудовлетворенности; 4 – скорее не удовлетворен; 5 – полностью не удовлетворен.
Третий визит осуществлялся дистанционно (по телефону): проводили оценку билиарной боли и ее влияния на повседневную активность при помощи опросника RAPID через 90 дней после первого визита.
Результаты
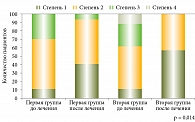
До начала терапии в первой группе пациентов боли испытывали 17 (94,4%) пациентов, во второй группе – 16 (94,1%). После проведенного лечения в обеих группах статистически значимо снизилось количество больных, испытывавших болевой синдром, с более значимой динамикой во второй группе (Chi2; p < 0,01) (рис. 1).
После проведенного лечения у всех пациентов второй группы не наблюдалось запора (исходно он был выявлен у шести больных), отмечена нормализация стула по Бристольской шкале (3-й и 4-й типы формы стула) (Chi2, p = 0,015). В первой группе достоверно значимых изменений выявлено не было.
Полученные данные о выраженном уменьшении болевого синдрома в обеих группах нашли отражение в статистически значимой динамике при оценке по ВАШ (критерий Уилкоксона; p < 0,01), при этом улучшение во второй группе было более выраженным (рис. 2).
При оценке удовлетворенности терапией по пятибалльной шкале были отмечены преимущества в группе больных, получавших гимекромон в дозе 1200 мг, среди которых 13 (81,3%) пациентов были полностью удовлетворены или скорее удовлетворены (рис. 3).
При анализе данных опросника RAPID до лечения и через 90 дней после лечения статистически достоверная динамика уменьшения болевого синдрома и его влияния на повседневную деятельность была выявлена только во второй группе (Chi2; p = 0,014) (рис. 4).
До начала терапии диаметр общего желчного протока в группах был сопоставим. После проведенного лечения отмечено его уменьшение в обеих группах, более выраженное во второй группе (критерий Уилкоксона; p = 0,05) (рис. 5).
Нежелательных эффектов при лечении препаратом выявлено не было. Приверженность терапии была высокая, отказов от продолжения лечения не зафиксировано.
Выводы
Большая эффективность в устранении клинических проявлений постхолецистэктомического синдрома, сохранявшаяся в течение трех месяцев после курса терапии, наблюдалась в группе пациентов, получавших Одестон (гимекромон) в дозе 1200 мг в сутки:
- отмечалось статистически значимое уменьшение доли пациентов, испытывавших болевой синдром, в группах больных, получавших гимекромон в дозе 600 мг и 1200 мг в сутки (Chi2; p < 0,01), более выраженное во второй группе;
- снижение выраженности болевого синдрома по ВАШ (критерий Уилкоксона; p < 0,01) отмечено в обеих группах, но более выражено у пациентов, принимавших гимекромон в дозе 1200 мг в сутки;
- по данным опросника RAPID, была выявлена статистически достоверная динамика уменьшения болевого синдрома и его влияния на повседневную деятельность спустя 90 дней после окончания лечения у больных, получавших гимекромон в дозе 1200 мг в сутки (Chi2; p = 0,014);
- в группе больных, получавших гимекромон в дозе 1200 мг в сутки, отмечена статистически значимая динамика нормализации стула (Chi2; p = 0,015);
- более значимая динамика уменьшения диаметра общего желчного протока отмечена в группе больных, получавших гимекромон в дозе 1200 мг в сутки (критерий Уилкоксона; p = 0,05);
- большинство больных (81,3%), получавших гимекромон в дозе 1200 мг в сутки, были полностью удовлетворены или скорее удовлетворены лечением.
Полученные данные свидетельствуют об эффективности и безопасности препарата Одестон (гимекромон) в терапии пациентов с дисфункцией сфинктера Одди после перенесенной холецистэктомии, что обусловлено его селективным спазмолитическим эффектом в отношении сфинктера Одди.
Конфликт интересов.
Настоящее исследование проведено при поддержке фармацевтической компании «Адамед Фарма».
D.S. Bordin, PhD, Prof., E.A. Dubtsova, PhD, E.Ya. Selezneva, PhD, E.O. Kukoleva, M.L. Lashko, M.V. Chebotareva, K.A. Nikolskaya, PhD
A.S. Loginov Moscow Clinical Scientific Center
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
Tver State Medical University
Scientific Research Institute of Healthcare and Medical Management of the Moscow City Health Department
Contact person: Dmytriy S. Bordin, d.bordin@mknc.ru
Laparoscopic cholecystectomy is the leading method of treatment of cholelithiasis. Often, postcholecystectomy syndrome develops after cholecystectomy. In most cases, its manifestations are of a functional nature and are associated with dysfunction of the Oddi sphincter. A study of the effectiveness of the drug Odeston (hymecromone) at doses of 600 mg and 1200 mg per day in patients with postcholecystectomy syndrome was conducted. 36 patients were randomized into two groups: the first group consisted of 18 patients receiving the drug hymecromone at a dosage of 600 mg per day (200 mg three times a day), the second group of 18 patients receiving the drug hymecromone 1200 mg per day (400 mg three times a day). The duration of therapy was 21 days. When assessing the pain syndrome on a visual analog scale, statistically significant dynamics (Chi2; p < 0.01) was observed in both groups after therapy, most pronounced in the second group. In the second group, normalization of the stool was noted (Chi2; p = 0.015) and a decrease in the diameter of the common bile duct (Wilcoxon criterion; p = 0.05). When assessing the dynamics of abdominal pain and its impact on daily activities 90 days after therapy, a statistically significant advantage was revealed in the second group (Chi2; p = 0.014). The data obtained indicate that Odeston is more effective in postcholecystectomy syndrome at a dose of 1200 mg per day.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.