Внутрипеченочная холангиокарцинома на фоне множественного холангиолитиаза как плохо диагностируемая проблема в клинической практике
- Аннотация
- Статья
- Ссылки
- English
Желчнокаменная болезнь (ЖКБ) является распространенным заболеванием органов пищеварения по всему миру, с частотой встречаемости в разных странах от 10 до 15%, в России – 3–12%, с существенными возрастными и гендерными различиями [1]. ЖКБ протекает преимущественно в виде острого или хронического холецистита. Холангиолитиаз является редким проявлением ЖКБ, характеризующимся наличием конкрементов в долевых и сегментарных желчных протоках. В европейских странах и в России встречается достаточно редко (не превышает 1%) и в подавляющем большинстве случаев (95–97%) является вторичным – связан с миграцией конкрементов из желчного пузыря [2]. В странах Восточной Азии частота холангиолитиаза достигает 45% вследствие хронического холестаза, вызванного трематодами Clonorchis sinensis, Opisthorchis viverrini. Первичное образование конкрементов во внутрипеченочных желчных протоках связано с общими нарушениями пигментного обмена и замедлением оттока желчи вследствие паразитарной инвазии (C. sinensis), стриктур внутрипеченочных протоков, склерозирующего холангита и холангиоэктазии при болезни Кароли [3].
Холангиоцеллюлярный рак, или холангиокарцинома (ХК), по частоте развития является второй после гепатоцеллюлярного рака первичной злокачественной опухолью печени. Около 50–70% от всех ХК развивается в области ворот печени, 20–30% – в дистальных отделах общего желчного протока и 5–15% – внутрипеченочно [4]. В настоящее время установлена этиопатогенетическая связь внутрипеченочной холангиокарциномы (ВПХ) с холангиолитиазом: частота холангиоцеллюлярного рака достигает 85 случаев на 100 тыс. населения в азиатских странах, в то же время в Европе она не превышает один случай на 100 тыс. населения [5].
Развитие аденокарциномы из эпителия желчных протоков – многоступенчатый процесс, включающий гиперплазию эпителия, дисплазию, аденокарциному in situ и инвазивную аденокарциному. Первичная ВПХ развивается из холангиоцитов каналов Геринга, гепатоцитов, междольковых желчных протоков, стволовых клеток печени, незрелых и зрелых междольковых холангиоцитов [6]. В канцерогенезе ВПХ ведущую роль играют хронический рецидивирующий холангит и пролиферация перибилиарных желез. По морфологическому критерию ВПХ наиболее часто представлена тубулярной аденокарциномой, более редкие варианты могут иметь плоскоклеточную, аденосквамозную, перстневидноклеточную дифференцировку и др. [7, 8].
Диагностика и лечение холангиолитиаза и холангиокарциномы
Холангиолитиаз и ВПХ выявляются преимущественно с помощью визуализирующих методов диагностики и часто являются случайной находкой при полном отсутствии клинических проявлений заболевания. В случаях клинически манифестного холангиолитиаза у пациентов наблюдаются гипертермия, немотивированная утомляемость, болевой синдром в правом верхнем квадранте живота, развитие желтухи. При лабораторном обследовании могут выявляться нейтрофильный лейкоцитоз, увеличение скорости оседания эритроцитов, холестатический и цитолитический синдромы. Ультразвуковое исследование (УЗИ) и мультиспиральная компьютерная томография (МСКТ) позволяют визуализировать дилатацию желчных протоков, наличие внутрипротоковых конкрементов и образований печени, а также паренхиматозные изменения. Магнитно-резонансная холангиопанкреатография позволяет получить достоверное изображение внутри- и внепеченочных желчных протоков, оценить наличие стриктур, а также выявить изменения перидуктальных тканей и паренхимы печени [9]. Позитронно-эмиссионная томография может быть полезна в диагностике ВПХ, но чувствительность метода варьирует в зависимости от морфологической структуры опухоли, при узловом типе ВПХ чувствительность может достигать 85%, тогда как при инфильтративном – не более 18% [10]. Биомаркер СА 19-9 при наличии ВПХ может быть как в пределах референтных значений, так и повышенным, при этом высокие значения СА 19-9 встречаются и при некоторых неопухолевых заболеваниях, например бактериальном холангите [11]. К инвазивным методам диагностики относятся ретроградная и чреспеченочная холангиография и холангиоскопия.
Стратегия лечения холангиолитиаза в целом основана на достижении максимально полного удаления конкрементов желчных протоков и профилактике холангита и развития билиарных стриктур, предупреждении прогрессирования заболевания с переходом в цирроз либо развития ХК. К нехирургическим методам относят методы эндоскопического и чрескожного удаления конкрементов, литотрипсию, а к хирургическим – резекцию печени и гепатэктомию. Развитие билиарных стриктур во время лечения всегда требует внимательного скрининга в отношении ХК. В сравнительном исследовании H.J. Kim и соавт. (2015) установили, что ВПХ должна быть заподозрена у пациентов с длительным анамнезом холангиолитиаза (более 10 лет), снижением на этом фоне массы тела, высокими уровнями щелочной фосфатазы, ракового эмбрионального антигена (РЭА), СА 19-9, наличием конкрементов в протоках обеих долей печени и/или выявлением билиарных стриктур [9].
В случае выявленной ВПХ на первой-второй стадиях хирургическое лечение должно рассматриваться как основное. Операция остается единственным радикальным методом, способным излечить пациента с опухолью билиарного тракта. Цель хирургического лечения – достижение R0‑резекции, что ассоциируется с наилучшими отдаленными результатами (пятилетняя выживаемость – 20–43%, медиана выживаемости – 27–36 месяцев). При ВПХ рутинно не выполняется трансплантация печени из‑за часто возникающего раннего рецидива опухоли, однако опыт отдельных центров трансплантации показывает хорошие результаты у небольших групп пациентов. В среднем не более 15% пациентов подлежат радикальному лечению на момент выявления заболевания. При более поздних стадиях ВПХ возможными вариантами лечения являются системная химиотерапия (ХТ), химиолучевая терапия (ХЛТ), а также методы локального контроля опухоли, такие как абляция, эмболизация, локорегионарная химиотерапия и фотодинамическая терапия. При погранично-резектабельном процессе начало лечения возможно с системной ХТ с повторной оценкой резектабельности после 4–6 курсов и принятием решения о хирургическом лечении, однако надо учитывать, что существующая системная химиотерапия приводит к уменьшению размеров первичной опухоли и переходу в резектабельное состояние в достаточно редких случаях. При однозначной нерезектабельности локализованного поражения после завершения системной ХТ первой линии (гемцитабин + цисплатин или гемцитабин + оксалиплатин) может проводиться ХЛТ со фторпиримидинами либо самостоятельная стереотаксическая лучевая терапия. Эффект локального контроля над опухолью может достигаться при подключении локорегионарных методов лечения – трансартериальной химио(радио)эмболизации опухоли, радиочастотной или микроволновой абляции. Комбинация гемцитабина c цисплатином определена стандартной схемой лечения в первой линии терапии нерезектабельного, рецидивирующего или метастатического рака желчевыводящих путей с медианой продолжительности 11,7 месяца по сравнению с 8,1 месяца при применении гемцитабина в монорежиме. В качестве терапии второй линии могут применяться также фторпиримидины в монорежиме, комбинация оксалиплатина с капецитабином или иринотекана с фторурацилом. При длительном периоде (более 6 месяцев) без прогрессирования после эффективной первой линии лечения возможно повторное использование гемцитабина с препаратом платины. Для пациентов, у которых по данным молекулярно-генетического исследования выявляется MSI-H / dMMR, есть вероятность получения эффекта от применения пембролизумаба [12].
Холангиокарцинома и болезнь Кароли
Болезнь Кароли (БК) – это генетически детерминированное заболевание, характеризующееся сегментарной необструктивной фиброзно-кистозной дилатацией внутрипеченочных желчных протоков с частым формированием внутрипеченочных конкрементов. Синдром Кароли (СК) – это сочетание дилатации внутрипеченочных желчных протоков и врожденного фиброза печени [13]. В основе заболевания – внутриутробная аномалия развития желчных протоков с их мешотчатым расширением, которая приводит к развитию хронического очагового воспаления, повторяющимся эпизодам холангита, образованию желчных конкрементов и в ряде случаев (до 14% больных) злокачественной трансформации [14]. Клиническая картина складывается из проявлений холестаза, гепатомегалии, рецидивирующей лихорадки, абдоминальной боли, обусловленных периодическими эпизодами билиарной обструкции внутрипеченочными конкрементами и холангитом, у части больных выявляются абсцессы печени. В большинстве случаев патологические изменения внутрипеченочных желчных протоков при БК или СК обнаруживают при УЗИ и МСКТ. Для верификации диагноза используют методы холангиографии: магнитно-резонансная, ретроградная или транспеченочная [15].
Установлено, что среди больных БК или СК риск развития ВПХ увеличивается в 100 раз по сравнению со здоровыми людьми [16]. Точные механизмы формирования ВПХ при БК и СК не установлены, существует несколько теорий: канцерогенный эффект воздействия желчных кислот на желчные протоки, обусловленный стойким стазом желчи [8]; постоянное повреждение протоков конкрементами, рецидивирующий холангит [10] и клеточная предрасположенность к неопластическим изменениям кистозно измененных внутрипеченочных желчевыводящих путей [14]. Предполагается, что злокачественные новообразования при БК или СК более вероятны у пожилых пациентов из-за большой продолжительности заболевания и прогрессирующей билиарной обструкции [17]. По другим данным, злокачественная трансформация не зависит от продолжительности заболевания, так как описаны случаи развития ВПХ от двух месяцев до двух десятилетий с момента появления симптомов БК и СК. По-видимому, существуют подтипы заболевания с более выраженными генетическими поломками и повышенным потенциалом развития ВПХ [18]. По некоторым данным, ВПХ, развившаяся на фоне БК или СК, характеризуется более агрессивным течением и худшим ответом на лечение по сравнению с когортой больных ХК, не ассоциированной с БК и СК [19, 20].
Клиническое наблюдение
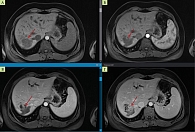
Женщина 32 лет с жалобами на боли в правом подреберье и иктеричность склер по направлению гастроэнтеролога обратилась на прием к онкологу в июне 2020 г. При амбулаторном УЗИ выявлено узловое образование в паренхиме седьмого сегмента печени размерами около 3,5 см, холангиоэктазия в правой доле печени, гиперэхогенные включения с акустической тенью в проекции желчных протоков левой доли печени без заметной их дилатации. Из анамнеза известно: наследственность отягощена по ЖКБ, у пациентки с 12 лет установлен диагноз ЖКБ: хронический калькулезный холецистит. В 2013 г. в связи с холедохолитиазом по экстренным показаниям выполнено оперативное вмешательство в объеме эндоскопической ретроградной холангиопанкреатографии, эндоскопической папиллосфинктеротомии с литоэкстракцией и последующей лапароскопической холецистэктомией. В дальнейшем наблюдалась у гастроэнтеролога, получала курсовое лечение препаратами урсодезоксихолевой кислоты. Ежегодно на УЗИ регистрировалось наличие в проекции долевых и сегментарных желчных протоков эхопозитивных включений, расцениваемых как пневмобилия после перенесенного оперативного лечения и кальцинаты печени. При первичном амбулаторном обследовании установлено повышение уровня СА 19-9 до 453 Ме/мл, повышение уровня трансаминаз до пяти норм. По результатам магнитно-резонансной томографии (МРТ) с контрастным усилением (на постконтрастных томограммах) выявлено объемное образование полицентрической формы в правой доле печени (SVII) размерами около 4,8 × 5,3 × 4,0 см, характеризующееся негомогенным медленным накоплением контраста солидным компонентом, продолжающимся в отсроченной фазе, за счет большого количества фиброза в зоне образования. Псевдоконтрастирование по контуру было обусловлено гипоперфузией в бассейне воротной вены, за счет чего паренхима кровоснабжалась из печеночной артерии (рис. 1).
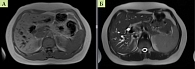
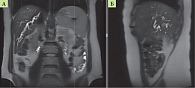
Внутрипеченочные желчные протоки печени, преимущественно левой доли, расширены, скучены и деформированы. В просвете желчных протоков обеих долей печени (преимущественно в левом печеночном) отмечены множественные дефекты контрастирования размерами от 0,2 до 0,6 см (рис. 2, 3).
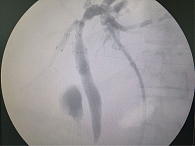
Пациентке выполнена трепанобиопсия солидной опухолевой массы правой доли печени под ультразвуковой навигацией. Гистологическое заключение: картина опухоли соответствует умеренно дифференцированной аденокарциноме панкреатобилиарной зоны. В связи с нарастанием билиарной гипертензии и явлений холестаза выполнена чрескожная холангиография с установкой наружновнутреннего транспапиллярного билиарного дренажа. При холангиографии отмечено наличие в протоках правой и левой долей печени дефектов контрастирования, подозрительных на конкременты, до 3–4 мм в диаметре, билиарных опухолевых стриктур протяженностью до 20–30 мм в зоне слияния переднего и заднего секторальных протоков правой доли печени и протяженного поражения протоков седьмого сегмента печени. Просвет внепеченочных желчных протоков свободен от конкрементов, не расширен, эвакуация контрастного вещества в двенадцатиперстную кишку не нарушена (рис. 4).
Таким образом, на основании данных МРТ и холангиографии установлен диагноз: «C22.1 Холангиокарцинома внутрипеченочных желчных протоков cТ2N0M0 второй стадии, смешанный масс-образующий и внутрипротоковый папиллярный тип опухоли, состояние после наружновнутреннего билиарного дренирования. Болезнь Кароли: множественные кистозные расширения внутрипеченочных желчных протоков, холангиолитиаз». В связи с погранично резектабельным процессом назначено шесть курсов ХТ по схеме гемцитабин/цисплатин с интервалом 21 день с октября 2020 по февраль 2021 г. ХТ пациентка перенесла с явлениями гематологической токсичности до третьей степени, тошнотой до второй степени. Замена холангиостомических дренажей выполнена в октябре 2020 и январе 2021 г. в связи с развитием холангита. При удалении холангиостом из желчных протоков извлечены конкременты минеральной плотности серого цвета размером от 3 до 5 мм (рис. 5).
По данным МСКТ от июня 2021 г. выявлено увеличение размеров первичной опухоли с распространением на седьмой и восьмой сегменты печени (7,8 × 6,4 см), появление асцита и очаговых изменений на брюшине, расцененных как признаки карциноматоза. Оценка степени печеночной дисфункции по MELD – 23 балла. Рост уровня онкомаркеров: СА 19-9 – 1890 Ме/мл, альфа-фетопротеин – 15,6 ед/мл, РЭА – 0,5 нг/мл. Для оценки возможности проведения таргетной терапии проведено молекулярно-генетическое исследование биоптатов: PD-L1, KRAS, ERBB3, ARID1A – отрицательный статус. В связи с прогрессированием заболевания и плохим соматическим статусом проведение дальнейшей химиотерапии признано невозможным. С паллиативной целью проведено удаление холангиостом и стентирование желчных протоков правой и левой долей печени нитиноловыми непокрытыми стентами.
В связи с резистентным асцитом и персистирующей печеночной недостаточностью в дальнейшем получала симптоматическое лечение. Срок жизни от момента установления диагноза ВПХ составил 14 месяцев и два месяца после установки стентов.
Заключение
Представлена история болезни пациентки 32 лет с развившейся ВПХ на фоне БК, множественного холангиолитиаза. Несмотря на раннюю клиническую манифестацию (в 12 лет) и тяжелое течение ЖКБ в виде острого калькулезного холецистита, осложненного холангиолитиазом, после хирургического лечения пациентке не было выполнено дообследование, которое позволило бы установить диагноз БК. В течение последующих семи лет после лапароскопической холецистэктомии пациентке неоднократно проводили УЗИ органов брюшной полости, при котором визуальные изменения интерпретировали как пневмобилию и кальцинаты печени. Диагноз БК был установлен только на поздней стадии ВПХ, характеризовавшейся агрессивным течением и отсутствием ответа на стандартную ХТ, а также типом опухоли, при котором невозможна таргетная терапия. Как показывает представленное клиническое наблюдение, исключительно важно своевременно диагностировать БК и проводить систематический скрининг осложнений заболевания, включая наиболее тяжелое – развитие злокачественных новообразований, поскольку в течение 20 лет частота ВПХ при БК достигает 20%, то есть развивается у каждого пятого пациента [14].
A.A. Sutyagin, S.V. Shchelochenkov, PhD, T.D. Shchelochenkova, PhD, O.N. Guskova, PhD, D.S. Bordin, PhD, Prof.
Tver Regional Clinical Oncological Dispensary
LLC "Paracelsus"
Tver State Medical University
A.S. Loginov Moscow Clinical Scientific Center
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
Contact person: Sergey V. Shchelochenkov, workmedbox@gmail.com
Intrahepatic cholangiocarcinoma (ICH) is one of the most aggressive malignant neoplasms of the gastrointestinal tract, which accounts for 10–15% of all primary liver tumors. Among the risk factors for ICH in Europe and Russia, diseases accompanied by the formation of concretions in the intrahepatic bile ducts, which include Karoli's disease (KD), are of primary importance. The article presents a clinical observation of HPV that developed against the background of KD, a literature review is conducted.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.