В статье рассматриваются вопросы гормональной терапии редко встречающейся опухоли – эндометриальной стромальной саркомы. Приводятся результаты исследования, продемонстрировавшего эффективность применения ингибитора ароматазы третьего поколения Веро-анастрозола у пациенток с рецидивом ЭСС.
В исследование на данный момент включены 6 пациенток с ІІІ стадией заболевания в возрасте от 52 до 65 лет. Рецидив заболевания выявлен в сроки от 8 до 14 месяцев после комплексного лечения. Четыре пациентки получают Веро-анастрозол в дозе 1 мг 1 раз в сутки до момента выявления прогрессирования заболевания, у всех них эффект от лечения был расценен как стабилизация болезни.
У одной пациентки лечение прекращено в связи с прогрессированием заболевания через 3 месяца от начала терапии. Одна пациентка получала Веро-анастрозол в течение 6 месяцев, после чего был получен полный ответ, ремиссия составляет 3 года 5 месяцев. В совокупности наши исследования и предыдущие наблюдения свидетельствуют о перспективности подобного подхода в лечении больных ЭСС.
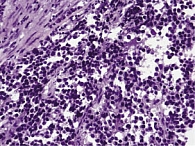
Рис. 1. Эндометриальная стромальная саркома. Окраска гематоксилином и эозином (увеличение в 400 раз)
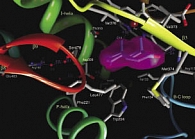
Рис. 2. Андростендион в активном связывающем сайте ароматазы
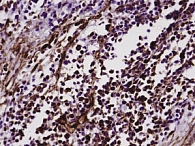
Рис. 3. Положительная реакция на виментин в большей части опухолевых клеток (увеличение в 400 раз)
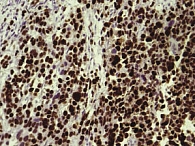
Рис. 4. Экспрессия ароматазы в опухоли (увеличение в 400 раз)

Таблица 1. Сравнительная характеристика антиароматазных препаратов
Эндометриальная стромальная саркома (ЭСС) – сравнительно редкое заболевание (рис. 1), что создает определенные трудности в ее изучении и выработке стандартов лечения. Течение ЭСС непредсказуемо – даже опухоли с низкой митотической активностью и минимальной клеточной атипией в 45–60% случаев рецидивируют, а отдаленные метастазы приводят к летальному исходу [1].
Этиология и патогенез ЭСС пока не установлены. Многие авторы считают: ЭСС возникают из полипотентных стромальных клеток, специализированных мезинхимальных клеток с иммунофенотипическими признаками миобластов. Существует предположение, что гладкомышечная дифференцировка является результатом метаплазии неопластических эндометриальных стромальных клеток. V. Cаnzonieri и соавт. полагают, что ЭСС низкой СЗ развиваются непосредственно из гладкомышечной стенки крупной вены. Немецкие морфологи обнаружили в культуре опухолевых клеток ЭСС, содержащей виментин, различные варианты цитокератина. Предполагают, что одним из факторов риска развития ЭСС может быть нарушение секреции половых гормонов. В последние годы появились сообщения о возникновении ЭСС у женщин, получавших тамоксифен в течение нескольких лет по поводу рака молочной железы [15, 16].
Биосинтез эстрогенов, в том числе в ткани некоторых новообразований, катализируется ферментным комплексом ароматазы, который является изоформой цитохрома Р450, содержащего монооксигеназную систему, участвующую в биосинтезе стероидных гормонов из холестерола (гидроксилирование по С22 и С20 при отщеплении боковой цепи 11β и 18). Монооксигеназная система состоит из трех компонентов, локализованных на внутренней митохондриальной мембране на границе с матриксом: НАДФ-специфичного (никотинамидадениннуклеотидфосфат), ФАД (флавинадениндинуклеатид), содержащего флавопротеин, и гемопротеина (адренодоксин) [2]. Цитохром Р450 является продуктом гена CYP19.
У человека ароматазы обнаружены в яичниках, яичках, адипоцитах, плаценте, головном мозге, мышцах, фибробластах кожи и костных остеобластах. Андрогены являются основной С19-стероидной субстанцией для биосинтеза эстрогенов в этих тканях. Ферментный комплекс ароматазы связывается с андрогенной стероидной субстанцией и катализирует определенную ступень синтеза эстрогенов, образующихся из андростендиона и тестостерона через три гидроксилазных ступени. Третья ступень ароматизации характеризуется как окислительная реакция, в которой цитохром Р450 конверсирует С19-андрогены в С18-эстрогены (рис. 2).
В неизмененном эндометрии экспрессия CYP19 не выявляется. У человека ген CYP19 содержит промоторы, которые управляют тканево-специфичной экспрессией ароматазы. Полиморфизм гена CYP19 увеличивает риск развития рака эндометрия вследствие нарушения механизмов ингибирования экспрессии ароматазы или сверхэкспрессии рецепторов фермента, которая приводит к гиперэстрогении. Сверхэкспрессия CYP19 при раке эндометрия особенно часто отмечается у женщин, несущих А6 и А7 аллели [3].
Иммунореактивность ароматазы была обнаружена в клетках стромы при эндометриоидной эндометриальной карциноме [4, 5]. Этот факт продемонстрировал, что внутриопухолевая ароматаза при малигнизации эндометрия была ассоциирована со стромальной инвазией. Не было обнаружено корреляции между экспрессией или активностью ароматазы и стероидным статусом, клинической стадией заболевания или степенью дифференцировки опухоли, хотя экспрессия ароматазы чаще определялась при низкой степени дифференцировки опухоли, чем при высокодифференцированных стромальных эндометриальных саркомах [6].
Раcширение использования ингибиторов ароматазы в клинической практике было обусловлено тем, что ингибитор цитохрома Р450 аминоглютетимид является эффективным в лечении распространенного рака молочной железы у пациенток в постменопаузе. Уже в 1984 г. в ряде исследований сообщалось об объективном ответе и уменьшении ароматазной активности в результате применения ингибиторов ароматазы. Так, объективный ответ после применения аминоглютетимида была получен у 4 из 18 женщин с распространенным раком эндометрия [7].
В конце 1990-х был синтезирован целый ряд ингибиторов ароматазы, появление которых ознаменовало начало новой эры в лечении гормонозависимых неоплазий. В 1998 г. была продемонстрирована более высокая антиопухолевая активность ингибиторов ароматазы по сравнению с тамоксифеном [7]. После ингибиторов ароматазы первого (аминоглютетимид и тестолактон) и второго (форместан и фадразол) поколения появились препараты третьего поколения – анастрозол, летрозол, экземестан и ворозол, эффективность которых оказалась от 1000 до 10 000 раз выше, чем аминоглютетимида. Форместан, эффективность которого была продемонстрирована при распространенных гормоночувствительных карциномах молочной железы, стал доступным в клинической практике в 1993 г. Препарат обнаруживал более высокую избирательность в качестве ингибитора ароматазы, однако почти у 17% пациенток наблюдались лихорадочные состояния (сравнимые с побочным эффектом аминоглютетимида) и местная воспалительная реакция в месте инъекции (17% пациенток). Препараты третьей генерации являются более специфичными для связывающих сайтов фермента ароматазы, поэтому побочные эффекты при длительном применении незначительны или умеренно выражены. Благодаря особенностям механизма действия экземестан обеспечивает угнетение действия ароматазы на 98% и снижение уровня эстрогенов на 90% уже через 7 дней от начала лечения [2].
Ингибиторы ароматазы разделяют на две группы: стероидные (тип 1) и нестероидные ингибиторы (тип 2). Стероидные ингибиторы, как и все дериваты андростендиона, действуют как искусственные субстраты и необратимо блокируют андрогенсвязывающий сайт, обеспечивая постоянную инактивацию фермента. Нестероидные ингибиторы связываются с частью гема фермента цитохрома Р450 и препятствуют утилизации НАДФ, что предотвращает гидроксилирование и приводит к снижению уровня эстрогенов. Поскольку фермент ароматаза конвертирует андрогены в эстрогены во всех тканях, блокаторы ароматазы могут ингибировать как периферическую, так и эндометриальную стромальную ароматизацию, так как ингибиторы ароматазы могут подавлять уровень эстрогенов эффективнее, чем хирургическая адреналэктомия или гипофизэктомия. Хотя точные патофизиологические механизмы действия ингибиторов не выяснены, наиболее вероятно, что апоптоз опухолевых клеток усиливается из-за нарушения синтеза эстрогенов. Ингибиторы ароматазы не влияют на статус эстрогеновых рецепторов в опухолевых клетках карциномы эндометрия в противоположность антиэстрогену – тамоксифену. In vitro было показано, что ингибиторы ароматазы подавляют пролиферацию и усиливают апоптоз в эндометриальном раке [8].
В исследовании O. Reich и S. Regauer [6] проанализирована экспрессия ароматазы в 23 образцах ткани опухоли низкодифференцированных ЭСС. Проводилась оценка иммуногистохимическим методом с использованием моноклональных и поликлональных антител. Экспрессия ароматазы была отмечена в 19 (83%) из 23 опухолей при применении моноклональных антител и в 20 (87%) из 23 – при использовании поликлональных антител. При использовании моноклональных антител экспрессия ароматазы была оценена как высокая в 5 (22%), умеренная – в 9 (39%) и низкая – в 5 (22%) опухолях, в 4 (17%) опухолях экспрессии ароматазы не выявлено. При применении поликлональных антител экспрессия ароматазы была оценена как высокая в 7 (31%), умеренная – в 4 (17%) и низкая – в 9 (39%) опухолях, в 3 (13%) случаях экспрессии ароматазы не выявлено. Низкая экспрессия ароматазы или полное ее отсутствие коррелировало с I стадией болезни, в то время как более высокие показатели экспрессии были чаще связаны с прогрессированием заболевания.
Однако до настоящего времени остаются невыясненными два важных аспекта использования ингибиторов ароматазы в лечении гормонозависимых злокачественных новообразований. Один из них – возможность определения чувствительности или резистентности опухоли к ингибиторам ароматазы в полученных гистологических образцах перед началом лечения пациентки, другой – установление точного механизма антиопухолевых эффектов ингибиторов ароматазы в клетках карциномы. Подавляющее большинство исследователей считают хирургическое вмешательство основным методом лечения ЭСС матки. Продолжаются попытки улучшить отдаленные результаты лечения с помощью адъювантной и неоадъювантной химиотерапии. Однако данные проведенных исследований крайне разноречивы. Неудовлетворенность результатами хирургического и химиотерапевтического лечения ЭСС обусловила попытки их дополнения лучевой терапией. Существуют исследования об эффективности гормональной терапии ЭСС [1].
В гинекологическом отделении Городского клинического онкологического диспансера Санкт-Петербурга (СПбГКОД) ведется набор пациенток с ЭСС, получающих терапию ингибитором ароматазы третьего поколения Веро-анастрозолом. Веро-анастрозол является нестероидным ингибитором ароматазы третьего поколения, обладающий наибольшей селективностью среди антиароматазных препаратов (табл. 1). Всего в исследование на данный момент включено 6 пациенток с ІІІ стадией заболевания в возрасте от 52 до 65 лет. Пациентки находятся на лечении в СПбГКОД с 2006 г.: 5 пациенток по поводу рецидива ЭСС после ранее проведенного комплексного лечения, 1 пациентка – под наблюдением после достижения полного ответа на терапию Веро-анастрозолом в 2008 г. У 3 пациенток выявлены местные рецидивы, у 2 больных наряду с местными рецидивами – отдаленные метастазы в легкие. Рецидив заболевания выявлен в сроки от 8 до 14 месяцев после комплексного лечения. 4 пациентки получают Веро-анастрозол в дозе 1 мг 1 раз в сутки до момента выявления прогрессирования заболевания, у всех 4 пациенток достигнут эффект стабилизации. У одной пациентки лечение прекращено в связи с прогрессированием заболевания через 3 месяца от начала терапии. Одна пациентка получала Веро-анастрозол в течение 6 месяцев, после чего был получен полный ответ, ремиссия составляет 3 года 5 месяцев. Нежелательных явлений, связанных с проводимой терапией, не выявлено.
Для иммуногистохимического анализа были доступны ткани всех пациенток. Полученный для морфологического анализа биопсийный и операционный материал фиксировался в нейтральном формалине и после стандартной гистологической проводки заливался в парафин. Из парафиновых блоков изготавливались срезы толщиной 5–7 мкм. Оценка морфологических особенностей ткани опухоли и зоны фона проводилась на срезах, окрашенных гематоксилином и эозином. Оценивали экспрессию маркера пролиферации Ki-67, экспрессию фермента ароматазы и количество рецепторов к эстрогену и прогестерону. Результаты иммуногистохимической реакции оценивались по 3-балльной шкале по методике McCarthy и соавт.
Проведенные нами иммуногистохимические исследования показали следующие результаты. В 4 случаях было выявлено отсутствие экспрессии рецепторов эстрогенов и прогестерона, низкая экспрессия – в 2 случаях. Панцитокератин АЕ1/АЕ3 не экспрессировался. Экспрессии десмина также не было обнаружено, что считается характерным для эндометриальной стромальной саркомы. У 1 пациентки, находящейся в ремиссии на момент начала исследования, было отмечено отсутствие экспрессии альфа-актина, что рассматривается как утрата эпитопов данного антигена при развитии опухоли. Виментин в ткани опухоли был положительным (рис. 3), что доказывает ее стромальное происхождение. В исследуемых опухолях определялась сверхэкспрессия по мутантному белку p53 и сверхэкспрессию Ki-67, что коррелировало со сверхэкспрессией фермента ароматазы (рис. 4) в ткани опухоли. Сверхэкспрессия Ki-67 и p53 указывает на высокую степень злокачественности опухоли и свидетельствует о глубоких нарушениях пролиферации и апоптоза в опухолевой ткани.
Демонстрация экспрессии ароматазы в ЭСС низкой степени злокачественности является основанием для более широкого изучения эффективности ингибиторов ароматазы в лечении женщин с ЭСС. В ряде исследований показана высокая эффективность ингибиторов ароматазы, превосходящая результаты применения прогестинов при эндометриальной стромальной саркоме. В одном случае получен объективный ответ на лечение рецидива заболевания летрозолом в течение 9 месяцев. В другом клиническом исследовании у 2 пациенток 44 и 34 лет с рецидивом эндометриальной стромальной саркомы с метастазами в легкие в результате монотерапии летрозолом был достигнут полный ответ. Безрецидивная выживаемость у этих пациенток составила 14 и 7 лет соответственно [9, 10, 11]. Согласно клиническим рекомендациям Европейского общества медицинской онкологии (ESMO), карциносаркому эндометрия выделяют в отдельную группу рака эндометрия, которая относится к опухолям с плохим прогнозом [12]. Одновременное наличие в опухоли маркеров эпителиальных и стромальных клеток при одном генотипе позволяет считать эндометриальную стромальную саркому монофазным вариантом карциносаркомы матки [13].
Отдаленные метастазы ЭСС высокой степени злокачественности наблюдаются у 20–30% больных. Больные умирают от прогрессирования заболевания в течение двух лет после хирургического лечения. До сих пор не существует единого мнения относительно роли гормонотерапии в качестве адъювантного компонента в комбинированном и комплексном лечении больных раком тела матки и в том числе ЭСС. После появления сообщения об успешной гормонотерапии рецидивов и метастазов рака молочной железы аналогичные подходы используются при лечении больных раком эндометрия. Чувствительность метастазов рака эндометрия к оксипрогестерону капронату и медроксипрогестерону ацетату при высокой и умеренной степени злокачественности превышает 50%, однако при низкодифференцированной – меньше 15%.
При рецидивах и метастазах ЭСС возможны длительные ремиссии. Прогестагены могут быть эффективны в случае экспрессии в опухоли рецепторов половых гормонов [14]. Однако, и это подтверждается в нашем исследовании, далеко не все опухоли оказываются позитивными по экспрессии рецепторов стероидных гормонов. В связи с этим проводятся дальнейшие исследования терапевтического воздействия другими гормональными агентами, потенциальный резерв которых далеко не исчерпан. Таким образом, гормональная терапия ингибитором ароматазы третьего поколения Веро-анастрозолом у пациенток с рецидивом ЭСС продемонстрировала свою эффективность. Результаты наших исследований, как и предыдущие наблюдения, свидетельствуют о перспективности подобного подхода в лечении больных ЭСС.





