Трудные вопросы диагностики и лечения аллергических заболеваний у детей. XVII Российский конгресс «Инновационные технологии в педиатрии и детской хирургии». Сателлитный симпозиум компании «Фармамед»
- Аннотация
- Статья
- Ссылки





Новое в этиопатогенезе пищевой аллергии
Под пищевой аллергией понимают побочные реакции у сенсибилизированных лиц на пищевые продукты, обусловленные иммунологическими механизмами, преимущественно IgE-антителами. По словам заведующей отделением аллергологии ФИЦ питания и биотехнологии, д.м.н., профессора Веры Афанасьевны РЕВЯКИНОЙ, пищевая аллергия характеризуется полиморфизмом клинических симптомов. Не случайно с ней связано большинство кожных, респираторных и гастроинтестинальных проявлений.
Этиология и виды аллергенов
К этиологическим факторам пищевой аллергии относятся аллергены, содержащиеся в пищевых продуктах. Как правило, это белки с высокой молекулярной массой (10–70 кД). Чем выше молекулярный вес пептидов, тем выше аллергенность пищевого продукта1. Иммунная система распознает лишь небольшую часть молекулы белка (антигена), называемую эпитопом. Именно эпитоп связывается с соответствующими специфическими IgE-антителами.
В настоящее время в белковой молекуле выделяют конформационные и линейные эпитопы. Конформационные эпитопы нестабильны. При нагревании в процессе производства изменяется их пространственная конфигурация, что приводит к снижению аллергенности как эпитопов, так и собственно пищевых продуктов. Конформационные эпитопы, как правило, ответственны за транзиторную аллергию (коровье молоко, яйцо, соя, пшеница). Линейные эпитопы стабильны, их активность не снижается в процессе приготовления пищи. Они отвечают за длительную аллергию (рыба, арахис, лесные орехи).
Любой пищевой аллерген содержит несколько молекул (компонентов) с различными эпитопами. Одни эпитопы видоспецифичны, другие, несмотря на схожесть, относятся к разным семействам. Так, некоторые эпитопы пыльцы березы гомологичны эпитопам арахиса, лесных орехов и фруктов. Это проявляется таким феноменом, как перекрестная реактивность.
Результаты исследований, проведенных специалистами Центра питания и биотехнологии, показали, что ведущим пищевым аллергеном у детей является белок коровьего молока (БКМ). Второй по значимости пищевой аллерген – горох и томаты. БКМ подразделяются на сывороточные (альфа-лактоальбумин, бета-лактоглобулин, бычий сывороточный альбумин, иммуноглобулин), на долю которых приходится 20%, и казеины (αs1-, αs2-казеины, g1-, g2-, g3-казеины и др.) – 80%.
Конформационные эпитопы сывороточных белков обычно разрушаются при нагревании или ферментативном гидролизе (термолабильны). Линейные эпитопы казеинов более термостабильны, не расщепляются в желудке. Они ответственны за развитие системных реакций и длительной аллергии. При обычной промышленной переработке молока белки не удаляются, но их аллергенность частично снижается.
Как показали клинические исследования, 75% детей с IgЕ-опосредованной пищевой аллергией на коровье молоко хорошо переносят продукты, в состав которых оно входит (кексы, торты, хлеб, вафли). Следовательно, включение таких продуктов в рацион питания может ускорить развитие у детей толерантности к коровьему молоку. По данным S.A. Leonard и соавт.2, введение в рацион ребенка выпечки, содержащей молоко и куриное яйцо, ускоряет развитие толерантности к необработанному молоку и яйцу. Меньше известно о кулинарной обработке молока при не-IgЕ-опосредованной аллергии на его протеины.
Развитие толерантности
Пищевая аллергия имеет вариабельное течение, с возрастом ее доминирующая роль снижается. В ряде исследований, посвященных оценке естественного течения аллергии к БКМ, за период наблюдения от шести месяцев до четырех лет развитие оральной толерантности отмечалось у 29% детей в возрасте 14–20 месяцев с IgE-опосредованной реакцией и у 74% – с не-IgE-опосредованной реакцией, за пятилетний период наблюдения – у 67% детей от года до восьми лет (98 месяцев) с IgE-опосредованной реакцией и у 86% – с не-IgE-опосредованной реакцией3.
Развитие клинических проявлений (начало и разрешение) при использовании молока у детей первого года жизни оценивали в ряде исследований, в том числе проведенных в США, Европе, Израиле, Португалии. Согласно полученным данным, ультрапастеризованное молоко может безопасно применяться перед введением сырого молока. Включение ультрапастеризованного молока в рацион питания способно ускорить развитие толерантности к сырому молоку.
Аналогичные исследования проводились и в отношении клинических симптомов (начало и разрешение) при употреблении яйца, сои, пшеницы, арахиса. Согласно полученным данным, употребление в пищу ультрапастеризованного яйца способствовало развитию толерантности к нему у 50% детей к шестилетнему возрасту. При включении в диету переработанной сои и пшеницы толерантность развивалась к шести-семи годам в 45–50% случаев при более высоких показателях IgE. И лишь у небольшого количества детей (10–22%) формировалась толерантность к арахису.
Какова хронология возникновения клинических симптомов пищевой аллергии? Реакция, возникающая менее чем через 15 минут, проявляется оральным аллергическим синдромом, в течение 15–60 минут – в виде крапивницы, астмы, анафилаксии, в течение 30–60 минут – болью в животе, тошнотой и рвотой.
Терапия пищевой аллергии
Современный алгоритм терапии пищевой аллергии включает элиминацию причинно-значимых пищевых аллергенов, неспецифических факторов, проведение противовоспалительной фармакотерапии, направленной на достижение контроля за течением пищевой аллергии. Что касается аллергенспецифической иммунотерапии, пока достаточной доказательной базы ее эффективности у пациентов с пищевой аллергией нет.
Диетотерапия – основа комплексного лечения детей. Она подразделяется на элиминационную (исключение причинно-значимых аллергенных продуктов), гипоаллергенную (исключение причинно-значимых и продуктов с высоким аллергенным потенциалом) и ротационную (чередование продуктов каждые два – четыре дня). При пищевой аллергии назначают антигистаминные препараты, пероральные формы кромогликата натрия, особенно при резистентных формах, кетотифен (у детей раннего возраста), пробиотики, энтеросорбенты, анти-IgE-препараты, препараты симптоматической терапии.
Как известно, частота дисбиотических нарушений у детей с пищевой аллергией достигает 94%. Не случайно в схему лечения для коррекции нарушений кишечной микробиоты вводят пробиотики с доказанной эффективностью: Bifidobacterium longum, Bifidobacterium lactis, Lactobacillus rhamnosus, Lactobacillus casei, Lactobacillus reuteri, а также Saccharomyces boulardii.
Мультиштаммовый пробиотик нового поколения Бак-Сет Беби (Великобритания), содержащий семь видов полезных бактерий и пребиотик, предназначен для детей с рождения (одно саше один раз в день). Мультипробиотик Бак-Сет Форте содержит 14 видов полезных бактерий и предназначен для детей с трех лет (одна капсула в день).
К слову сказать, препарат Бак-Сет, который используется у детей с высоким риском атопии в целях коррекции гастроинтестинальных проявлений пищевой аллергии, получил награду королевы Великобритании Елизаветы II.
В исследовании, проведенном в Центре питания и биотехнологии, у детей на фоне применения мультипробиотика Бак-Сет существенно снижалось содержание эозинофильного катионного протеина – маркера аллергии, а также уровень эозинофильного нейротоксина по сравнению с группой контроля. Кальпротектин у большинства детей оставался в норме.
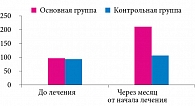
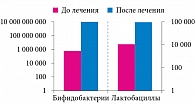
Положительная динамика наблюдалась и в отношении показателей IgA: среднее значение секреторного IgA (sIgA) в основной группе на фоне терапии мультипробиотиком увеличилось более чем в два раза по сравнению с исходным и аналогичным показателем в группе контроля (рис. 1). Оценка динамики микробиологических показателей у больных основной группы продемонстрировала увеличение содержания лактобацилл и бифидобактерий (рис. 2).
Установлено, что пробиотики эффективны в предупреждении экземы. Кроме того, Lactobacillus reuteri оказывает профилактический эффект в отношении атопического дерматита (АтД): кумулятивная частота АтД к шестимесячному возрасту достоверно ниже у детей, матери которых во время беременности получали рекомендуемый рацион питания и пробиотик Lactobacillus reuteri.
Энтеросорбенты также используются в схемах лечения пищевой аллергии, особенно при кожных проявлениях. Они выводят из организма аллергены, продукты неполного ферментативного расщепления, биологически активные вещества, патогенные, условно патогенные микроорганизмы и вирусы.
Завершая выступление, профессор В.А. Ревякина констатировала, что при выборе терапии пищевой аллергии у детей необходимо учитывать этиологические факторы и особенности патогенетических механизмов. При этом первоочередными остаются элиминация причинно-значимых аллергенов с диетической коррекцией и медикаментозное лечение с использованием препаратов, влияющих на разные звенья патогенеза.
Маски аллергических заболеваний у детей. Аллергия или не аллергия?
Как отметила профессор кафедры аллергологии и клинической иммунологии Российского университета дружбы народов, д.м.н. Дали Шотаевна МАЧАРАДЗЕ, специалисту в условиях рутинной практики часто приходится консультировать пациентов с гиперэозинофилией.
Гиперэозинофилия бывает первичной и вторичной. Наиболее частыми причинами вторичной, или реактивной неопухолевой гиперэозинофилии могут быть аллергические заболевания (аллергический бронхолегочный аспергиллез, реакции на лекарственные средства, астма и др.), паразитарные (стронгилоидоз, токсокароз, шистосомоз, филариоз), метаболические нарушения (гипокортицизм), иммунодефицитные состояния, аутоиммунные заболевания (дерматит Дюринга, буллезный дерматит). О наличии у ребенка гиперэозинофилии могут свидетельствовать снижение веса, температурная реакция, увеличение размеров печени и селезенки (требует консультации гематолога).
Если причины вторичной гиперэозинофилии установить не удается, необходимо провести тщательное обследование. На первом этапе выполняют общий и биохимический анализы крови, а также определяют уровни тропонина, IgE, IgG, IgA, витамина В12, триптазы. Кроме того, проводят рентгенографию грудной клетки, ультразвуковое исследование (УЗИ) брюшной полости, эхокардиографию (ЭхоКГ), анализ крови методом полимеразной цепной реакции (ПЦР), иммунофенотипирование.
Наличие идиопатической гиперэозинофилии служит основанием для назначения глюкокортикостероидов 1 мг/кг/сут в течение двух недель.
По словам профессора Д.Ш. Мачарадзе, уровень сывороточного общего IgE имеет низкую диагностическую специфичность. Его определяют в трех случаях: для исключения гипер-IgE-синдрома, назначения омализумаба, выявления аллергического бронхолегочного аспергиллеза.
Экстремально высокие уровни IgE могут также наблюдаться при АтД. Атопический дерматит – хроническое заболевание кожи, которое сопровождается сухостью и зудом, нередко развивается у детей через три месяца после рождения и имеет наследственную отягощенность.
Важно дифференцировать АтД от неонатальной эритродермии, которая проявляется у детей с шестинедельного возраста. Заболевание, маскирующееся под АтД, относится к первичным иммунодефицитам. Неонатальная эритродермия может иметь место при врожденных инфекциях, лекарственной аллергии, метаболических нарушениях, мастоцитозе и даже псориазе новорожденных.
Первичный иммунодефицит всегда сопровождается гипер-IgE-синдромом, синдромом Вискотта – Олдрича и нередко сопряжен с аллергическими проявлениями. Триада Вискотта – Олдрича представлена экземой, которая проявляется в течение первых недель жизни, тромбоцитопенией и рецидивирующими инфекциями. Экзема напоминает классический АтД, но может быть тяжелой и сопровождаться формированием корок, петехий, пурпуры.
Селективный дефицит IgA в 50% случаев также сопровождается экземой, астмой, конъюнктивитом, пищевой аллергией или аллергическим ринитом. У ребенка может развиться тяжелая анафилаксия при переливании IgA-содержащих продуктов крови. Целесообразно определять уровень IgА после четырех лет, поскольку до этого возраста показатели варьируются.
Основное отличие пищевой аллергии от других неблагоприятных реакций на продукты питания заключается в IgE-опосредованных и не-IgE-опосредованных механизмах. Побочные реакции на пищевые продукты могут быть вызваны метаболическими, фармакологическими или токсическими факторами. Пищевая аллергия не может быть причиной хронической астмы или аллергического ринита.
Нередко тесты, позволяющие выявлять антитела IgE к пище, не являются диагностическими. Золотым стандартом для подтверждения аллергии считается оральный провокационный тест. Согласно 111 проведенным провокационным тестам (44 ребенка), в пищевом рационе детей отсутствовали определенные продукты из-за положительных результатов других тестов, только в 7% случаев имела место истинная пищевая аллергия. Следовательно, 93% детей не употребляли в пищу безопасные для их здоровья продукты из-за неадекватной трактовки результатов теста.
Самая тяжелая форма пищевой аллергии – анафилаксия. Существует идиопатическая форма анафилаксии на ранее неопознанный аллерген. Нередко анафилаксия развивается на анизакиды, попадающие в организм с рыбой. Важным симптомом анафилаксии является острая боль в животе.
Тяжелая анафилаксия при попадании в организм яда пчел также может проявляться абдоминальной болью, требующей госпитализации. Истинную аллергию важно дифференцировать от системного мастоцитоза. Кровь на специфические антитела следует брать через три-четыре недели после укуса насекомых. Если тест отрицательный, надо проверить уровень триптазы.
Анафилаксия может сопровождать все аллергические заболевания. Существует так называемое правило двойки: если в первые два часа вовлеченными в процесс оказались три органа, имеет место анафилаксия. Пищевая анафилаксия через 20 минут после употребления креветок, сельдерея, хлеба может быть индуцирована физической нагрузкой.
Не-IgE-опосредованная пищевая аллергия нередко маскируется под кишечные инфекции. Поэтому следует обращать внимание на подострые и хронические симптомы, которые могут свидетельствовать о пищевом происхождении, например синдром энтероколита, вызванный пищевым белком. Сильная рвота, летаргия, иногда гипотензия и ацидоз у детей часто наблюдаются через два часа после приема пищи.
Аллергический колит, проявляющийся слизисто-кровавым стулом, равно как и синдром энтероколита, требует определения пищевых аллергических триггеров.
При энтеропатическом акродерматите высыпания под глазами, вокруг рта и ануса сопровождаются диареей. В основе развития энтеропатического акродерматита лежит дефицит цинка. В случае когда определение содержания цинка затруднено, следует оценить уровень щелочной фосфатазы, поскольку цинк входит в состав этого фермента. Если уровень щелочной фосфатазы снижен, ребенку назначают препараты цинка.
Эозинофильный эзофагит широко диагностируется за рубежом у детей и взрослых и практически не диагностируется в нашей стране. Как правило, диагностика основана на клинических и патоморфологических данных. Клинические симптомы проявляются дисфагией, изжогой, рвотой, болью в животе. У новорожденных и детей до двух лет часто наблюдаются отказ от еды, рвота, срыгивания. Дети более старшего возраста жалуются на трудности глотания. Установлено, что эозинофильный эзофагит чаще встречается у лиц мужского пола с атопией.
Различают аллергическую и неаллергическую бронхиальную астму. Педиатров должно настораживать сообщение родителей о продолжительном кашле у ребенка в раннем возрасте в отсутствие симптомов простуды. Резюмируя сказанное, профессор Д.Ш. Мачарадзе подчеркнула, что в типичных случаях диагностика крапивницы не вызывает затруднений у клиницистов. Однако при атипичных проявлениях возникают сложности дифференциальной диагностики, обусловленные вариабельностью симптомов и недостаточной информированностью практикующих врачей о редких заболеваниях и синдромах, протекающих с классическими и атипичными уртикарными высыпаниями.
Больной с атопическим дерматитом и его питание
Атопический дерматит – хроническое аллергическое воспалительное заболевание, для которого характерны зуд, возрастная морфология высыпаний, стадийность. По словам старшего научного сотрудника отделения аллергологии ФИЦ питания и биотехнологии, к.м.н. Елены Дмитриевны КУВШИНОВОЙ, этому заболеванию свойственны возрастная эволюция клинической картины – от экссудативной до пруригинозной формы, а также цикличность и сезонность.
Выделяют три основных периода болезни.
Первый – младенческий (от ноля до двух лет) с экссудативной формой АтД. Как правило, на коже щек отмечается экссудация, возникают папулы, микровезикулы, которые вскрываются и образуют дерматозные колодцы, покрывающиеся серозными, а при присоединении вторичной гнойной инфекции – гнойно-геморрагическими корочками. В этом возрастном периоде иногда наблюдается эритематозно-сквамозная форма АтД без экссудации, но с очагами эритемы, эритематозными папулами, покрытыми корочками. В распространенной форме эти элементы воспроизводятся не только на коже лица, но также на шее и сгибательных поверхностях.
Второй период – детский (от двух до 13 лет). Характеризуется возникновением эритематозно-сквамозной формы с лихенизацией.
Третий период – подростковый и взрослый (старше 13 лет). Для него характерны наличие лихеноидной и пруригинозной форм АтД с признаками хронического аллергического воспаления.
Важно дифференцировать АтД от псориаза, чесотки, ихтиоза, микробной экземы, себорейного дерматита, пеленочного дерматита.
Пеленочный дерматит связан с недостаточным уходом за ребенком. Он проявляется в виде эритемы, отечности, уртикарной сыпи в области промежности, ягодиц и бедер. Зуд отсутствует.
Себорейный дерматит вызывается грибком Рityrosporum ovale. Для него характерны эритематозные очаги с фестончатыми краями, покрытые желтыми, жирными чешуйками. Локализация: волосистая часть головы, носогубные и паховые складки. Зуд слабый или отсутствует.
Чесотка представляет собой паразитарное заболевание кожи, вызванное Sarcoptes scables. Заболевание проявляется зудящими папулами и везикулами, располагающимися линейно, попарно, с характерными чесоточными ходами и расчесами. Имеет место выраженный ночной зуд.
При микробной экземе часто наблюдается сенсибилизация к стрептококку и стафилококку. Характерны эритематозные очаги с четкими границами (1–3 см) насыщенного красного цвета. Локализация чаще асимметрична, на голени или носит распространенный характер. Зуд умеренный, начало заболевания в любом возрасте.
Ихтиоз – генодерматоз, который проявляется фолликулярным гиперкератозом, сухостью кожи, мелкопластинчатым и крупнопластинчатым шелушением, слабовыраженным зудом. Заболевание начинается в первые месяцы жизни ребенка.
Псориаз имеет аутоиммунную природу и может стартовать в любом возрасте. Он характеризуется наличием папул с быстрым образованием бляшек, покрытых серебристыми чешуйками, на волосистой части головы, в естественных складках кожи или местах трения.
Основным терапевтическим мероприятием при пищевой аллергии считается диетотерапия. Детям с пищевой аллергией назначается общая гипоаллергенная диета. Из пищевого рациона исключаются цельное коровье молоко, цитрусовые, манная крупа, оливки, рыба, шоколад, кофе, колбаса, клубника, малина, хрен, редька, баклажаны, уксус, горчица. Рекомендуется употреблять кисломолочные продукты без фруктовых добавок, из круп – гречку, рис, овсянку, овощи и фрукты светлой окраски, овощные супы.
Как известно, основными триггерами пищевой аллергии являются БКМ (казеин, бычий сывороточный альбумин альфа-лактальбумин, бета-лактоглобулин), яйцо (овальбумин, овомукоид, овотрансферрин, лизоцим), в злаках – глютен и белок сои. У детей первого года жизни с аллергией к БКМ, находящихся на смешанном и искусственном вскармливании, смеси на основе коровьего молока заменяются лечебными смесями на основе высокогидролизованных молочных белков. В зависимости от субстрата гидролиза они могут быть сывороточными и казеиновыми. Выбор по субстрату гидролиза определяется данными аллергологического обследования. При повышенной чувствительности к БКМ и сывороточным БКМ ребенку назначают казеиновые гидролизаты, при аллергии к казеину – сывороточные гидролизаты.
При неэффективности смеси на основе полного гидролиза применяются аминокислотные смеси. Абсолютным показанием к назначению аминокислотных смесей являются прежде всего тяжелый АтД с задержкой развития, гипоальбуминемия или железодефицитная анемия, желудочно-кишечные симптомы с хронической диареей, рвотой, отказом от еды, отставанием в физическом развитии, энтеропатией с потерей белка.
Кроме того, аминокислотные смеси назначаются детям с бронхиальной обструкцией или острым отеком гортани, обусловленными приемом молочных продуктов, а также при анафилаксии.
Лечебной диеты с исключением БКМ из пищевого рациона следует придерживаться в течение шести месяцев, а при наличии тяжелых реакций – не менее 12–18 месяцев. Максимальная продолжительность безмолочной диеты без повторного обследования не должна превышать 12 месяцев. Продукты, содержащие молочный белок, целесообразно вводить после контроля уровня специфических IgE-антител в крови, который обычно проводят спустя шесть месяцев от начала безмолочной диеты.
Смеси на основе изолята сои не являются продуктами первого выбора в остром периоде аллергии к БКМ. Они применяются у детей в возрасте старше шести месяцев при нетяжелых проявлениях аллергии к БКМ и отсутствии гастроинтестинальных нарушений и сенсибилизации к белку сои.
Современные представления об оптимальном формировании пищевой толерантности предполагают введение прикорма в возрасте от четырех до шести месяцев. Каждый новый продукт вводят постепенно, на его адаптацию отводится одна-две недели. Предпочтение отдается монокомпонентным продуктам. Новый продукт включается в пищевой рацион ребенка в минимальных количествах – не более 5 мл (г), предпочтительно в утреннее кормление, чтобы в течение дня можно было понаблюдать за реакцией. В отсутствие аллергической реакции объем продукта ежедневно увеличивается на 10–30 г в течение пяти – семи дней.
В зависимости от нутритивного статуса ребенка и характера стула первым прикормом обычно становится овощное пюре или безмолочная каша. При дефиците массы тела в качестве первого прикорма может быть введена безмолочная безглютеновая каша (гречневая, кукурузная, рисовая), затем вводятся овощи. С целью коррекции белковой части рациона меню ребенка расширяется за счет мясного пюре.
Безглютеновая диета, назначаемая детям с пищевой аллергией, подразумевает исключение из рациона овса, пшеницы, манной крупы, перловой крупы, ячменя, ржи, а также продуктов, содержащих глютен. Это мясопродукты (сосиски, сардельки), хлебобулочные продукты, конфеты, полуфабрикаты, кондитерские изделия, молочные продукты и глютенсодержащие добавки.
В основе современной диетотерапии лежит персонифицированный подход. Принципы современной диетотерапии заключаются в элиминации пищевого продукта только при строгой доказанности его аллергенности, с его полноценной заменой другим продуктом, не уступающим по питательной ценности и калорийности, и исключением из рациона продуктов с высоким аллергизирующим потенциалом (орехи, мед, морепродукты, цитрусовые, шоколад).
Диетотерапия должна обеспечивать все физиологические потребности организма в энергии, основных пищевых веществах, витаминах и минералах. При этом необходимо соблюдать квоту белка, количество жира не должно превышать 30% суточной калорийности рациона.
Гастроинтестинальные симптомы в практике аллерголога
По мнению старшего научного сотрудника отделения аллергологии ФИЦ питания и биотехнологии, к.м.н. Инны Анатольевны ЛАРЬКОВОЙ, сегодня в реальной клинической практике имеет место не только гипердиагностика клинически не значимых реакций на пищевые аллергены, но и гиподиагностика истинной пищевой аллергии. Гастроинтестинальные проявления долго не распознаются или оцениваются неадекватно.
Механизмы возникновения
В основе развития гастроинтестинальных проявлений пищевой аллергии лежат IgE-опосредованные и не-IgE-опосредованные аллергические реакции. К IgE-опосредованным гастроинтестинальным проявлениям пищевой аллергии относят оральный аллергический синдром, гастроинтестинальную анафилаксию, к клеточно-опосредованным – пищевой проктоколит, пищевой энтероколит, энтеропатию. Эозинофильный эзофагит, эозинофильный гастроэнтерит и колит развиваются вследствие сочетанных IgE-опосредованных и клеточных реакций.
Клинические варианты
Оральный аллергический синдром проявляется в любом возрасте зудом, першением, отеком в полости рта. Гастроинтестинальные симптомы стандартно характеризуются тошнотой, рвотой, болью в животе и диареей, вызванной приемом пищи. У детей раннего возраста имеют место беспокойство после еды, обильные срыгивания, отказ от еды.
При анафилаксии на фоне многосистемных реакций возникают гастроинтестинальные симптомы (тошнота, рвота, боль в животе, диарея).
Индуцированный пищей проктоколит манифестирует у детей первого года жизни и сопровождается наличием слизи и крови в стуле в отсутствие других симптомов.
Индуцированный пищевыми белками синдром энтероколита (БКМ, яйцо, соя, рис) чаще развивается у детей первого года жизни, с первого месяца. Синдром энтероколита сопровождается профузной или интермиттирующей рвотой, диареей, кровью и слизью в стуле, метеоризмом, метаболическим ацидозом, болью в животе, анемией, гипопротеинемией, отсутствием прибавки в весе, дегидратацией и гиповолемией. Может быть острым и хроническим.
Нередко при индуцированном пищевыми белками энтероколите в классическом варианте sIgЕ отсутствуют, в атипичном – выявляются. Дифференциальная диагностика затруднена, приходится исключать инфекционные заболевания желудочно-кишечного тракта (ЖКТ), паразитарные инфекции, иные проявления пищевой аллергии, дисахаридазную недостаточность, болезнь Гиршпрунга, инвагинации, гастроэзофагеальную рефлюксную болезнь (ГЭРБ), кишечную непроходимость, целиакию, воспалительные заболевания кишечника (ВЗК), наследственные нарушения обмена веществ.
Индуцированная пищевыми белками энтеропатия (БКМ, соя, яйцо, пшеница) зачастую манифестирует у детей младше девяти месяцев. Ее симптомы проявляются в виде рвоты, диареи, стеатореи, отсутствия прибавки в весе и росте, тошноты, метеоризма, крови в стуле, анемии. Отличительные особенности такой энтеропатии при морфологическом исследовании – поражение ворсинок, гиперплазия крипт. Индуцированную пищевыми белками энтеропатию необходимо дифференцировать от протеин-теряющей энтеропатии, аутоиммунной энтеропатии, дисахаридазной недостаточности, панкреатической недостаточности, первичного иммунодефицита, других проявлений пищевой аллергии, синдрома приобретенного иммунодефицита, лимфангиоэктазии кишечника, врожденной патологии эпителия, наследственных нарушений обмена веществ.
Эозинофильный эзофагит может встречаться во всех возрастных группах. Его клиническими признаками являются рвота, срыгивание, боль в животе, отказ от еды, дисфагия, ахалазия, снижение аппетита, чувство быстрого насыщения, стриктуры. Эозинофильный эзофагит дифференцируют от функциональных нарушений у детей раннего возраста, пороков развития, ГЭРБ.
Эозинофильный гастроэнтерит развивается в любом возрасте, чаще у взрослых. Его симптомы – боль в животе, рвота, тошнота, диарея, вздутие живота, асцит, потеря массы тела, анемия. Эозинофильный гастроэнтерит трудно дифференцировать от других проявлений пищевой аллергии (индуцированной пищевыми белками энтеропатии, энтероколита).
При проведении дифференциальной диагностики в ряде случаев приходится исключать инфекционный гастроэнтерит, паразитарные инфекции, другие проявления пищевой аллергии, ВЗК, системные заболевания, заболевания соединительной ткани, мастоцитоз, карциному, лимфому, аллергию на лекарственные препараты.
Считается, что эозинофильный колит чаще встречается у взрослых, однако множество работ свидетельствует о его наличии у детей раннего возраста. Он сопровождается болью в животе, диареей с кровью и слизью, потерей массы тела и анемией.
Эозинофильный колит может сочетаться с болезнью Крона, неспецифическим язвенным колитом и лимфоидным колитом. Его следует дифференцировать от инфекционного колита, паразитарных инфекций, ВЗК, других проявлений пищевой аллергии.
При эозинофильных заболеваниях в 50% случаев могут обнаруживаться специфические IgE к пищевым аллергенам. Тем не менее симптомы отсроченные. Пациенты наблюдаются как больные с гастропатологией. В течение нескольких дней могут возникать тошнота, рвота, боль в животе, но острые эпизоды тяжелой, повторяющейся рвоты или вялости не характерны.
Дифференциальная диагностика
Правильная трактовка характера диареи позволяет сузить круг дифференциально-диагностического поиска. Так, разжиженный пенистый стул с кислым запахом наблюдается при дисахаридазной недостаточности и глюкозно-галактозной мальабсорбции, водная диарея – при инфекциях и инвазиях, постинфекционном энтерите, дисахаридазной недостаточности, глюкозно-галактозной мальабсорбции, пищевой аллергии, дискинезии ЖКТ, при некоторых гормонпродуцирующих опухолях, мастоцитозе, хлоридной диарее, врожденной натриевой диарее.
Жирный стул имеет место при экзокринной недостаточности поджелудочной железы, патологии кишечника, в том числе целиакии, герпетиформном дерматите, постинфекционном энтерите, очень жирный стул с эпизодами выпадения слизистой оболочки прямой кишки с характерным запахом при выраженной экзокринной недостаточности поджелудочной железы – муковисцидозе и врожденной липазной недостаточности. Выраженная полифекалия, нередко проявляющаяся серым жирным стулом, характерна при целиакии, герпетиформном дерматите, энтеропатическом акродерматите, пищевой аллергии.
Дифференциальная диагностика гастроинтестинальной пищевой аллергии проводится с синдромом мальабсорбции при наследственной (10%) и приобретенной патологии.
Клинический случай
Больная Е., четыре года. Поступила в отделение аллергологии ФИЦ питания и биотехнологии с жалобами на постоянную ежедневную боль в животе, метеоризм, неустойчивый стул с примесью слизи (в том числе в большом количестве), реже с алой кровью, избирательный аппетит, умеренную заложенность носа. Из анамнеза: наследственность по аллергическим заболеваниям отягощена: у старшего родного брата – поллиноз, пищевая аллергия, с десяти лет – неспецифический язвенный колит, у дедушки по линии матери – аллергический ринит, у матери – синдром раздраженного кишечника.
Девочка от второй беременности (обе беременности разрешились оперативно). С рождения находилась на смешанном вскармливании молочной смесью (безлактозный НАН). Попытка ввести гидролизованную смесь не увенчалась успехом – ребенок от питания отказался, вследствие чего мать продолжила докорм молочной смесью. Прикорм был введен с восьми месяцев, поскольку при более раннем введении отмечались ухудшение стула и метеоризм. Прививки – БЦЖ в роддоме. Перенесенные заболевания – редко острые респираторные вирусные инфекции.
Первые проявления симптомов – с рождения в виде колик, снижения аппетита (отказ от еды), метеоризма, разжиженного стула со слизью, зеленью, затем – стула со склонностью к запорам. В полуторамесячном возрасте появилась кровь в стуле, что расценивалось как аллергия на БКМ. Кормящей матери назначили безмолочную диету, которую она соблюдала, но ребенку гидролизованную смесь ввести не удалось.
На первом году жизни кровь в стуле девочки отмечалась чаще, чем на втором. На третьем году жизни имел место всего один эпизод на фоне более редких симптомов метеоризма и боли в животе. В возрасте 3,6 года у ребенка вновь появились редкие эпизоды алой крови в стуле, метеоризм и боль в животе стали постоянными, запоры сменились неустойчивым стулом, эпизодически со слизью. Четкая связь между этими явлениями и использованием того или иного продукта не прослеживалась, но на фоне уменьшения приема молочной продукции после трех лет наблюдалось некоторое улучшение состояния.
У ребенка с рождения отмечались симптомы АтД. По словам матери, улучшение течения АтД наблюдалось на фоне применения антибиотиков. С ноября 2017 г. до момента госпитализации (в течение пяти месяцев) имела место ремиссия АтД. Кроме того, улучшение гастроинтестинальных симптомов (болевого синдрома, слизи, метеоризма) имело место на фоне антибактериальной терапии (Сумамед, Зиннат). Ухудшение было зафиксировано лишь на фоне применения Аугментина. Всего проведено 12 курсов антибактериальной терапии. Между тем у ребенка с одного года эпизодически отмечалась заложенность носа, в два месяца – повышенная сенсибилизация к молочному белку.
Пациентке Е. в возрасте 11 месяцев в ФИЦ питания и биотехнологии был поставлен диагноз «гастроинтестинальная форма пищевой аллергии». Рекомендаций специалистов о безмолочной диете мать придерживалась не всегда.
Поскольку симптомы сохранялись, в год два месяца девочке провели колоноскопию. Неспецифический язвенный колит исключен. Ребенок неоднократно проходил стационарное обследование (колоноскопия, эзофагогастродуоденоскопия (ЭГДС), определение уровня кальпротектина). Полученные данные не подтвердили наличие у ребенка ВЗК. При очередном обследовании в 3,6 месяца (колоноскопия) неспецифический язвенный колит и болезнь Крона исключены. Кроме того, анализ на наследственную аминоацидопатию, органическую ацидурию, нарушения митохондриального бета-окисления не дал положительного результата.
В отделении аллергологии Центра питания и биотехнологии проведено обследование. Общий анализ крови – без патологии, биохимический анализ крови – в пределах референсных значений, иммунологический анализ крови, в том числе уровень общего IgE, – в норме, сенсибилизация к БКМ, глютену, пшенице, мясу, яйцу, сое не обнаружена. УЗИ органов брюшной полости – дискинезия желчевыводящих путей, УЗИ почек – изменений не выявлено.
Анализ кала: стул неоформленный, умеренное количество крахмала, жирных кислот, слизи, дисбиоз, снижение количества бифидо- и лактобактерий, уровень кальпротектина и эластазы в норме. Анализ крови: антитела к сальмонеллам, шигеллам, псевдотуберкулезу, иерсиниозу, простейшим и гельминтам, сахаромицетам и аутоантитела pANCA не выявлены. Обеспеченность витамином D маргинальная. Учитывая анамнез пациентки, был проведен анализ кала на антигены токсина А и В Clostridium difficile. Результат положительный.
Диагноз: инфекция, вызванная C. difficile, пищевая аллергия, персистирующий аллергический ринит, АтД – стадия ремиссии, дисфункция билиарного тракта на фоне деформации желчного пузыря (перегиб тела).
Пациентке назначена безмолочная диета, по рекомендации инфекциониста проведены курсы терапии метронидазолом 30 мг/кг/сут в три приема, а также S. boulardii по одному порошку два раза в день в течение семи дней с последующим контролем на наличие токсинов. При наличии более двух рецидивов – длительное лечение ванкомицином. В дальнейшем – терапия мультипробиотиком Бак-Сет Форте.
C. difficile – грамположительная, спорообразующая, цитотоксинпродуцирующая бацилла, основным фактором риска развития которой является антибиотикотерапия и ВЗК. Инфекция способна мимикрировать и потенцировать симптомы пищевой аллергии. При появлении у пациента новых симптомов, повышении уровня кальпротектина, развитии анемии, гипопротеинемии, отставании в весе и росте, отсутствии эффекта от диетотерапии врачу следует пересмотреть диагноз и/или расширить диагностический поиск.
Трудный пациент в детской аллергологической практике. Клинические случаи
Как отметил сотрудник отделения аллергологии ФИЦ питания и биотехнологии Валерий Алексеевич МУХОРТЫХ, родители обычно обращаются с жалобами на метеоризм, срыгивание, колики, беспокойный сон, боль в животе, высыпания, отеки, неустойчивый характер стула у детей. Зачастую педиатры длительно не распознают гастроинтестинальные признаки пищевой аллергии, диагностируют функциональные нарушения ЖКТ, дисбактериоз кишечника, лактазную недостаточность. В связи с этим необоснованно отменяется грудное вскармливание, назначаются безлактозные, кисломолочные, соевые смеси, диета.
Клинический пример 1. Пациент Т., 12 месяцев. Срыгивание, метеоризм, неустойчивый стул (эпизодически разжиженный), высыпания на коже, сопровождающиеся зудом. Из анамнеза: наследственность по аллергическим заболеваниям отягощена – у отца реакция на пыль и лекарственная непереносимость, у сестры отца – АтД. Ребенок от первой беременности, протекавшей на фоне слабости родовой деятельности, родоразрешение путем кесарева сечения. Все при рождении – 4150 г, рост – 54 см, оценка по шкале Апгар – 8/9 баллов.
Исключительно на грудном вскармливании мальчик находился в течение первых двух недель, на смешанном – до 4,5 месяца, затем – на искусственном. Были перепробованы разные смеси, включая аминокислотные, которые ребенок получает по настоящее время. При введении прикорма с шести месяцев мать отмечала у ребенка удовлетворительную переносимость кабачков, при использовании остальных продуктов прикорма (даже в малых количествах) – высыпания. Высыпаниями проявилась и лекарственная аллергия. По профилактическим прививкам – медицинский отвод.
Первые проявления аллергии в виде частых срыгиваний, колик, метеоризма наблюдались с рождения и сохранялись до шести месяцев. С одномесячного возраста мать отмечала распространенные высыпания, без зуда, что расценивалось педиатром как аллергическая реакция на питание матери, которой была рекомендована строгая безмолочная диета. Однако мальчику назначали молочные смеси, которые из-за отсутствия положительной динамики как со стороны кожи, так и со стороны гастроинтестинальных проявлений постоянно менялись (одну молочную смесь заменяли другой). При переходе на гипоаллергенные смеси состояние ребенка ухудшалось.
В шесть месяцев ребенку назначили полный гидролизат, на фоне которого уменьшились и кожные, и гастроинтестинальные проявления. Через месяц отмечалось незначительное ухудшение состояния кожных покровов, в связи с чем педиатр рекомендовал заменить смесь на аминокислотную. Ее ребенок получает по настоящее время.
С одной стороны, на фоне приема данной смеси удалось полностью купировать кожные и гастроинтестинальные проявления, с другой – не представляется возможным расширить рацион питания, поскольку при попытках введения каш, мяса кожный процесс обостряется. В качестве прикорма ребенок получает только один продукт (кабачок).
В возрасте 7,5 месяца мальчика обследовали на дисбактериоз. Получал терапию бактериофагами, прошел курс ферментотерапии без положительного эффекта.
На момент поступления ребенка в отделение аллергологии ФИЦ питания и биотехнологии в его рационе присутствовали аминокислотная смесь и овощное пюре (кабачок). При осмотре: состояние средней степени тяжести, кожные покровы сухие, с распространенными эритематозными высыпаниями. Живот вздут, мягкий и безболезненный при пальпации. Стул регулярный, кашицеобразный, периодически со слизью.
Общий анализ крови – эозинофилия (11%), протеинограмма – снижение глобулиновой фракции (11,9 г/л при норме 20–25 г/л). В иммунологическом анализе крови снижены уровни иммуноглобулинов A, G, M, уровень IgЕ выше нормы (232 МЕ/мл, норма – 100 МЕ/мл). УЗИ органов брюшной полости – признаки вторичных изменений поджелудочной железы, S-образная деформация желчного пузыря. Специфические IgE-антитела к БКМ, глютенам, капусте белокочанной, баранине, кабачку, кролику, курице, гречке, рису – нулевой класс аллергии.
С учетом результатов анализа ребенка направили в НИИ иммунологии на консультацию врача-иммунолога. Подозрение на первичный иммунодефицит потребовало дообследования – контроль уровней иммуноглобулинов A, G, M через три месяца с последующим решением вопроса о дальнейшей тактике лечения.
В период госпитализации ребенка предпринимались попытки расширить рацион за счет мяса индейки, кролика, гречневой каши. Однако даже при использовании продуктов в малых дозах усиливались кожные и гастроинтестинальные проявления. Из-за подозрения на иммунодефицит ребенок должен наблюдаться в специализированном отделении. Расширение рациона возможно и на фоне проведения патогенетической терапии.
Клинический пример 2. Пациент Д., год четыре месяца. Поступил с жалобами на колики, вздутие живота, слабость, плохой сон, стул с непереваренными кусочками пищи и слизью, высыпания, не сопровождающиеся зудом. Из анамнеза: наследственность по аллергическим заболеваниям отягощена – у матери и ее родной сестры поллиноз. Ребенок от первой беременности, протекавшей физиологически, роды самостоятельные. Первый месяц жизни находился на грудном вскармливании, до года двух месяцев – на искусственном (Симилак). При введении прикорма в шесть месяцев реакций не отмечалось.
В год два месяца у ребенка появились жалобы на сильное вздутие живота. После обращения в больницу г. Ростова последовала госпитализация в инфекционное отделение с диагнозом «острый неуточненный энтероколит в тяжелой форме с токсико-эксикозом 1-й степени; дисферментоз». Со слов матери, на фоне лечения (три курса антибактериальных препаратов) состояние ухудшилось, вздутие живота усилилось, появился жидкий стул со слизью и непереваренными остатками пищи до 15 раз в сутки.
На фоне обезвоживания ребенок находился в отделении реанимации, где была продолжена антибиотикотерапия и проведена коррекция питания – смесь Симилак отменили. После отмены смеси стул нормализовался, вздутие живота уменьшилось, однако сохранялись примеси слизи и непереваренных остатков пищи. Была рекомендована коррекция питания. Тем не менее при использовании безмолочных каш и фруктов вздутие живота сохранялось.
ЭГДС показала умеренно выраженный дуоденит, при гистологическом исследовании фрагментов тощей кишки – хронический выраженный еюнит. Такая морфологическая картина характерна для синдрома мальабсорбции.
На фоне лечения (безмолочная диета с ограничением глютеновых продуктов, инфузионная терапия глюкозо-солевыми растворами с включением новокаина, Но-шпы, преднизолона и дексаметазона, Макмирора, Креона, Эспумизана, Мотилиума) отмечалась положительная динамика – вздутие живота уменьшилось, ребенок стал спокойнее, прибавил 500 г, стул кашицеобразный со слизью и небольшим количеством непереваренной пищи.
Ребенка госпитализировали в отделение аллергологии ФИЦ питания и биотехнологии. При обследовании показатели общего и биохимического анализов крови в норме, уровень общего IgA – 13 МЕ/мл. УЗИ органов брюшной полости выявило признаки дискинезии желчевыводящих путей, вторичных изменений поджелудочной железы. С помощью экспресс-теста (Celiac-test) обнаружены положительные антитела IgA к трансглутаминазе. При аллергообследовании уровня специфических IgE к пищевым аллергенам сенсибилизация к БКМ, глютену не выявлена.
ЭГДС с биопсией тонкой кишки: структура слизистой оболочки тощей кишки характерна для нелеченой целиакии – имела место полная атрофия кишечных ворсинок с гипертрофией крипт, несколько увеличено число межэпителиальных лимфоцитов, в собственной пластинке повышенное содержание лимфоцитов и плазматических клеток. Заключение: целиакия, острая стадия.
Ребенку назначена пожизненная безглютеновая диета с введением в рацион молочных продуктов. Через месяц при контрольном осмотре на фоне строгой аглютеновой диеты родители отмечали значительное улучшение состояния ребенка: колики не беспокоили, стул стал ежедневным, вздутие живота уменьшилось.
Клинический пример 3. Пациент С., семь лет. Поступил с жалобами на периодическую боль в животе, срыгивание, рвоту, метеоризм, неприятный запах изо рта, изменения в копрограмме (стеаторея). Из анамнеза: наследственность по аллергическим заболеваниям отягощена – у отца пищевая аллергия, лактазная недостаточность, у бабушки – бронхиальная астма. Мальчик от первой беременности, протекавшей с угрозой прерывания. Мать до 20 недель беременности получала гормонотерапию. Ребенок находился на грудном вскармливании в течение первых трех недель, затем – на искусственном. Прикорм вводился с пяти месяцев.
У ребенка с года отмечались жалобы на колики, неоформленный стул со слизью и непереваренными остатками пищи, выраженную стеаторею, метеоризм, что расценивалось педиатром как синдром мальабсорбции. Мальчику неоднократно заменяли одну молочную смесь другой. Ферментотерапия – без положительного эффекта. В двухмесячном возрасте ребенка перевели на вскармливание гидролизатами, проявления со стороны ЖКТ сохранялись. В девять месяцев на фоне сохранения гастроинтестинальных проявлений, стеатореи ребенка впервые обследовали на муковисцидоз. Потовая проба отрицательная. Был также исключен диагноз целиакии, синдром Швахмана – Даймонда.
Со слов матери, состояние улучшилось на фоне приема ферментов. Их отмена сопровождалась ухудшением состояния, проблемами со стулом (разжиженный, со слизью, пенистый). Ребенка неоднократно госпитализировали в разные стационары с синдромом мальабсорбции, где исключались неспецифический язвенный колит, болезнь Крона. Пищевая аллергия не диагностирована. Только в пять лет ребенок впервые попал к аллергологу. Проведено аллергологическое обследование: специфические IgE к различным продуктам (БКМ, гречиха, свинина, картофель, груша, желток, кролик, капуста) не выявлены. Однако аллерголог принял решение о назначении безмолочной диеты. На фоне ее применения жалобы разной интенсивности сохранялись.
Мальчика направили на консультацию в отделение аллергологии ФИЦ питания и биотехнологии. При обследовании выявлен повышенный уровень IgE – 303 МЕ/мл. УЗИ органов брюшной полости: признаки дискинезии желчевыводящих путей, вторичных изменений поджелудочной железы. При исследовании сыворотки крови на уровень специфических IgE-антител к пищевым аллергенам установлена высокая степень сенсибилизации к глютену. Сенсибилизация к коровьему молоку, гречке, рису, индейке, баранине, свинине, кролику не выявлена.
На основании результатов анализа ребенку назначили диагностическую безглютеновую диету в течение месяца с постепенным введением в рацион молочных продуктов. Через месяц при контрольном осмотре на фоне строгой безглютеновой диеты родители отмечали значительное улучшение: колики не беспокоили, стул стал ежедневным без патологических примесей. Было рекомендовано продолжить безглютеновую диету до полугода.
Следует отметить, что в этой семье у полуторагодовалого младшего брата с выраженными проявлениями АтД и небольшими гастроинтестинальными симптомами (неустойчивый стул) мать самостоятельно исключила из пищевого рациона глютен и наблюдала выраженный положительный эффект.
Клинический пример 4. Пациентка Е., три года. Периодические высыпания, сопровождающиеся кожным зудом. Ребенок от второй беременности, протекавшей физиологически. До четырех месяцев – грудное вскармливание, затем искусственное (молочные смеси). Прикорм вводился с пяти месяцев, переносимость удовлетворительная. Профилактические прививки проводились согласно национальному календарю. Наследственность по аллергическим заболеваниям отягощена: у родного брата эпизоды крапивницы, пищевая аллергия.
Первые проявления аллергии отмечались в возрасте одного месяца в виде мелкоточечных заболеваний, покраснений кожи на фоне гипоаллергенной диеты кормящей матери. В возрасте года четырех месяцев девочка перенесла острый энтероколит, вызванный Enterobacter aerogenes (подтвержденный бактериологически и клинически). Получала антибактериальную и симптоматическую терапию. Спустя две недели от начала терапии появилась пятнисто-папулезная сыпь.
В аллергологическом отделении диагностированы АтД, лямблиоз, синдром избыточного бактериального роста. Девочка получала антигистаминную наружную терапию (крем Унна, Циндол), антибактериальную (Хемомицин) и противогельминтную (Немозол) терапию. На фоне терапии постоянно менялся характер сыпи (появлялись герпетические высыпания, элементы вторичного инфицирования). При выписке домой на фоне отмены всех препаратов, за исключением антигистаминных, отмечалось улучшение. До лета 2017 г. выраженных обострений дерматита не наблюдалось. До марта 2018 г. находилась на строгой гипоаллергенной диете (безмолочной, безглютеновой) – без значимого эффекта.
При иммунологическом обследовании у ребенка выявлено снижение уровней Т-лимфоцитов, фагоцитоза, фагоцитарного числа, циркулирующих иммунных комплексов. В сентябре 2017 г. врач-иммунолог диагностировал врожденный иммунодефицит, снижение гуморального иммунитета. Девочка получала Имунофан, Полиоксидоний, Ликопид, Эриус с незначительной положительной динамикой. С января 2018 г. – постепенное расширение рациона за счет молочных продуктов, банана. Переносимость была удовлетворительной.
Состояние кожных покровов у ребенка ухудшается в весенне-летний период (с мая по сентябрь). Высыпания стадийны: в течение недели появляется гиперемия на коже, затем пузырь с жидким прозрачным содержимым, далее он лопается и наступает ремиссия. Локализация – на верхних и нижних конечностях. Кожный зуд, болезненность, высыпания горячие на ощупь.
В июне 2018 г. находилась на обследовании в отделении аллергологии клиники ФИЦ питания и биотехнологии. Выявлен 3-й класс аллергии к полыни. Через две недели после выписки из стационара и по настоящее время у ребенка имеют место полиморфные высыпания на коже, сопровождающиеся кожным зудом.
Последнее обострение наблюдалось в сентябре 2018 г. Девочка была госпитализирована в отделение аллергологии ФИЦ питания и биотехнологии. При комплексном обследовании у ребенка выявлен высокий уровень IgE – 776 МЕ/мл (норма до 100 МЕ/мл). УЗИ: признаки дискинезии желчевыводящих путей. Анализ на наличие вирусов методом ПЦР отрицательный. При исследовании уровня специфических IgE-антител к пищевым, бытовым, пыльцевым аллергенам выявлен 4-й класс аллергии к полыни. Точный диагноз не установлен, предположительный – атипичная реакция кожи на цветение полыни. Девочка находится под наблюдением специалистов.
Заключение
Многообразие клинических симптомов с широким спектром причинно-значимых аллергенов затрудняет диагностику и снижает эффективность терапии аллергических заболеваний у детей. Частота дисбиотических нарушений у детей с пищевой аллергией достигает 94%, поэтому оптимизация ведения таких пациентов предусматривает включение в схему терапии пробиотиков с доказанной эффективностью.
Мультиштаммовые пробиотики Бак-Сет Беби и Бак-Сет Форте зарекомендовали себя как эффективное и безопасное средство для коррекции нарушений кишечной микробиоты у детей разного возраста.
Бак-Сет Беби, содержащий семь видов бактерий и пребиотик, разрешен к применению у детей с рождения. Бак-Сет Форте, в состав которого входят 14 штаммов пробиотических бактерий, предназначен для коррекции нарушений стула и подавления атопических и воспалительных реакций у детей старше трех лет.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.