Интенсивность острой боли и изменения вариабельности сердечного ритма при проведении тонзиллэктомии
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Проанализированы два метода анестезиологического пособия при тонзиллэктомии: местная аппликационно-инфильтрационная анестезия (МА) (первая группа – 30 пациентов) и сочетание МА и тотальной анестезии (вторая группа – 35 пациентов). Во всех случаях МА использовали 1%-ный раствор лидокаина. Интенсивность боли в миллиметрах оценивали по визуальной аналоговой шкале. О вариабельности сердечного ритма судили по результатам периоперационного холтеровского мониторирования электрокардиограммы.
Результаты. В первой группе зафиксирована более высокая интенсивность болевого синдрома, а также большее напряжение вегетативной нервной системы, по данным анализа SDNN, SDANN, SDNNidx, rMSSD. В первой группе имела место тенденция к симпатикотонии, во второй – парасимпатикотония.
Заключение. По сравнению с тотальной анестезией местная вызывает большие стресс-реакции при проведении тонзиллэктомии. Необходимо продолжить поиск анестезиологических средств, позволяющих свести к минимуму стресс-ответ при тонзиллэктомии.
Материал и методы. Проанализированы два метода анестезиологического пособия при тонзиллэктомии: местная аппликационно-инфильтрационная анестезия (МА) (первая группа – 30 пациентов) и сочетание МА и тотальной анестезии (вторая группа – 35 пациентов). Во всех случаях МА использовали 1%-ный раствор лидокаина. Интенсивность боли в миллиметрах оценивали по визуальной аналоговой шкале. О вариабельности сердечного ритма судили по результатам периоперационного холтеровского мониторирования электрокардиограммы.
Результаты. В первой группе зафиксирована более высокая интенсивность болевого синдрома, а также большее напряжение вегетативной нервной системы, по данным анализа SDNN, SDANN, SDNNidx, rMSSD. В первой группе имела место тенденция к симпатикотонии, во второй – парасимпатикотония.
Заключение. По сравнению с тотальной анестезией местная вызывает большие стресс-реакции при проведении тонзиллэктомии. Необходимо продолжить поиск анестезиологических средств, позволяющих свести к минимуму стресс-ответ при тонзиллэктомии.


В хирургической оториноларингологии тонзиллэктомия является одним из распространенных хирургических вмешательств. Так, по данным Американской ассоциации оториноларингологии, удаление миндалин – второе по частоте выполнения хирургическое вмешательство [1]. Несмотря на улучшение анестезиологического пособия и хирургической техники, проблемы послеоперационной боли и стресса не утрачивают актуальности и сегодня [1]. Внедрение электрокоагуляционной хирургической техники практически исключило риск послеоперационного кровотечения, но не исключило полностью вероятность развития боли, дискомфорта вследствие местного воспаления, раздражения нервных окончаний и ларингоспазма [2]. После операции пациенты, как правило, испытывают одинофагию (сильную боль при глотании пищи). У них меняется пищевое поведение и снижается физическая активность [3].
Послеоперационный период способен спровоцировать развитие заболеваний и осложнений [3]. Период восстановления с характерной симптоматикой после тонзиллэктомии у взрослых может длиться до двух недель [4]. Иногда дисфагия ограничивает прием пищи и в ряде случаев приводит к обезвоживанию, требующему инфузионной терапии. В 20% случаев обезвоживание становится причиной повторных обращений к врачу [5–7].
Сильная боль – одна из наиболее заслуживающих внимания жалоб после тонзиллэктомии. Как известно, интенсивность боли зависит от хирургической техники [6, 8, 9] и фармакологического подхода к лечению боли [10, 11]. Существует несколько типов боли после тонзиллэктомии. Чаще боль имеет убывающий характер, реже ее интенсивность нарастает в первые несколько дней после операции [12]. В ряде случаев выраженность боли снижается через неделю после операции, иногда боль сохраняется в течение двух недель и более [12]. Отдельная группа пациентов с самого начала испытывает очень сильную боль. Со временем ее интенсивность постепенно уменьшается [12].
Безусловно, послеоперационный стресс и болевой синдром взаимосвязаны [13]. Боль провоцирует изменения и нарушения деятельности легочной, сердечно-сосудистой, нейроэндокринной систем, желудочно-кишечного тракта, иммунологических и метаболических функций [14–16]. Многие авторы считают важной роль вегетативной нервной системы в формировании различных механизмов боли с участием главным образом соматосимпатических рефлексов [17–23] с помощью биомаркеров симпатоадреналовой системы. В частности, имеются в виду плазменные катехоламины и кортизол, измерение уровней которых используется как физиологический показатель степени стресса и боли [24, 25]. Однако эти инвазивные методы забора проб крови не обеспечивают эффективного контроля боли в отделении интенсивной терапии [26]. Колебания частоты сердечных сокращений и уровня артериального давления, обычно используемые в качестве признаков ноцицепции во время анестезии, выражаются в изменении вариабельности сердечного ритма (ВСР) [27], что отражает взаимодействие вегетативных, гуморальных и прочих внутренних факторов, влияющих на частоту сердечных сокращений [28]. ВСР широко используется в качестве неинвазивного маркера вегетативного воздействия на сердечную деятельность [29]. Однако авторами многих исследований установлена связь между вегетативной нервной системой и острой болью [30–33].
Материал и методы
В исследование было включено 65 пациентов с хроническим тонзиллитом в возрасте от 18 до 56 лет. 30 пациентам (18 женщин и 12 мужчин) первой группы тонзиллэктомию проводили под местной инфильтрационной анестезией, 35 пациентам (10 мужчин и 25 женщин) второй – под общей и местной анестезией.
В первой группе в начале хирургического вмешательства после аппликационной анестезии 10%-ным раствором лидокаина проводили местную инфильтрационную анестезию 1%-ным раствором лидокаина. Во время анестезии пациенты находились в сидячем положении. Анестетик вводили в пяти точках: над верхним полюсом миндалины, в месте схода небно-язычной и небно-глоточной дужек, в области верхнего полюса миндалины, в области среднего полюса миндалины, в области нижнего полюса миндалины (у основания небно-язычной дужки, в проекции восьмого нижнего зуба), в области небно-глоточной дужки миндалины. Последующую тонзиллэктомию выполняли в соответствии с классической техникой.
Во второй группе использовали тотальную внутривенную анестезию 1%-ным раствором пропофола и интубационную искусственную вентиляцию легких с помощью 8%-ной газовой смеси севофлурана и кислорода (5 л/мин), местно – 1%-ный раствор лидокаина. Тонзиллэктомия начиналась с разреза слизистой оболочки скальпелем у основания передней небной дужки слева (0,5–0,7 см). Далее выделяли небную миндалину. Миндалину брали на зажим, отводили кверху и острым распатором отсепаровывали от небно-язычной и небно-глоточных дужек, начиная с нижнего полюса, постепенно поднимаясь к средним отделам и верхнему полюсу с ее последующей отсепаровкой и удалением. После отсечения миндалины выполняли тщательную ревизию ниш.
Болевой синдром оценивали через сутки после тонзиллэктомии по визуальной аналоговой и цифровой рейтинговой шкалам. Интенсивность боли измеряли в миллиметрах. Вычисляли среднее значение интенсивности для каждого пациента. ВСР оценивали по результатам периоперационного холтеровского мониторирования электрокардиограммы. Так, рассматривались следующие параметры ВСР:
- SDNN – стандартное отклонение всех интервалов NN;
- SDANN – стандартное отклонение средних значений SDNN;
- SDNNidx – триангулярный индекс, характеризующий общее состояние ВСР;
- rMSSD – коэффициент, характеризующий высокочастотный компонент.
Результаты обрабатывались с помощью программ Statistica 8.0 и Microsoft Exel.
Результаты
В первой группе отсутствие болевого синдрома или слабую боль после тонзиллэктомии отметили 40,0% пациентов, среднюю боль – 37,0%, сильную и очень сильную – 14,0 и 9,0% соответственно (табл. 1). Во второй группе 15,9% не испытывали боли или она была слабой, у 34,8% отмечалась боль средней интенсивности, у 39,1% – сильная боль, у 10,2% – очень сильная (табл. 1).
Статистический и аутокорреляционный анализ ВСР у пациентов, перенесших тонзиллэктомию, за первые сутки после хирургического вмешательства показал, что большее напряжение вегетативной нервной системы наблюдалось у тех, кому проводилась местная инфильтрационная анестезия. Так, показатели SDNN и SDANN во второй группе оказались ниже нормальных значений – 107 ± 28,6 и 85,43 ± 22,83 мс соответственно (p < 0,05). В то же время в первой группе ниже референсных значений был лишь показатель SDANN (101,87 ± 18,6 мс), SDNNidx и rMSSD превысили норму – 77,63 ± 14,17 и 57,18 ± 10,44 мс соответственно (p < 0,05) (табл. 2).
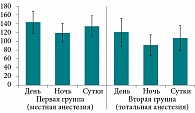
Значения суточных показателей SDNN в первой группе были достоверно выше, чем во второй (p < 0,05). Однако во второй группе наблюдалась большая его вариабельность. При сравнении дневных и ночных показателей SDNN между группами различий не выявлено (p < 0,05) (табл. 2, рис. 1).
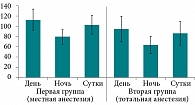
Суточные показатели SDANN в первой группе были достоверно выше, чем во второй (p < 0,05). Значения SDANN в обеих группах за ночь были достоверно ниже, чем за период бодрствования (p < 0,05) (табл. 2, рис. 2).
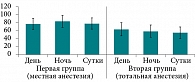
Суточные показатели SDNNidx в первой группе были достоверно выше, чем во второй (p < 0,05). При сравнении дневных значений SDNN между группами различий не выявлено (p < 0,05). Однако ночные значения SDNNidx во второй группе были достоверно ниже, чем в первой (p < 0,05). Различий в дневных и ночных значениях в каждой из групп не зафиксировано (p < 0,05) (табл. 2, рис. 3).
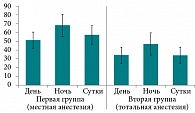
Суточные показатели rMSSD в первой группе были достоверно выше, чем во второй (p < 0,05). При сопоставлении дневных и ночных значений rMSSD между группами наблюдалось их стойкое повышение в первой группе (p < 0,05). В каждой группе ночные показатели достоверно превышали дневные (p < 0,05) (табл. 2, рис. 4).
Обсуждение
Особое внимание уделяется оценке стандартного отклонения от средней длительности всех синусовых интервалов (SDNN) – интегрального показателя, характеризующего ВСР в целом за период записи и зависящего от воздействия как симпатического, так и парасимпатического отдела вегетативной нервной системы [29]. Согласно данным SDNN за сутки, во второй группе наблюдалось преобладание тонуса парасимпатической нервной системы (рис. 1).
Стандартное отклонение средних значений SDNN из пятиминутных сегментов за сутки (SDANN), по сравнению с SDNN, точнее показало степень выраженности парасимпатической нервной системы в обеих группах. Так, во второй группе отмечалось более выраженная парасимпатикотония.
Увеличение суточного rMSSD у пациентов, перенесших тонзиллэктомию под местной анестезией, говорит о преобладании парасимпатического контура вегетативной нервной системы. Об этом же свидетельствует и повышение дневных и ночных показателей rMSSD в первой группе (рис. 4).
SDNNidx, имеющий непосредственную корреляционную зависимость от низкочастотного компонента сердечного ритма, являющийся маркером симпатического отдела вегетативной нервной системы, в первой группе достоверно превышал нормальные значения и показатели второй группы за сутки и ночной период (табл. 2).
Данная картина ВСР у пациентов первой группы может свидетельствовать о нестабильности вегетативной нервной системы в ответ на стрессовое воздействие (хирургическое повреждение тканей, интраоперационный и последующий болевой синдромы и др.). Преобладание ваготонии у пациентов, перенесших тонзиллэктомию под действием тотальной анестезии, скорее всего обусловлено влиянием на вегетативную нервную систему пропофола. Так, результаты ряда исследований показали, что пропофол подавляет активность парасимпатической и симпатической нервной систем, в большей степени активность последней [34–36].
Выводы
Анализ полученных данных позволяет говорить об очевидном преимуществе тотальной анестезии при тонзиллэктомии перед классическим местным инфильтрационным монообезболиванием. Однако необходим дальнейший поиск медикаментозных средств для общей анестезии при тонзиллэктомии, характеризующихся равномерным влиянием на баланс вегетативной нервной системы и не вызывающих активации одной из ее частей.
V.I. Popadyuk, M.V. Iljinskaya, O.A. Shevelyov, I.V. Kastyro
Peoples’ Friendship University of Russia
Contact person: Valentin Ivanovich Popadyuk, lorval04@mail.ru
Objective – to evaluate the intensity of acute pain and the changes in heart rate variability.
Material and methods. We evaluated two methods of anesthesia during tonsillectomy (group 1 – local application of infiltration anesthesia (LA), 30 patients; group 2 – the combination of LA and total anesthesia, 35 patients). LA in all cases was manage 1% lidocaine. Pain intensity was evaluated a visual analogue scale and is measured in millimeters. Heart rate variability was measured by the results of the perioperative ECG Holter monitoring.
Results. In group 1 there was a high intensity of pain. Higher tension of the autonomic nervous system registered in group 1, according to the analysis of SDNN, SDANN, SDNNidx, rMSSD. In the first group tended to sympathicotony and in the group with total anesthesia – parasimpathicotony.
Conclusion. When using only local anesthesia for tonsillectomy causes severe stress reaction, compared
with the total anesthesia. It is necessary to continue the search for anesthetic agents that will minimize
the stress response during tonsillectomy.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.