Эректильная дисфункция и необструктивное бесплодие. Уденафил – разумный выбор
- Аннотация
- Статья
- Ссылки
- English



Распространенность и причины мужского бесплодия в России
В России вопросами мужского бесплодия, так же как и вопросами эректильной дисфункции – одного из самых сложных и распространенных сосудистых заболеваний, традиционно занимаются урологи.
Если проанализировать современную структуру мужского бесплодия, то не менее 30% всех случаев мужской инфертильности прямо или косвенно вызваны гормональными причинами, а гипогонадизм среди причин мужского бесплодия стоит на третьем месте после идиопатического бесплодия и бесплодия, ассоциированного с варикоцеле [1]. Среди пациентов с тяжелыми нарушениями сперматогенеза, например олигозооспермией и необструктивной азооспермией, распространенность гипогонадизма достигает 45%.
В России самый высокий процент (до 60%) так называемого неуточненного (идиопатического) бесплодия у мужчин по сравнению, например, с Европой (30–41%). Идиопатическое мужское бесплодие с точки зрения уролога – это бесплодие без выявляемых урологических причин (варикоцеле, хроническая инфекция половых придаточных желез, антиспермальные антитела). Если урологические причины бесплодия не обнаружены, дальнейшая диагностика и, соответственно, лечение не проводятся.
Бесплодие и окислительный стресс
Окислительный стресс не только наблюдается абсолютно при всех формах бесплодия, за исключением аплазии семявыносящего протока, но и лежит в основе патогенеза мужского бесплодия. Так, окислительный стресс приводит к нарушению энергетического обмена в сперматозоиде, недостаточному поступлению жирных кислот и глюкозы в митохондрии сперматозоида, малой подвижности сперматозоидов, изменению морфологии сперматозоидов (повреждение ДНК).
Выраженность окислительного стресса всегда усугубляется повышенным уровнем фолликулостимулирующего гормона. Последний является плохим прогностическим признаком в отношении медикаментозного лечения бесплодия и признан маркером гибели сперматогенного эпителия, которая сопровождается выбросом в кровь цитокинов и протеиназ, усиливающих агрессивное действие свободных радикалов.
Бесплодие и эректильная дисфункция
Нередко бесплодие сочетается с эректильной дисфункцией, которая может носить как органический, так и психогенный характер, поскольку бесплодие в паре – это стрессорный фактор, особенно для мужчин. Согласно результатам первого в России крупного эпидемиологического исследования среди урологически здоровых мужчин в возрасте от 20 до 75 лет, только у 10,1% опрошенных мужчин отсутствовали признаки эректильной дисфункции. Соответственно распространенность эректильной дисфункции разной степени выраженности составляла 89,9% (в том числе в 71,3% случаев – легкая, 6,6% – средняя, 12% – тяжелая) [2].
Эректильная дисфункция при бесплодии
Общепризнанным «золотым стандартом» фармакотерапии первой линии эректильной дисфункции являются ингибиторы фосфодиэстеразы пятого типа (ФДЭ-5) [3]. Клиническая эффективность и возможные побочные эффекты ингибиторов ФДЭ-5 в каждом конкретном случае могут различаться. Это связано с индивидуальными особенностями экспрессии всех изоформ ФДЭ-5, на которые ингибиторы ФДЭ-5 оказывают свое потенциальное влияние. Полагаем: может наступить время, когда ингибиторы ФДЭ-5 будут подбираться индивидуально на основании генетического обследования (фармакогенетики), однако пока следует ориентироваться на известные фармакокинетические свойства ингибиторов ФДЭ-5.
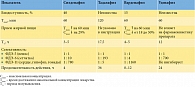
В настоящее время установлено, что только один ингибитор ФДЭ-5 – уденафил – не оказывает ингибирующего действия на ФДЭ-11, которая находится в гонадах, в связи с чем данный препарат не обладает тестикулярной токсичностью (таблица). Меньшая селективность к ФДЭ-11 обусловливает большую безопасность в отношении сердца, гипофиза, гонад. Отсутствие проявлений тестикулярной токсичности на фоне приема уденафила до последнего времени являлось фармакокинетическим фактом, не подтвержденным в работах, анализирующих клинический опыт применения препарата. В этой связи назрела необходимость оценки данного преимущества уденафила в рутинной практике.
Рассмотрим клиническое наблюдение – опыт применения уденафила у пациента с выраженной олигоастеноспермией. Отметим: если у пациента с бесплодием выявляется олигоастеноспермия с повышенным уровнем фолликулостимулирующего гормона, то он направляется в клинику экстракорпорального оплодотворения (ЭКО) без подготовки, что в последующем приводит к достаточно низкой результативности процедуры. Между тем эффективность ЭКО значительно повышается после несложной медикаментозной подготовки, направленной на нивелирование окислительного стресса и улучшение кровотока.
Клинический пример
Пациент П. 1982 г.р. из Ярославля 14.04.12 обратился в клинику по поводу бесплодия в браке в течение пяти лет, эректильной дисфункции, ожирения.
Анамнез
В течение пяти лет пациент наблюдался по месту жительства у уролога по поводу азооспермии. Ему была выполнена тестикулярная биопсия, при морфологическом исследовании материала сперматозоиды не обнаружены (спермограмма от 24.11.11). Семейной паре предложена инсеминация донорской спермой, от которой пациент и его жена отказались.
При осмотре в клинике
Эректильная дисфункция – по шкале твердости эрекции твердость полового члена второй степени (пенис твердый, но недостаточно твердый для пенетрации) (рис. 1). Окружность талии 106 см (норма до 93 см), масса тела 111 кг. Методом биоимпедансометрии (количественный состав тела) было установлено, что количество жировой клетчатки превышает допустимые нормы в два раза (31,7 кг при норме содержания жировой ткани 15,1 кг). Это может служить как самостоятельной причиной окислительного стресса, так и усугублять окислительный стресс другой этиологии.
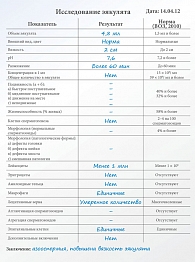
Пациенту была выполнена повторная спермограмма, подтвердившая полное отсутствие сперматозоидов (спермограмма от 14.04.12). Принимая во внимание азооспермию, пациенту было проведено гормональное обследование (анализ на гормоны). У пациента был изолированно повышен фолликулостимулирующий гормон, что свидетельствовало о гибели сперматогенного эпителия яичек.
У пациента также был выявлен андрогенный дефицит – дефицит тестостерона, приводящий к метаболическим нарушениям во всех органах и тканях, в том числе в ткани сперматогенного эпителия, необходимого для пролиферации и кинеза половых клеток. Кроме того, у пациента был повышен свободный трийодтиронин в связи с дефицитом метаболически важного микроэлемента – йода, участвующего в синтезе тиреоидных гормонов, в связи с чем пациент был дополнительно обследован эндокринологом.
Говоря об ожирении как о проблеме XXI века, неразрывно связанной с дефицитом тестостерона и эректильной дисфункцией, следует помнить и об окислительном стрессе, прогрессивно нарастающем вслед за увеличением количества жировой клетчатки и негативно влияющем на все этапы сперматогенеза. В данном клиническом случае маловероятно, что только наличие ожирения, андрогенного дефицита и дефицита йода, усугубляющих окислительный стресс, стало причиной повышения уровня фолликулостимулирующего гормона. Окислительный стресс оказывает губительное воздействие на уцелевшие островки сперматогенеза в извитых канальцах яичка. Помимо ослабления антиоксидантной защиты организма у пациентов с ожирением истощается и система синтазы оксида азота на фоне андрогенного дефицита, провоцируя дефицит вазодилатирующего оксида азота с возникновением стойкого ангиоспазма под действием вазоконстриктора эндотелиина 1. Данные изменения приводят не только к эректильной дисфункции, но и к генерализованной ишемии, в том числе внутритестикулярной.
Изолированное повышение фолликулостимулирующего гормона, как правило, связывают с перенесенными ранее паротитом, краснухой и генетическими причинами. При формулировке диагноза были указаны все причины бесплодия, это позволило подобрать адекватную патогенетическую терапию.
Диагноз
Гипергонадотропный гипогонадизм (изолированное повышение фолликулостимулирующего гормона). Андрогенный дефицит на фоне ожирения. Эректильная дисфункция органического генеза. Дефицит йода.
Лечение
Возможность медикаментозного влияния на повышенный фолликулостимулирующий гормон у мужчин с азооспермией подвергается сомнению. Подход к каждому пациенту должен быть индивидуальным и патогенетически обоснованным. Необходимо исключить риск возникновения побочных действий в отношении сперматогенеза, в том числе и при азооспермии с повышением фолликулостимулирующего гормона.
Исходя из диагноза и патогенеза заболевания в данном случае основные направления терапии включали борьбу с эндотелиальной дисфункцией, дефицитом тестостерона и оксида азота, а также с окислительным стрессом. Для нормализации уровня тестостерона таким пациентам обязательно назначать стимулирующую терапию с применением препаратов хорионического гонадотропина в дозе от 3000 до 5000 МЕ еженедельно.
Данную терапию можно сочетать с применением трансдермального тестостерона (Андрогеля), который ускоряет процесс cгорания жировой ткани. Хорионический гонадотропин, будучи аналогом лютеинизирующего гормона, стимулирует выработку клетками Лейдига (интерстициальными клетками яичка) тестостерона. Под действием тестостерона в неповрежденных эндотелиальных клетках происходит выделение оксида азота, положительно влияющего на общий тонус сосудов тканей, в том числе и яичка. Все перечисленное приводит к активации нейрональной синтазы оксида азота нехолинергическими неадренергическими нервными окончаниями, которыми богата мочеполовая система [4].
Стоит учитывать тот факт, что у данной группы пациентов отмечаются разной степени выраженности эндотелиальная, нейрональная дисфункции и компенсация дефицита оксида азота происходит медленно, параллельно с репарацией. С целью ликвидации дефицита оксида азота и ускорения репарации патогенетически правильным будет назначение ингибиторов ФДЭ-5. Однако не все ингибиторы лишены отрицательного действия на сперматогенез, а тем более способны улучшать прогноз лечения бесплодия у пациентов с повышенным уровнем фолликулостимулирующего гормона.
На данный момент оптимальным, по нашему мнению, ингибитором ФДЭ-5, оказывающим дополнительное позитивное влияние на сперматогенез, является уденафил. Уденафил, наиболее селективный по отношению к ФДЭ-5, положительно воздействует на эректильную функцию, при этом не влияя отрицательно на сперматогенез за счет отсутствия тропности к ФДЭ-11, находящейся в ткани яичка. Кроме того, установлено, что ингибиторы ФДЭ-5 не только различны по своей селективности, но и имеют неодинаковые антиоксидантные свойства [5]. Сочетание именно этих особенностей уденафила послужило основанием для выбора данного ингибитора. Пациент в дополнение к вышеописанной терапии получал уденафил по 50 мг через день в течение полутора лет.
Оценивая краткосрочные результаты лечения пациента П., хотелось бы отметить значительное улучшение качества его половой жизни. Предсказуемо на фоне лечения у пациента нормализовалась эрекция (четвертая степень твердости полового члена – норма – по шкале степени твердости эрекции) (рис. 2). Первые неожиданные результаты терапии бесплодия были получены через четыре месяца лечения, когда анализы показали наличие сперматозоидов в эякуляте (спермограмма от 29.08.12).
Пациент в течение полутора лет оставался на комбинированной терапии хорионическим гонадотропином (Андрогель был отменен после нормализации массы тела), уденафилом, стандартной витаминотерапии (витаминами А, Е, С) и антиоксидантной терапии (Спермактин).
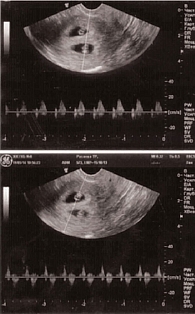
Было проведено исследование ДНК новых сперматозоидов на наличие фрагментации. В ходе диагностического исследования 05.09.13 методом TUNEL было проанализировано 100 сперматозоидов. В 3% выявлена фрагментация ДНК, что является нормой (референсные значения – до 15%). Учитывая полученные результаты, было принято решение о планировании беременности методом ЭКО. В мае 2014 г. жене пациента выполнен протокол ЭКО с переносом двух эмбрионов. При контроле ультрасонографическим методом через шесть недель (19.06.14) определена многоплодная беременность (два эмбриона с отчетливым сердцебиением) (рис. 3).
Заключение
В течение последних 15 лет, прошедших с момента внедрения в клиническую практику первого ингибитора ФДЭ-5, достигнуты значительные успехи в лечении эректильной дисфункции. Однако сегодня требования к фармакотерапии эректильной дисфункции, в том числе к ингибиторам ФДЭ-5, повышаются.
В настоящее время синтезировано несколько молекул ингибиторов ФДЭ-5, отличающихся своими плейотропными эффектами. Уденафил – единственный ингибитор ФДЭ-5, который помимо восстановления половой функции оказывает положительное влияние на сперматогенез. В этой связи его можно рекомендовать в качестве препарата выбора в лечении мужчин с эректильной дисфункцией и бесплодием. Кроме того, уденафил можно использовать в комплексной терапии при подготовке мужчин к ЭКО и интрацитоплазматической инъекции сперматозоида в ооцит, что значительно повышает эффективность этих методов репродукции.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


